修回日期: 2012-08-21
接受日期: 2012-09-03
在线出版日期: 2012-09-28
目的: 以异型性指数, 界定二乙基亚硝胺诱发大鼠肝癌前病变的时效关系与量效关系.
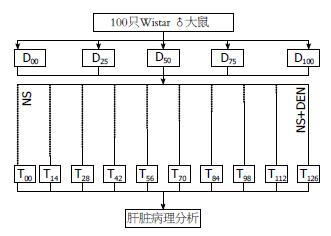
方法: Wistar♂大鼠100只, 体质量均衡随机分5组; 每84 h 1次分别腹腔注射二乙基亚硝胺0、25、50、75、100 mg/kg造模. 每组体质量排序分10小组, 年龄配对; 造模时程最短0 d, 间隔14 d延长, 最长126 d, 灌注固定肝脏. 常规石蜡包埋, 6 μm切片, HE染色, 观察病变性质后显微照相; 使用Image-Pro Plus软件, 分别形态计量10、20、40倍物镜下汇管区(R1)、肝索(R2)、肝细胞核(R3)的体积构成比, 观察每10个高倍镜视野下的核分裂像; 计算各动物异型性指数[Ei = (1-R1)-1•(R3)•(R2)-1]. Prism 4软件回归"二乙基亚硝胺导致异型性指数"的时效曲线及曲线下面积, 进而导致曲线下面积的量效关系.
结果: 以异型性指数(肝细胞核/浆体积比校正值), 回归0、25、50、75、100 mg/kg二乙基亚硝胺造模的半效时程(95%CI)分别为70 347(0-)、1 734(937-3 211)、1 536(948-2 490)、1 530(890-2 632)、1 183(955-1 466)h, 曲线下面积分别为0.0064、0.0084、0.0123、0.0165、0.0167[异型性指数•log(h)]. 以曲线下面积, 回归二乙基亚硝胺诱发肝细胞癌前病变的半效剂量为48.255 mg/kg. 50.000 mg/kg造模各时程的异型性指数与核分裂像总数之间呈直线正相关(y = 0.0023x-0.0056, r = 0.9217, n = 10, P<0.01).
结论: 以异型性指数为指标, 每84 h腹腔注射1次二乙基亚硝胺, 诱发♂大鼠肝细胞癌前病变的最佳造模剂量为48.255 mg/kg(约50.000 mg/kg), 最佳造模累积连续时程为64 d. 核分裂像计数验证了异型性指数的临床预警价值.
引文著录: 宋艺君, 刘晓婷, 冯丽莉, 王湘, 白荟芳, 田民强, 张微, 祖承哲, 赵欣, 蔡大勇, 王玥琦. 二乙基亚硝胺诱发肝癌前病变大鼠模型的建立. 世界华人消化杂志 2012; 20(27): 2562-2569
Revised: August 21, 2012
Accepted: September 3, 2012
Published online: September 28, 2012
AIM: To define diethylnitrosamine-induced hepatic precancerous lesions with atypia index in rats.
METHODS: After normalization of the body weight, 100 male Wistar rats were equally and randomly divided into five groups and were intraperitoneally injected with different doses of diethylnitrosamine in normal saline (0, 25, 50, 75, 100 mg/kg) twice weekly. The rats in each group were further divided into 10 subgroups with end-points ranging from d00 to d126 with an interval of 14 days. Liver samples were fixed, sectioned, and stained with hematoxylin and eosin. After being evaluated pathologically, the volume ratios of portal triad (R1), hepatic cord (R2) and hepatic nucleus (R3) were obtained under an Olympus microscope with 10-, 20-, and 40-amplification, respectively, by use of Image-Pro Plus software. Hepatic mitotic figures were counted under high magnification. The atypia index of hepatocytes was calculated as the volume ratio of nucleus to cytoplasm in precancerous lesions using the formula [(1-R1)-1∙(R2)-1∙(R3)]. By using Graph Pad Prism version 4 for Windows, the half effective durations and the area under curve of the atypia indexes were regressed in Sigmoidal time-response (variable slope) from the logarithm of end-point hours [11.4 + Time (d) ×24 h/d] for each of 5 doses, so did the half effective doses of the area under curves from the logarithm of dosages [10 + Dose (mg/kg) ×1000 (μg/kg)]. The atypia indexes were regressed linearly with the mitotic counts to confirm their specificity in predicting hepatic carcinogenesis.
RESULTS: From the atypia index of hepatocytes (corrected volume ratio of nucleus to cytoplasm), the half effective durations of diethylnitrosamine at 0, 25, 50, 75, and 100 mg/kg to induce hepatic precancerous lesions were 70 347, 1 734, 1 536, 1 530 and 1 183 h, respectively. The areas under curves were 0.0064, 0.0084, 0.0123, 0.0165 and 0.0167 [(atypia index) × log(h)], respectively. From the area under curve, the half effective dose of diethylnitrosamine to induce hepatic precancerous lesions was 48.225 mg/kg. The atypia indexes in rats treated with 50 mg/kg diethylnitrosamine correlated positively with mitotic counts in hepatic precancerous lesions (y = 0.0023x-0.0056, r = 0.9217, n = 10, P < 0.01).
CONCLUSION: The atypia index might be used to define hepatic precancerous lesions. A rat model of hepatic precancerous lesions could be replicated by intraperitoneal injection of diethylnitrosamine at a dose of 48.225 mg/kg twice a week for 9 wk. The specificity of the model to predict hepatic carcinogenesis can be confirmed with mitotic counts in hepatic precancerous lesions.
- Citation: Song YJ, Liu XT, Feng LL, Wang X, Bai HF, Tian MQ, Zhang W, Zu CZ, Zhao X, Cai DY, Wang YQ. Definition of diethylnitrosamine-induced rat hepatic precancerous lesions with atypia index. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2562-2569
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2562.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2562
肝癌发病隐匿、进展迅速、预后极差[1]. 中医临床调整体质, 维持患者自稳调节[2], 防治肝癌疗效特异[3]. 与西医肝癌诊治规范不同, 中医强调治未病[4,5]. 在多种动物模型中, 二乙基亚硝胺(diethylnitrosamine, DEN)诱发大鼠肝癌前病变的阶段性类似人类病程[6]; 前期小鼠实验发现DEN诱导肝癌前病变具有剂量与时程的依赖性[7,8]. 依据临床活检肝细胞癌前病变的形态计量线索[9,10], 本课题采用异型性指数(atypical index, AI)定量DEN诱发大鼠肝癌前病变的强度与时程. 结果显示"异型性指数可特异性界定DEN诱发大鼠肝癌前病变".
♂Wistar大鼠购自北京维通利华实验动物技术有限公司, 体质量134.72 g±8.73 g, 分笼饲养. DEN购自美国sigma公司, 批号1000928405; 德国LETIZ公司FS/FAS5030石蜡切片机等病理科常规设备; 美国Media Cybernetics公司Image-Pro Plus 7.0(7.0.1, 41N70000-60555)软件.
1.2.1 分组及造模: 100只♂大鼠适应性喂养1 wk后, 体质量均衡随机分5组(剂量0、25、50、75、100 mg/kg). 以14 d间隔, 各剂量组按照体质量高低列队分为10个给药时程小组, 每小组2只; 分别于第126、112、98、84、70、56、42、28、14、0 d开始腹腔注射安排剂量的DEN生理盐水, 即年龄配对分别造模处理0、14、28、42、56、70、84、98、112、126 d(图1). 末次注射后84 h, 腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉, 放血处死大鼠, 7%体质量的肝素化生理盐水冲洗残留血液, 14%体质量的中性福尔马林灌注固定; 解剖取出肝脏, 中性福尔马林固定24 h.
1.2.2 病理观察: 中性磷酸盐缓冲液清洗固定肝脏, 取肝脏右叶中部, 切取2 mm×4 mm×6 mm组织块; 常规石蜡包埋, 6 µm切片; 同步烤片、脱蜡、梯度乙醇水化, HE染色. 20倍物镜下光镜观察质控苏木素分化时间(4 s最清晰). 梯度乙醇脱水、二甲苯透明、树脂封片; 光镜下胞浆红染, 核蓝染. 病理评价肝病变的性质和程度, 确定合适形态计量的具体条件.
1.2.3 形态计量: Olympus显微镜10、20、40倍物镜下, 分别获得5视野的显微照片. 使用Image-Pro Plus显微分析系统, 分别形态计量10倍物镜下汇管区(R1)、20倍物镜下肝索(R2)、40倍物镜下增生肝细胞核(R3)的体积构成比, 面积比3/2次方. 各动物5视野几何平均值为数据, 2动物几何平均值为统计数据.
1.2.4 核分裂像计数: 在40倍物镜下, 计数肝小叶区域50个高倍镜视野的核分裂像总数, 回归分析每个高倍镜视野核分裂像数与异型性指数之间的相关性, 确定异型性指数对癌变可能性的预测程度.
1.2.5 数据处理: (1)异型性指数: 按公式[Ei = (1-R1)-1•(R3)•(R2)-1]计算动物肝细胞异型性指数. 其中, (1-R1)代表肝小叶体积比, R2代表肝索体积比, R3代表肝细胞核体积比; 计算值代表肝小叶范围内的、肝细胞核对肝细胞浆的体积比; (2)时效关系: 对数(11.4+24×天数)转化为小时时程. Prism 4软件连续可变斜率模式, 回归异型性指数与造模处理对数小时时程之间的时效曲线, 获得最大异型性指数的半效时程及其95%的可信区间. 采用曲线下面积分析模式, 获得各剂量组曲线下面积(AUCi); (3)量效关系: 按对数[10+D(mg)×1 000]转化给药剂量, 即对数微克剂量, 设定实际未给药具有1的对数剂量效能. Prism 4软件连续可变斜率模式, 回归AUCi与对数效能剂量之间的量效曲线, 获得造模导致异型性指数的半效剂量及95%的可信区间; (4)直线相关: Excel软件分析剂量与体质量变化或核分裂像计数与异型性指数的直线相关.
统计学处理 用mean±SD表示各组计量数据, t检验进行组间比较, P<0.05表示差异有统计学意义.
2.1.1 0 mg/kg剂量组: 大鼠正常生长, 活动自如, 皮毛光泽, 饮食活跃, 大便正常, 体质量渐增. 肝脏淡红色, 无纹理, 质地柔软, 无显著病变.
2.1.2 25 mg/kg剂量组: 大鼠早期活动自如, 皮毛光泽; 后期萎靡不振, 被毛蜷曲, 食欲不振, 精神萎靡, 体质量增长减慢. 肝脏早期黄斑, 中期粘连粗糙, 后期质硬、结节伴腹水.
2.1.3 50 mg/kg剂量组: 大鼠前期活动自如; 中后期活动减少, 被毛粗糙, 食欲不振, 精神萎靡, 体质量增长减慢. 肝脏早期混浊, 中期叶间粘连, 后期质硬、结节伴腹水.
2.1.4 75 mg/kg剂量组: 大鼠前期活动自如; 中后期活动减少, 被毛粗糙, 进食量下降, 体质量增长减慢. 肝脏早期混浊, 中期叶间粘连, 后期质硬、结节伴血性腹水.
2.1.5 100 mg/kg剂量组: 大鼠前期活动减少, 被毛萎黄, 精神萎靡; 后期目光呆滞, 微微发抖, 蜷缩成团, 呈濒死状态. 肝脏早期黄斑, 中期结节状, 后期质硬结节伴血性腹水.
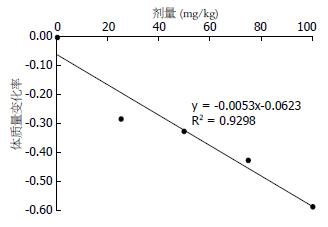
造模剂量与体质量变化率(表1)呈负相关(y = -0.0053x-0.0623, r = 0.9643, n = 5, P<0.01, 图2).
0 mg/kg组各时程肝组织病变轻微, 可找到灶性细胞水肿、小滴脂变或点状坏死. 25、50 mg/kg组随时程, 肝组织有"变质-纤维化-肝硬化-异型增生"等阶段性病变. 75、100 mg/kg组随时程, 肝组织"阶段性病变"出现早、程度重.
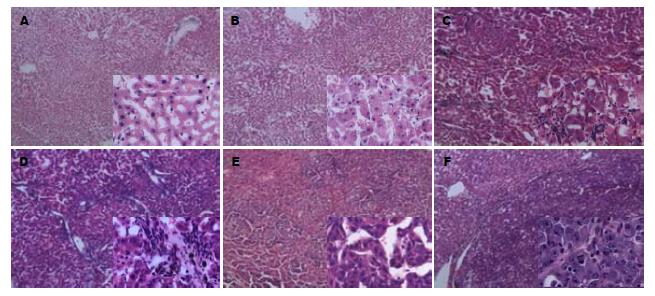
2.2.1 正常结构: 见于零剂量组和各剂量组造模零时程大鼠(图3A). (1)肝小叶: 肝索与肝窦面积比约为2/3; 以中央静脉为中心, 肝细胞索放射状排列; 相邻肝板网状连接, 延伸到周边的肝小叶界板. 肝血窦见内皮细胞、枯否氏细胞与储脂细胞, 腔内可残留血细胞; 无水肿, 无出血. 肝细胞浆均质红染, 核圆形居中, 染色质蓝色随年龄有加深趋势, 核体积随年龄有增大趋势; 可找到灶性细胞水肿或小滴脂变; (2)汇管区: 肝动脉、门静脉与胆管的肝内分支位于少量结缔组织之间, 无炎性细胞浸润, 无水肿, 无出血, 无胆汁淤积等病变.
2.2.2 变质病变: 见于DEN给予组早期大鼠(图3B). (1)肝小叶: 肝细胞索与肝血窦面积比约为2/5; 肝细胞索排列紊乱, 体积增加; 肝血窦被压狭窄, 可见内皮细胞水肿、枯否氏细胞增生与储脂细胞水肿, Diss腔内可找到水肿或出血. 肝细胞浆内出现分布均匀的红染颗粒, 甚至胞浆疏松化或气球样变; 核无显著变化, 但位置随细胞水肿加重偏离中心. 肝细胞的小滴脂变有增多加大的趋势; (2)汇管区: 肝动脉、门静脉与胆管无显著病变; 结缔组织内出现轻度水肿, 中重度炎性细胞浸润, 无出血、无胆汁郁积.
2.2.3 纤维化: 见于DEN给予组中期大鼠(图3C). (1)肝小叶: 肝索与肝窦面积比约为2/5; 肝细胞索排列紊乱, 体积回降; 被压肝血窦狭窄有缓解. 肝细胞水肿有所减轻, 核染色加深、体积增大、可见双核, 核形态无显著扭曲, 肝细胞的小滴脂变增多加大; (2)汇管区: 肝动脉与门静脉无显著病变, 胆管增生明显; 淋巴细胞为主的炎性细胞浸润显著, 胶原纤维增生明显, 纤维条索向肝小叶内延伸, 但未能完全分割肝小叶. 可找到毛细胆管与肝细胞郁胆.
2.2.4 肝硬化: 见于DEN给予组中晚期大鼠(图3D). (1)假小叶: 肝细胞索与肝血窦面积比约为1/3; 肝细胞索排列紊乱, 肝血窦狭窄. 肝细胞水肿减轻, 核染色加深、体积增大、双核多见, 部分核形状改变; 大多数假小叶大部分为新生肝细胞. 肝细胞小滴脂变与细胞水肿加重; (2)汇管区: 纤维增生、炎性细胞浸润与胆管增生明显; 增生胶原纤维条索向肝小叶内延伸, 已完全分割肝小叶, 形成假小叶. 毛细胆管与肝细胞胆汁郁积.
2.2.5 异型性增生: 见于DEN组晚期大鼠(图3E). (1)假小叶: 肝细胞索与肝血窦面积比约为1/4, 肝细胞变质与增生病变并存; 变质主要为肝细胞的小滴脂变、细胞水肿与点状坏死, 部分坏死累及假小叶界板(碎片状坏死); 增生肝细胞浆偏碱性染色, 核染色加深、体积增大、双核多见,核外形可见明显扭曲; 8只大鼠出现肝细胞癌病灶; (2)纤维间隔: 纤维增生、炎性细胞浸润与胆管增生明显; 增生胶原纤维条索已完全分割肝小叶, 形成假小叶. 毛细胆管与肝细胞胆汁郁积显著. 尽管只取材了右叶中部1组织块, 给予DEN的72只大鼠中, 中高剂量组8只大鼠出现了肝细胞癌病灶(图3F).
2.3.1 汇管区体积比: 随时程汇管区体积比增加(表2), 代表沉积胶原纤维增生. 其中, 5剂量组分别为0.09%-0.35%、0.09%-0.43%、0.06%-1.55%、0.08%-1.79%和0.10%-2.24%.
| 剂量(mg/kg) | 时程(log(h)) | 体积比 | 异型性指数(AI) | 癌变率(P/T) | ||
| 汇管区(R1) | 肝索(R2) 肝细胞核(R3) | |||||
| 0 | 1.056905 | 0.0009 | 0.3991 | 0.0009 | 0.0021 | 0/2 |
| 2.540830 | 0.0009 | 0.4294 | 0.0010 | 0.0023 | 0/2 | |
| 2.834675 | 0.0011 | 0.5066 | 0.0015 | 0.0030 | 0/2 | |
| 3.008345 | 0.0011 | 0.5143 | 0.0017 | 0.0034 | 0/2 | |
| 3.132067 | 0.0020 | 0.5696 | 0.0019 | 0.0033 | 0/2 | |
| 3.228246 | 0.0020 | 0.5782 | 0.0022 | 0.0037 | 0/2 | |
| 3.306939 | 0.0035 | 0.4176 | 0.0016 | 0.0038 | 0/2 | |
| 3.373537 | 0.0033 | 0.4858 | 0.0019 | 0.0040 | 0/2 | |
| 3.431267 | 0.0034 | 0.5008 | 0.0021 | 0.0042 | 0/2 | |
| 3.482216 | 0.0035 | 0.5159 | 0.0031 | 0.0061 | 0/2 | |
| 25 | 1.056905 | 0.0009 | 0.4585 | 0.0009 | 0.0020 | 0/2 |
| 2.540830 | 0.0010 | 0.5127 | 0.0010 | 0.0020 | 0/2 | |
| 2.834675 | 0.0013 | 0.5581 | 0.0020 | 0.0035 | 0/2 | |
| 3.008345 | 0.0018 | 0.5771 | 0.0031 | 0.0053 | 0/2 | |
| 3.132067 | 0.0023 | 0.6489 | 0.0042 | 0.0064 | 0/2 | |
| 3.228246 | 0.0033 | 0.6533 | 0.0057 | 0.0087 | 0/2 | |
| 3.306939 | 0.0035 | 0.6636 | 0.0059 | 0.0090 | 0/2 | |
| 3.373537 | 0.0039 | 0.6691 | 0.0061 | 0.0092 | 0/2 | |
| 3.431267 | 0.0041 | 0.6822 | 0.0073 | 0.0108 | 0/2 | |
| 3.482216 | 0.0043 | 0.6951 | 0.0081 | 0.0117 | 0/2 | |
| 50 | 1.056905 | 0.0006 | 0.4726 | 0.0013 | 0.0027 | 0/2 |
| 2.540830 | 0.0032 | 0.4205 | 0.0014 | 0.0033 | 0/2 | |
| 2.834675 | 0.0086 | 0.5293 | 0.0024 | 0.0046 | 0/2 | |
| 3.008345 | 0.0092 | 0.5913 | 0.0051 | 0.0087 | 0/2 | |
| 3.132067 | 0.0095 | 0.6802 | 0.0061 | 0.0091 | 0/2 | |
| 3.228246 | 0.0098 | 0.6743 | 0.0075 | 0.0113 | 0/2 | |
| 3.306939 | 0.0101 | 0.7007 | 0.0086 | 0.0125 | 0/2 | |
| 3.373537 | 0.0107 | 0.6377 | 0.0092 | 0.0145 | 0/2 | |
| 3.431267 | 0.0149 | 0.8235 | 0.0118 | 0.0145 | 0/2 | |
| 3.482216 | 0.0155 | 0.7986 | 0.0122 | 0.0155 | 1/2 | |
| 75 | 1.056905 | 0.0008 | 0.5089 | 0.0015 | 0.0029 | 0/2 |
| 2.540830 | 0.0018 | 0.5330 | 0.0019 | 0.0036 | 0/2 | |
| 2.834675 | 0.0111 | 0.6107 | 0.0054 | 0.0090 | 0/2 | |
| 3.008345 | 0.0092 | 0.6822 | 0.0071 | 0.0105 | 0/2 | |
| 3.132067 | 0.0109 | 0.7848 | 0.0106 | 0.0137 | 0/2 | |
| 3.228246 | 0.0097 | 0.7779 | 0.0133 | 0.0173 | 0/2 | |
| 3.306939 | 0.0116 | 0.8084 | 0.0146 | 0.0183 | 0/2 | |
| 3.373537 | 0.0124 | 0.7630 | 0.0164 | 0.0218 | 0/2 | |
| 3.431267 | 0.0172 | 0.8346 | 0.0178 | 0.0216 | 1/2 | |
| 3.482216 | 0.0179 | 0.8352 | 0.0184 | 0.0224 | 1/2 | |
| 100 | 1.056905 | 0.0010 | 0.4129 | 0.0012 | 0.0030 | 0/2 |
| 2.540830 | 0.0011 | 0.4241 | 0.0014 | 0.0032 | 0/2 | |
| 2.834675 | 0.0043 | 0.4833 | 0.0040 | 0.0083 | 0/2 | |
| 3.008345 | 0.0073 | 0.5900 | 0.0077 | 0.0131 | 0/2 | |
| 3.132067 | 0.0119 | 0.6294 | 0.0093 | 0.0150 | 0/2 | |
| 3.228246 | 0.0162 | 0.6230 | 0.0109 | 0.0178 | 0/2 | |
| 3.306939 | 0.0188 | 0.7528 | 0.0144 | 0.0195 | 0/2 | |
| 3.373537 | 0.0190 | 0.7751 | 0.0164 | 0.0216 | 1/2 | |
| 3.431267 | 0.0217 | 0.8012 | 0.0175 | 0.0224 | 2/2 | |
| 3.482216 | 0.0224 | 0.8347 | 0.0184 | 0.0225 | 2/2 | |
2.3.2 肝索体积比: 随时程肝索体积比增加(表2), 代表肝细胞变性和增生. 其中, 5剂量组分别为39.91%-51.59%、45.85%-69.51%、47.26%-79.86%、50.89%-83.52%、41.29%-83.47%.
2.3.3 肝细胞核体积比: 随时程肝细胞核体积比增加(表2), 代表异型性. 其中, 5剂量组分别为0.09%-0.31%、0.09%-0.81%、0.13%-1.22%、0.15%-1.84%、0.12%-1.84%.
2.3.4 异型性指数: 随时程异型性指数增加(表2), 代表总体异型性. 其中, 5剂量组分别为0.21%-
0.61%、0.20%-1.17%、0.27%-1.55%、0.29%-2.24%、0.30%-2.25%.
2.3.5 癌变率: 8只动物发生肝细胞性肝癌(表2), 既代表造模过度的癌前病变, 也预示癌前病变继续进展为癌的可能性. 其中, 5剂量组分别为0/20、0/20、1/20、2/20、5/20.
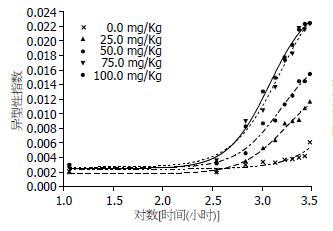
各剂量组对数时程与异型性指数之间存在时效关系, 出现连续可变斜率时效特征(表3)与时效曲线(图4). 其中, 50 mg/kg剂量组大鼠的症状表现, 类似于肝癌前病变患者的证候特征. 各剂量组的AUC分别为0.64%、0.84%、1.23%、1.65%、1. 67%[AI•log(h)].
| 剂量(mg/kg) | 半效时程(h) | 可信限(h) | 时效方程 | R | AUC |
| 0 | 70347(419Ws) | 0-∞ | Y = 0.002398+0.438102/(1+10(7.692189-1.587X)) | 0.9242 | 0.0064 |
| 25 | 1734(10Ws) | 936.5-3211 | Y = 0.00177+0.01276/(1+10(6.309572-1.948X)) | 0.9931 | 0.0084 |
| 50 | 1536(9Ws) | 947.9-2490 | Y = 0.002557+0.016193/(1+10(6.336954-1.989X)) | 0.9935 | 0.0123 |
| 75 | 1530(9Ws) | 889.7-2632 | Y = 0.002698+0.026002/(1+10(5.71389-1.794X)) | 0.9942 | 0.0165 |
| 100 | 1183(7Ws) | 954.9-1466 | Y = 0.002487+0.023033/(1+10(6.428716-2.092X)) | 0.9970 | 0.0167 |
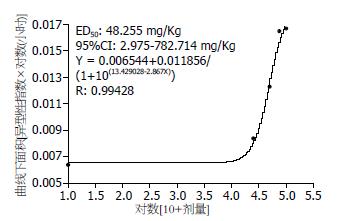
对数剂量与AUC之间存在连续可变斜率的量效曲线(图5). 其半效剂量(ED50)为48.255 mg/kg, 95%可信区间(CI95)为2.975-782.714 mg/kg, 方程式为y = 0.006544+0.011856/(1+10(13.429028-2.867x)), 相关系数的可信程度(R)为0.99428(n = 5, P<0.01).
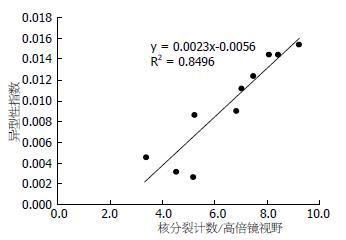
剂量50 mg/kg组各时程的平均核分裂像计数依次为5.15、4.50、3.35、5.20、6.80、7.00、7.45、8.05、8.40、9.20(图6), 与异型性指数呈直线相关(y = 0.0023x-0.0056, r = 0.9217, n = 10, P<0.01).
我国乙型肝炎病毒慢性感染严重, 通过肝硬化癌变率高, 肝癌危害比西方人群严峻[1,2]. 中医强调治未病, 调整体质, 维持稳态, 防治肝癌[3-5]. 尽管病因预防取得显著效应, 迄今仍未明确界定肝细胞的癌前病变特征; 在多种肝癌模型中, DEN诱发肝癌前病变的阶段性特征, 与人类病程类似[6]. 前期DEN诱导性小鼠肝癌前病变具有剂量与时程依赖性[7,8]. 在量效关系与时效关系上, 本课题首次采用AI, 界定DEN诱发大鼠肝癌前病变, 发现AI预警肝癌发病具有特异性[9,10].
具有诱癌和促癌双重效应的DEN[11]提供了同步确定时效与量效的可能性[12]. 本实验探索了肝癌前病变AI的4个特征: (1)立论依据: DEN诱导肝细胞癌变造模大鼠的基本特征包括体质量变化、症状表现、肝脏解剖形态、肝脏组织结构等观察, 符合循证医学兼顾遗传易感与环境致病的2类因素[3-5]. 依据癌前病变内涵(癌变可能性高的非肿瘤性病变)和癌细胞多形性特征(相对核体积增大), 消除干扰病变(充血、水肿、变性或坏死)的前提下, "胞核占胞浆的体积比"是探索癌前病变标准化AI的主要思路, 计算AI方程式排除了"肝组织中非肝小叶区"和"肝小叶中非肝细胞成分"的混淆, 提高了AI预警癌变的相对特异性[6-10]; (2)时效关系: 造模初期AI增高平缓, 中期各剂量组均出现AI增高迅速, 后期高剂量组增高减慢; 提示DEN诱导肝细胞癌前病变呈现效应累积. 其中, 50 mg/kg组造模AI效应曲线中段变化率稳定, 是判断防治药效的合适时间窗口, 即每84 h腹腔注射1次, 连续9 wk时药物对肝细胞癌前病变的促进或拮抗作用最为敏感. 这与文献报道DEN诱导肝癌的前期病变相吻合[11,12]; (3)量效关系: 在AI-AUC体现累积效应的前提下, 零剂量AI属于实验动物的自发性病变(不可控的造模干扰), 以理论敏感度提高1 000倍(mg造模按μg计算)设定效能赋值为1(零剂量效应为10 μg/kg), 则实际造模DEN剂量效应是自发病变的增敏倍数. 在量效曲线中, 极低剂量范围(包括零剂量效应)时, 曲线斜率接近0代表2类生物学意义, 其一该数学模拟模式获得了对造模动物自发病变的客观校正, 其二该设定敏感性提高程度使零剂量效应处于"低剂量暴露生物效应(biological effects of low-level exposures, BELLE)"的兴奋效应(hormesis)剂量范围之内, 实质上属于预应激生物保护效应[13]. 当48.255 mg/kg剂量时, 理论曲线斜率1代表该剂量造模动物受额外影响因素的AI变化最为敏感; 以此为中心的曲线中间区域, 确定了肝癌前病变造模的可使用DEN剂量范围[12]. 极高剂量范围(包括效应最大值剂量)时, 曲线斜率也接近0的生物学意义提示再追加造模剂量, 肝癌前病变效应不会相应增加; 实际上动物在发生癌前病变之前就出现中毒死亡[7,11]; (4)特异性: 为了验证AI预警肝癌发生可能性的特异性, 实验设计的最长时程最高剂量造模动物应有接近5%的癌变发生率. 在实验终点8只大鼠出现癌变病灶的前提下, 对接近最佳DEN造模剂量的50 mg/kg组动物肝组织增生区(非癌变)进行核分裂像计数, 发现该数值与AI之间存在高度正相关; 确认了DEN造模9 wk对预警肝癌的特异性. 除细胞浆淡染外(糖原增加所致), 肝细胞分裂像总数包括4期核变化, 即前期(染色体形成, 核膜与核仁消失)、中期(染色体排列在赤道板)、后期(离开赤道板向2极分开的2套染色体,图3F右下插图中间区)与末期(核膜与核仁出现,2个核均含染色质)[14]; 其中, 在短时程造模动物多见末期核分裂像(相对于AI), 明显偏离回归直线.
形态学变化提示DEN诱发肝癌前病变, 除突变理论外, 符合基因组不稳定、克隆选择、体细胞选择、组织器官化的概念[15]; 本实验动物分别表现为病理核分裂像多见、单只动物癌变病灶细胞类型相似、癌变病灶与正常组织之间具有演变阶段性、从肝硬化癌变后相对形态稳定. 病灶内及周边过渡区存在巨噬细胞与淋巴细胞, 与病变扩大关系密切, 提示该癌变机制中存在促癌炎症[16,17]. DEN广泛作用于生物分子(DNA、RNA、蛋白质和脂质), 起到诱癌和促癌的双重作用, 引发肝细胞通过肝硬化再发生癌前病变[6,7,11], 以AI同步确定DEN造模的量效关系与时效关系, 造模过程"简便快捷"[18]. HE染色形态计量为核心指标, 界定了肝细胞癌前病变的阶段性特征[19], 在软件帮助下观察方法"普及易行"[20].
本实验以AI同步确定了DEN诱发大鼠肝癌前病变的时效关系与量效关系, 用核分裂像相关分析验证了AI预警肝癌发生可能的特异性. 即每84 h腹腔注射48 mg/kg DEN 1次, 连续9 wk, 癌前病变肝细胞的核/浆体积比校正值约为1%; 追加因素增减异型性指数的变化幅度最大, 可看作一种实用的肝癌前病变模型. 结合血清生物标志物[21]或修饰物[22]检测, 将为预防肝癌循证医学研究, 提供合适的动物模型[23]. 结合原位调控分子计量[24], 将为优选患者个性化干预措施, 提供可借鉴的病理生理途径[25]. 同时为中医按证候[5]采用方剂治疗提供研究思路和观察对象[3,4,26], 以此探索预防肝癌的新思路[27].
肝癌前病变是肝癌发生之前的非肿瘤性病理变化, 缺乏形态学诊断标准. 我国乙型肝炎病毒慢性感染严重, 通过肝硬化癌变率高, 肝癌危害比西方人群严峻. 中医强调治未病, 调整体质, 维持稳态, 防治肝癌. 尽管预防取得显著效应, 迄今仍未明确界定肝细胞的癌前病变特征.
蔡三军, 主任医师, 复旦大学附属肿瘤医院大肠外科
肝癌属于多基因遗传与多环境因素致病的恶性肿瘤, 预防策略有待确定.
二乙基亚硝胺具有诱癌与促癌的双重作用, 是诱发肝癌前病变的刺激物.
本研究依据循证医学, 结合临床线索, 提出了肝癌前病变异型性指数的形态学概念; 运用形态计量软件, 检测计算肝细胞核/浆体积比的校正值, 该异型性指数能特异性预警肝癌发病的可能性, 可确定二乙基亚硝胺诱发肝癌前病变的时效关系与量效关系.
肝癌前病变异型性指数奠定了肝癌预防研究的形态学基础, 可应用于发病机制分析、药理效应评价和风险因素评估.
肝癌前病变异型性指数: 是消除了汇管区与肝血窦病变影响因素的、非肿瘤性增生肝细胞核与肝细胞浆的体积比.
本研究设计科学合理, 文章结构清晰, 结果结论明确.
编辑: 李军亮 电编:闫晋利
| 1. | Sato K, Mori M. Evolving molecular mechanism-based strategies for control of hepatocellular carcinoma. Curr Med Chem. 2011;18:4375-4388. [PubMed] [DOI] |
| 2. | European Association For The Study Of The Liver; European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56:908-943. [PubMed] |
| 3. | Li Y, Martin RC. Herbal medicine and hepatocellular carcinoma: applications and challenges. Evid Based Complement Alternat Med. 2011;2011:541209. [PubMed] |
| 4. | Ma L, Wen S, Zhan Y, He Y, Liu X, Jiang J. Anticancer effects of the Chinese medicine matrine on murine hepatocellular carcinoma cells. Planta Med. 2008;74:245-251. [PubMed] [DOI] |
| 5. | 龙 顺钦, 杨 小兵, 吴 万垠, 邓 宏, 河 文峰, 周 宇姝, 廖 桂雅, 欧阳 育树, 蔡 姣芝, 胡 学军. 原发性肝癌的中医体质类型分布及其预后因素分析. 中国肿瘤临床. 2012;39:101-104. |
| 6. | Ogawa K. Molecular pathology of early stage chemically induced hepatocarcinogenesis. Pathol Int. 2009;59:605-622. [PubMed] [DOI] |
| 7. | Kushida M, Kamendulis LM, Peat TJ, Klaunig JE. Dose-related induction of hepatic preneoplastic lesions by diethylnitrosamine in C57BL/6 mice. Toxicol Pathol. 2011;39:776-786. [PubMed] [DOI] |
| 8. | 焦 艺博, 刘 晓婷, 毛 文超, 张 健, 冯 丽莉, 田 民强, 张 东星, 蔡 大勇, 王 玥琦. 姜黄素对二乙基亚硝胺诱发小鼠肝癌前病变的预防作用. 中国药师. 2012;15:1218-1221. |
| 9. | Wen CH, Huang MS, Wang SL, Su YC, Yang SF, Chai CY. Diagnostic value of computerized nuclear morphometry for the prediction of malignancy in liver fine needle aspiration cytology. Acta Cytol. 2009;53:77-82. [PubMed] [DOI] |
| 10. | Cooper LA, Kong J, Gutman DA, Wang F, Gao J, Appin C, Cholleti S, Pan T, Sharma A, Scarpace L. Integrated morphologic analysis for the identification and characterization of disease subtypes. J Am Med Inform Assoc. 2012;19:317-323. [PubMed] [DOI] |
| 11. | Shirakami Y, Gottesman ME, Blaner WS. Diethylnitrosamine-induced hepatocarcinogenesis is suppressed in lecithin: retinol acyltransferase-deficient mice primarily through retinoid actions immediately after carcinogen administration. Carcinogenesis. 2012;33:268-274. [PubMed] [DOI] |
| 12. | Richardson DB, MacLehose RF, Langholz B, Cole SR. Hierarchical latency models for dose-time-response associations. Am J Epidemiol. 2011;173:695-702. [PubMed] [DOI] |
| 13. | Calabrese EJ. BELLE: an evolving legacy. Hum Exp Toxicol. 2010;29:247-248. [PubMed] [DOI] |
| 14. | Rabes HM, Szymkowiak R. Cell kinetics of hepatocytes during the preneoplastic period of diethylnitrosamine-induced liver carcinogenesis. Cancer Res. 1979;39:1298-1304. [PubMed] |
| 15. | Vineis P, Schatzkin A, Potter JD. Models of carcinogenesis: an overview. Carcinogenesis. 2010;31:1703-1709. [PubMed] [DOI] |
| 16. | Schneider C, Teufel A, Yevsa T, Staib F, Hohmeyer A, Walenda G, Zimmermann HW, Vucur M, Huss S, Gassler N. Adaptive immunity suppresses formation and progression of diethylnitrosamine-induced liver cancer. Gut. 2012; Jan 20. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Pinato DJ, North BV, Sharma R. A novel, externally validated inflammation-based prognostic algorithm in hepatocellular carcinoma: the prognostic nutritional index (PNI). Br J Cancer. 2012;106:1439-1445. [PubMed] [DOI] |
| 18. | Al-Rejaie SS, Aleisa AM, Al-Yahya AA, Bakheet SA, Alsheikh A, Fatani AG, Al-Shabanah OA, Sayed-Ahmed MM. Progression of diethylnitrosamine-induced hepatic carcinogenesis in carnitine-depleted rats. World J Gastroenterol. 2009;15:1373-1380. [PubMed] [DOI] |
| 19. | Roncalli M, Terracciano L, Di Tommaso L, David E, Colombo M. Liver precancerous lesions and hepatocellular carcinoma: the histology report. Dig Liver Dis. 2011;43 Suppl 4:S361-S372. [PubMed] [DOI] |
| 20. | Vertemati M, Moscheni C, Petrella D, Lamperti L, Cossa M, Gambacorta M, Goffredi M, Vizzotto L. Morphometric analysis of hepatocellular nodular lesions in HCV cirrhosis. Pathol Res Pract. 2012;208:240-244. [PubMed] [DOI] |
| 21. | Fang M, Dewaele S, Zhao YP, Stärkel P, Vanhooren V, Chen YM, Ji X, Luo M, Sun BM, Horsmans Y. Serum N-glycome biomarker for monitoring development of DENA-induced hepatocellular carcinoma in rat. Mol Cancer. 2010;9:215. [PubMed] [DOI] |
| 22. | Mehta A, Norton P, Liang H, Comunale MA, Wang M, Rodemich-Betesh L, Koszycki A, Noda K, Miyoshi E, Block T. Increased levels of tetra-antennary N-linked glycan but not core fucosylation are associated with hepatocellular carcinoma tissue. Cancer Epidemiol Biomarkers Prev. 2012;21:925-933. [PubMed] [DOI] |
| 23. | Adam AC, Faudou V, Paschen SA, Adam OM, Kahl P, Drebber U, Fischer HP, Büttner R. Hepatocarcinogenesis in non-cirrhotic liver is associated with a reduced number of clonal hepatocellular patches in non-tumorous liver parenchyma. J Pathol. 2012; Jun 11. [Epub ahead of print]. [PubMed] [DOI] |
| 24. | Takahashi M, Shibutani M, Woo GH, Inoue K, Fujimoto H, Igarashi K, Kanno J, Hirose M, Nishikawa A. Cellular distributions of molecules with altered expression specific to the tumor promotion process from the early stage in a rat two-stage hepatocarcinogenesis model. Carcinogenesis. 2008;29:2218-2226. [PubMed] [DOI] |
| 25. | Han ZG. Functional Genomic Studies: Insights into the Pathogenesis of Liver Cancer. Annu Rev Genomics Hum Genet. 2012; Jun 11. [Epub ahead of print]. [PubMed] [DOI] |