修回日期: 2012-08-18
接受日期: 2012-09-03
在线出版日期: 2012-09-18
目的: 观察贝伐单抗治疗转移性结直肠癌(metastatic colorectal cancer, MCC)中高血压的发生情况, 评价其对贝伐单抗疗效的预测价值.
方法: 回顾性分析我院使用贝伐单抗联合化疗治疗的MCC患者中, 不良反应高血压的发生、治疗及转归. 根据是否发生贝伐单抗相关性高血压把患者分为两组, 比较两组疾病控制率(disease control rate, DCR)和无进展生存时间(progression-free survival, PFS).
结果: 40例MCC患者使用贝伐单抗联合化疗治疗, 高血压发生的中位时间为38 d, 发生率为17.5%(7/40), 3级高血压发生率为5.0%(2/40), 无4-5级高血压发生, 降压治疗后血压均可控制. 与未发生高血压患者比较, 发生高血压患者的DCR更高(85.8% vs 60.1%, P = 0.439), PFS(13 mo vs 8 mo, P = 0.191)更长, 但未达统计学差异.
结论: 高血压为贝伐单抗治疗MCC中常见不良反应, 大多为轻-中度, 降压治疗效果好, 但高血压未能显示出对贝伐单抗疗效的预测作用.
引文著录: 杨琳, 蒋月强, 梅齐, 陈元. 转移性结直肠癌治疗中贝伐单抗相关性高血压的发生及意义. 世界华人消化杂志 2012; 20(26): 2525-2528
Revised: August 18, 2012
Accepted: September 3, 2012
Published online: September 18, 2012
AIM: To investigate the incidence and management of bevacizumab-induced hypertension in patients with metastatic colorectal cancer (MCC), and to evaluate its relationship with response to bevacizumab.
METHODS: MCC patients treated with bevacizumab and chemotherapy were retrospectively enrolled in this study. Focus was placed on the patients' blood pressure, corresponding management and clinical outcome. Patients were divided into two groups according to the occurrence of bevacizumab-induced hypertension or not. The disease control rate (DCR) and progression-free survival (PFS) were compared between the two groups.
RESULTS: In total, 40 MCC patients were treated with bevacizumab and chemotherapy. The median time from the initiation of bevacizumab to the beginning of hypertension was 38 days. The incidence of treatment-induced hypertension was 17.5% (7/40). Two patients (5.0%) were classified to have grade 3 hypertension. No grades 4-5 hypertension occurred. Blood pressure was controlled well in 7 patients after corresponding treatment. Patients with bevacizumab-induced hypertension had better DCR (85.8% vs 60.1%, P = 0.439) and PFS (13 mo vs 8 mo, P = 0.191), but there were no statistical differences between the two groups.
CONCLUSION: In MCC patients treated with bevacizumab and chemotherapy, the incidence of treatment-induced hypertension is high. But most of cases are mild to moderate and respond well to proper treatment. Bevacizumab-induced hypertension is not predictive factor of response to bevacizumab.
- Citation: Yang L, Jiang YQ, Mei Q, Chen Y. Bevacizumab-induced hypertension in patients with metastatic colorectal cancer: Its incidence and clinical significance. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2525-2528
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2525.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2525
结直肠癌是人类最常见的恶性肿瘤之一, 其发病率在美国位居恶性肿瘤的前3位[1], 在中国, 居肿瘤相关性死亡率的第5位, 且近年来发病率明显上升[2]. 转移性结直肠癌(metastatic colorectal cancer, MCC)预后很差, 5年生存率约11%. 而贝伐单抗(bevacizumab, avastin)联合化疗无论用于一线还是二线治疗, 均能进一步提高其无进展生存(progression free survival, PFS)和总生存(overall survival, OS)[3,4]. 贝伐单抗是一种人源化的抗血管内皮生长因子(vascular endothelial growth factor, VEGF)单克隆抗体, 他通过阻断VEGF与内皮受体结合, 抑制肿瘤微血管形成[5]. 高血压是贝伐单抗最常见的不良反应. 高血压控制不佳不仅导致心血管事件、肾脏疾病和中风, 而且可能使抗肿瘤治疗中断, 影响临床获益; 另一方面, 高血压被报道可能作为预测贝伐单抗治疗MCC疗效的重要生物指标[6]. 因此, 贝伐单抗相关性高血压日愈被人们所重视. 本研究对我院使用贝伐单抗治疗的MCC患者40例中高血压的情况进行了回顾性分析.
回顾性分析我院2010-02/2012-06应用贝伐单抗联合化疗治疗MCC患者40例, 结肠癌21例、直肠癌19例, 均经病理学确诊. 年龄39-78岁, 平均年龄57.3岁, 男23例, 女17例. 31例为一线治疗, 9例为二线治疗. 使用贝伐单抗治疗中位周期数为6周期(2-21周期), 剂量为7.5 mg/(kg•3 wk). 联合化疗方案包括: FOLFOX(奥沙利铂+四氢叶酸钙+氟尿嘧啶)12例、FOLFIRI(伊立替康+四氢叶酸钙+氟尿嘧啶)20例、XELOX(奥沙利铂+卡培他滨)6例、卡培他滨5例, 3例患者采用1种以上化疗方案. 5例患者既往有高血压病史.
贝伐单抗每次7.5 mg/kg, 联合化疗, 每3 wk为1周期. 每位患者均记录治疗开始前, 治疗开始后(最初3 wk每周至少测量血压3次, 此后每周至少测量血压1次)血压值. 发生高血压则根据通用不良反应术语标准(Common Terminology Criteria for Adverse events, CTCAE)V3.0版进行分级. 记录发生贝伐单抗相关高血压患者的降压治疗方法及血压转归.
患者每6-8 wk行影像学检查, 按照实体肿瘤疗效评价标准(response evaluation criteria in Solid tumors, RECIST)1.0版进行疗效评价, 分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progression of disease, PD). 计算疾病控制率(disease control rate, DCR) = CR+PR+SD. PFS是指从首次用药到疾病进展或因任何原因死亡的时间间隔(以发生在先的事件计算).
统计学处理 应用SPSS13.0软件进行统计分析, 计数资料采用Pearson Chi-Square检验. PFS由Kaplan-Meier曲线计算得到, 二组间比较经Log-rank检验. 均以P<0.05为有统计学差异.
发生贝伐单抗相关高血压7例(17.5%), 高血压出现的中位时间为38 d(8-141 d). 1级患者3例(7.5%), 行生活方式调节后, 2例血压恢复正常, 1例加用硝苯地平缓释片10 mg每日1次后, 血压控制正常; 2级患者2例(5.0%), 1例口服培哚普利4 mg每日1次, 1例口服硝苯地平缓释片10 mg每日2次, 血压控制稳定; 3级患者2例(5.0%), 既往均有高血压病史, 治疗前口服硝苯地平缓释片10 mg每日2次, 发生贝伐单抗相关性高血压后, 加用双氢克尿噻25 mg每日2次+培哚普利4 mg每日1次治疗, 血压得到控制; 无4或5级高血压发生. 无患者因高血压导致贝伐单抗治疗减量或中断.
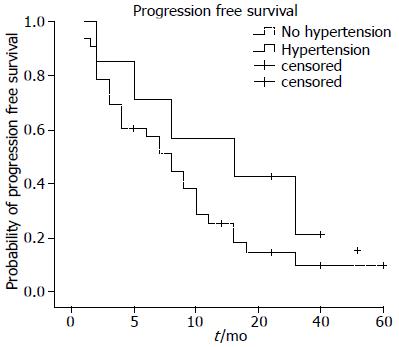
可评价疗效病例40例, 其中CR为2例(5.0%), PR为9例(22.5%), SD为15例(37.5%), PD为14例(35.0%), DCR为65.0%, 中位PFS为9 mo, 中位OS未达到. 发生高血压的7例患者中CR为1例(14.3%), PR为2例(28.6%), SD为3例(42.9%), PD为1例(14.3%), DCR为85.8%, 中位PFS为13 mo. 与未发生高血压的患者比较, 发生高血压患者的DCR(85.8% vs 60.1%)和PFS(13 mo vs 8 mo)更优, 但均未达统计学差异(P = 0.439, P = 0.191, 图1).
2004年贝伐单抗作为第一个抗血管生成药物被批准应用于临床以来, 人们发现靶向血管生成信号通路的药物常常导致高血压[7,8]. 其发病机制可能与体循环血管阻力(systemic vascular resistance, SVR)增加有关[9]. 神经内分泌因子增加 (如肾素、醛固酮、儿茶酚胺类、肾上腺素等)、血管稀疏化、一氧化氮生成减少和内皮功能障碍, 均可导致SVR升高, 最终表现为血压升高.
Zhu等[10]发表的Meta分析显示: 贝伐单抗相关性高血压的总发生率为25%(21%-30%), 低剂量贝伐单抗(每次≤7.5 mg/kg)所致高血压的发生率为2.7%-32.0%; 高剂量贝伐单抗(每次10或15 mg/kg)所致高血压的发生率为17.6%-36.0%. 本研究中患者均采用低剂量贝伐单抗治疗, 贝伐单抗相关性高血压的发生率与文献报道相似. 因此, 对接受贝伐单抗治疗的患者建议有规律的监测血压, 尤其是在治疗的前3 wk.
合理使用降压药物治疗能使绝大多数患者血压得以控制, 从而避免发生相关心脑血管事件, 以及贝伐单抗治疗的减量或停药. 本研究中7例发生贝伐单抗相关高血压的患者在经过合理降压治疗后, 血压均恢复至正常, 无患者因此导致贝伐单抗减量或停药. 由于缺乏对照研究, 目前贝伐单抗相关性高血压的降压治疗并无标准方案. Hedrick等[11]报道, 贝伐单抗相关性高血压患者中27%需要使用降压药, 其中血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors, ACEI)占33.3%, β受体阻滞剂占29%, 利尿剂占26.6%, 钙通道拮抗剂占22.7%, 血管紧张素受体阻断剂(angiotensin receptor blocker, ARB)占15%, 其他药物占9.7%. 对于高血压合并蛋白尿的患者, 可优先选用ACEI和ARB类药物, 以阻断肾素-血管紧张素系统. 需要注意的是, 我国广泛使用的钙离子拮抗剂中二氢吡啶类的硝苯地平以及非二氢吡啶类, 如维拉帕米和地尔硫卓在贝伐单抗相关性高血压中都是不推荐使用或需谨慎使用的, 而其他二氢吡啶类的, 如氨氯地平和非洛地平, 是推荐使用的. 因为硝苯地平据报道能诱导VEGF分泌[12], 可能减弱VEGF单克隆抗体即贝伐单抗抑制肿瘤血管生成的生物作用; 维拉帕米和地尔硫卓是细胞色素氧化酶CYP3A4的抑制剂, 而贝伐单抗需经此酶代谢.
高血压是贝伐单抗作用机制相关性(on-target)的不良反应, 反映出贝伐单抗抑制VEGF信号通路的效果, 人们推测贝伐单抗相关高血压可能作为其临床疗效的预测因子. 最早Scartozzi等[6]报道了39例MCC使用贝伐单抗的患者, 发生2-3级高血压的患者中75%达到PR, 未发生高血压的患者中只有32%(P = 0.004). 随后, Ryanne Wu等[13]回顾性分析84例使用贝伐单抗治疗的MCC患者, 显示发生高血压的患者OS和PFS更长(P = 0.03和P = 0.01). De Stefano等[14]以及Ravaud等[15]的研究也得出了相似的结论. 然而, Hurwitz等[16]的一项回顾性分析包括结直肠、乳腺和肾癌的6个研究共5 900例患者, 显示只有一项研究表明贝伐单抗相关性高血压对患者OS和PFS有预测作用. 不同研究中测量血压的时间和频率、高血压分级标准、分层因素等均不完全相同, 可能导致结果目前存在争议. 本研究中发生高血压患者的DCR和PFS更优, 但未达统计学差异. 这可能与本研究样本量有限、发生贝伐单抗相关性高血压的病例数较少、且为回顾性分析等有关, 进一步开展更大样本、前瞻性、多中心的临床研究是否能肯定贝伐单抗相关性高血压与其疗效之间的相关性, 我们拭目以待.
总之, 高血压是贝伐单抗治疗中常见的不良反应, 需严密监测. 贝伐单抗相关性高血压以轻中度为主, 降压治疗后大多可以控制, 无需调整贝伐单抗剂量或停用. 初步结果显示高血压的发生对贝伐单抗的临床疗效未能显示出预测作用. 随着贝伐单抗应用的日益广泛, 我们期待更多的相关临床研究, 使患者能更安全、更有效的使用此类药物.
贝伐单抗联合化疗能进一步提高转移性结直肠癌患者的无进展生存时间和总生存时间. 高血压是贝伐单抗治疗中最常见的不良反应. 控制不佳的高血压可能导致心脑血管事件和肾脏疾患, 并使抗肿瘤治疗被迫中断.
杨柏霖, 副主任医师, 南京中医药大学附属医院
目前国外学者对贝伐单抗相关性高血压的发生、处理以及其预测肿瘤治疗疗效等方面进行了研究, 以期更安全的使用贝伐单抗, 并能更早预测其疗效, 但结果尚存在争议.
Scartozzi等报道发生2-3级高血压的结直肠癌患者更能从贝伐单抗治疗中获益. Ryanne等研究发现发生贝伐单抗相关性高血压的患者OS和PFS更长. 但Hurwitz等回顾性分析了6项研究, 其中5项均否定了上述结论.
本文首次在中国MCC患者中系统性观察和分析了贝伐单抗相关性高血压的发生、处理、转归, 以及其与贝伐单抗治疗疗效的关系, 积累了贝伐单抗用于亚裔患者的治疗经验.
本研究选题合理, 结果可靠, 对临床医师有很好的参考价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 3. | Giantonio BJ, Catalano PJ, Meropol NJ, O'Dwyer PJ, Mitchell EP, Alberts SR, Schwartz MA, Benson AB. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544. [PubMed] [DOI] |
| 4. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 6. | Scartozzi M, Galizia E, Chiorrini S, Giampieri R, Berardi R, Pierantoni C, Cascinu S. Arterial hypertension correlates with clinical outcome in colorectal cancer patients treated with first-line bevacizumab. Ann Oncol. 2009;20:227-230. [PubMed] [DOI] |
| 7. | Wu S, Chen JJ, Kudelka A, Lu J, Zhu X. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis. Lancet Oncol. 2008;9:117-123. [PubMed] [DOI] |
| 8. | Bamias A, Manios E, Karadimou A, Michas F, Lainakis G, Constantinidis C, Deliveliotis C, Zakopoulos N, Dimopoulos MA. The use of 24-h ambulatory blood pressure monitoring (ABPM) during the first cycle of sunitinib improves the diagnostic accuracy and management of hypertension in patients with advanced renal cancer. Eur J Cancer. 2011;47:1660-1668. [PubMed] [DOI] |
| 9. | Izzedine H, Ederhy S, Goldwasser F, Soria JC, Milano G, Cohen A, Khayat D, Spano JP. Management of hypertension in angiogenesis inhibitor-treated patients. Ann Oncol. 2009;20:807-815. [PubMed] [DOI] |
| 10. | Zhu X, Wu S, Dahut WL, Parikh CR. Risks of proteinuria and hypertension with bevacizumab, an antibody against vascular endothelial growth factor: systematic review and meta-analysis. Am J Kidney Dis. 2007;49:186-193. [PubMed] [DOI] |
| 11. | Miura S, Fujino M, Matsuo Y, Tanigawa H, Saku K. Nifedipine induced vascular endothelial growth factor secretion from coronary smooth muscle cells promotes endothelial tube formation via the kinase insert domain-containing receptor/fetal liver kinase-1/NO pathway. Hypertens Res. 2005;28:147-153. [PubMed] [DOI] |
| 12. | Ryanne Wu R, Lindenberg PA, Slack R, Noone AM, Marshall JL, He AR. Evaluation of hypertension as a marker of bevacizumab efficacy. J Gastrointest Cancer. 2009;40:101-108. [PubMed] [DOI] |
| 13. | De Stefano A, Carlomagno C, Pepe S, Bianco R, De Placido S. Bevacizumab-related arterial hypertension as a predictive marker in metastatic colorectal cancer patients. Cancer Chemother Pharmacol. 2011;68:1207-1213. [PubMed] [DOI] |
| 14. | Ravaud A, Sire M. Arterial hypertension and clinical benefit of sunitinib, sorafenib and bevacizumab in first and second-line treatment of metastatic renal cell cancer. Ann Oncol. 2009;20:966-967; author reply 967. [PubMed] [DOI] |
| 15. | Hurwitz H, Douglas PS, Middleton JP, Sledge GW, Johnson DH, Reardon DA, Chen D, Rosen O. Analysis of early hypertension (HTN) and clinical outcome with bevacizumab (BV). 2010;abstr 3039. |