修回日期: 2012-07-11
接受日期: 2012-08-01
在线出版日期: 2012-09-18
目的: 探讨HER-2蛋白表达与胃癌临床病理特征的关系以及HER-2蛋白表达与基因扩增的关系, 并探讨原发灶与转移灶中HER-2基因扩增及表达的异质性.
方法: 用免疫组织化学(immunohistochemistry, IHC)、荧光原位杂交(fluorescence in-situ hybridization, FISH)检测180例胃癌原发灶及112例转移淋巴结中HER-2的表达情况及基因状态, 将检测结果进行比较, 并与临床病理特征进行统计学分析.
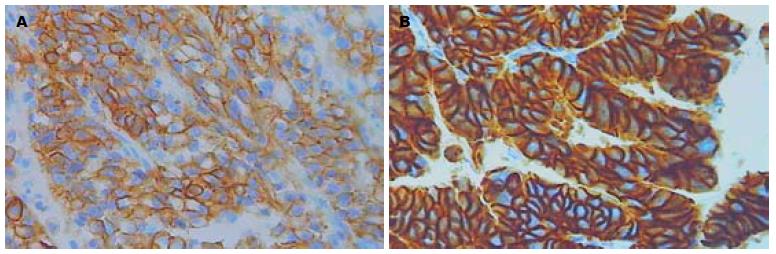
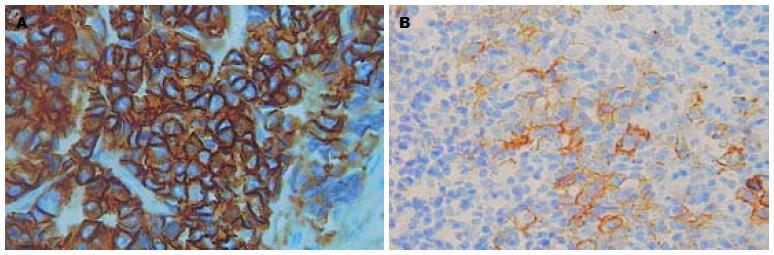
结果: 180例胃癌原发灶IHC染色0、1+、2+及3+的例数分别为139(77.2%)、16(8.9%)、15(8.3%)及10(5.6%), 即HER-2蛋白阳性表达率为13.9%; 112例淋巴结转移灶IHC染色0、1+、2+及3+的例数分别为80(71.5%)、9(8.0%)、14(12.5%)及9(8.0%), 即HER-2蛋白阳性表达率为20.5%, 两者无显著性差异(P>0.05); 原发灶和淋巴结转移灶FISH与IHC阳性符合率分别为84.0%、82.6%; 112例淋巴结转移灶与其对应原发灶相比, 有6例IHC和/或FISH结果不一致, 其中3例发生了蛋白表达的阳性转变, 2例发生了基因状态的阳性转变, 未发现阴性转变; HER-2的表达与TNM分期、Lauren分型、有无淋巴结转移、浸润深度、分化程度有关(P<0.05).
结论: HER-2蛋白过表达与基因扩增有较好的一致性; HER-2过表达与胃癌的浸润和转移有关; HER-2基因扩增及表达在胃癌原发灶与转移灶中具有异质性; 若原发灶HER-2阴性, 应进一步检测转移灶.
引文著录: 张永磊, 花亚伟, 张占东, 马飞, 许家亮. HER-2在胃癌原发灶和转移淋巴结中的表达. 世界华人消化杂志 2012; 20(26): 2485-2490
Revised: July 11, 2012
Accepted: August 1, 2012
Published online: September 18, 2012
AIM: To investigate the expression and amplification status of HER-2 in primary gastric cancer and lymph node metastases and to analyze their association with clinicopathologic features of gastric cancer.
METHODS: The expression and amplification status of HER-2 in primary tumors (n = 180) and metastatic lymph nodes (n = 112) of gastric cancer were detected by immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH). Their association with clinicopathologic features of gastric cancer was analyzed using SPSS17.0.
RESULTS: The positive rate of HER-2 expression in primary tumors and paired lymph node metastases was 13.9% and 20.5%, respectively, with no significant difference between the two groups (P > 0.05). In primary tumors and metastatic lymph nodes, the concordance between HER-2 positivity by IHC and FISH was 84.0% and 82.6%, respectively. There were 6 cases with discordant HER-2 results between primary tumors and matched lymph node metastases, of which 3 were negative for HER-2 overexpression and 2 were negative for HER-2 amplification in primary lesions but showed positive conversion in metastatic lymph nodes. No cases showed negative conversion during the metastatic process. The positive rate of HER-2 was significantly associated with clinical stage, Lauren type, lymph node metastasis, depth of invasion, and degree of differentiation (all P < 0.05).
CONCLUSION: There was a high concordance between IHC and FISH results. HER-2 overexpression is correlated with invasion and metastasis of gastric cancer. HER-2 overexpression and amplification in metastatic sites have heterogeneity compared to primary tumors. HER-2 status should be assessed in metastatic sites if primary tumors are tested negative for HER-2.
- Citation: Zhang YL, Hua YW, Zhang ZD, Ma F, Xu JL. HER-2 amplification and overexpression in primary tumors and paired lymph node metastases of gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2485-2490
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2485.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2485
胃癌是我国发病率最高的消化系统恶性肿瘤, 全世界每年新发的胃癌病例40%以上是在中国, 且大多数胃癌患者发现时已属进展期, 最终多因肿瘤的浸润、转移而死亡, 也因此整体上胃癌治疗效果不佳. 因而寻找、分子水平上的预后指标及治疗手段成为热点, 并在人类表皮生长因子受体家族成员HER-2的研究中取得较大突破. 2009年ToGA试验[1]将曲妥珠单抗成功应用于晚期胃癌的治疗, HER-2基因检测也成为胃癌的常规检查. 目前建立在分子病理分型基础上的生物靶点治疗多用于肿瘤复发、转移患者, 并且人们多依据肿瘤原发灶特异性分子靶点的表达水平来决定转移性肿瘤患者的治疗, 但肿瘤细胞的转移是一个多分子参与的非随机的过程, 肿瘤细胞转移能力的形成是由肿瘤转移异质性决定的. 在乳腺癌[2]中已经证实HER-2基因扩增及表达具有异质性, 并认为其可能是针对HER-2的靶向治疗未达到预期疗效的原因之一. 在胃癌中, 此类研究尚不多; 本研究通过免疫组织化学(immunohistochemistry, IHC)及荧光原位杂交(fluorescence in-situ hybridization, FISH)检测胃癌组织中的HER-2表达情况及基因状态, 分析其与胃癌常见临床病理特征的关系, 比较其在胃癌原发灶与淋巴结转移灶中的差异, 为HER-2靶点治疗药物的临床应用及精确筛选适合靶向治疗的患者提供理论依据.
收集2010-06/2011-09在我院手术切除并经病理组织学确诊的手术胃腺癌组织蜡块标本, 所有患者术前未行化疗、放疗及免疫治疗; 其中癌组织180例, 对应转移淋巴结112例. 180例胃癌中, 男112例, 女68例; 年龄30-79岁(平均59岁); 有淋巴结转移112例, 无淋巴结转移68例; 肿瘤直径>5 cm 86例, ≤5 cm 94例, 有浆膜浸润116例, 无浆膜浸润64例; 按Lauren分型: 肠型62例, 弥漫型102例, 混合型26例; 按WHO组织学分级G1: 19例, G2: 55例, G3/G4: 106例; 按AJCC(2010)病理学分期(pTNM): Ⅰ期17例, Ⅱ期45例, Ⅲ期103例, Ⅳ期15例.
LEICA SM2010R切片机(上海莱卡仪器有限公司), 光学显微镜(日本OLYMPUS), 101型电热鼓风干燥箱(北京市永光明医疗仪器厂), 原位杂交仪ThermoBriteTM(StatSpin, USA), 全自动多功能组织病理检测系统Ventana Bench Mark XT及配套试剂盒. 一抗: Anti-Her-2/neu(4B5)购自德国罗氏诊断有限公司; HER-2基因扩增检测试剂盒(包含GLP HER-2/neu/CSP17探针及GLP杂交缓冲液)购自北京金菩嘉医疗科技有限公司.
1.2.1 HER-2检测: 经10%中性福尔马林固定、石蜡包埋的胃癌组织标本连续切片, 厚度为3-5 μm, 用IHC检测HER-2蛋白. 然后对原发灶和淋巴结转移灶中所有染色结果为1+、2+及3+的病例进行FISH检测, 并在原发灶和转移灶中分别随机挑选15例染色为0的病例行FISH检测, 以作为对照; 再将原发灶与对应转移灶HER-2蛋白表达不一致的病例行FISH检测(与前重复者不做). 使用双盲法由2位有临床经验的病理科医生对IHC染色结果进行判读.
1.2.2 Her-2/neu结果评分标准: 0: 无反应或<10%肿瘤细胞膜染色; 1+: ≥10%肿瘤细胞微弱或隐约可见膜染色, 细胞仅有部分膜染色; 2+: ≥10%肿瘤细胞有弱到中度的基底膜、侧膜或完全膜染色; 3+: ≥10%肿瘤细胞的基侧膜、侧膜或完全膜的强染色. 0、1+为HER-2阴性表达, 2+、3+为HER-2阳性表达. 在100×物镜下观察胃癌细胞核的FISH结果并进行信号计数和比值计数, 计数30个细胞, 统计Ratio值(30个细胞核中红信号总数/30个细胞核中绿信号总数); 结果判断标准: (1)Ratio<1.8为阴性结果, 即无HER-2基因扩增; (2)Ratio>2.2为阳性结果, 即HER-2基因发生扩增; (3)Ratio介于1.8-2.2之间时, 可以选择增加计数细胞至100个, 或重做FISH实验来判断最终结果.
统计学处理 所有数据使用SPSS17.0软件进行统计学处理, 率的比较用χ2检验及Fisher确切概率法; P<0.05认为差异有统计学意义.
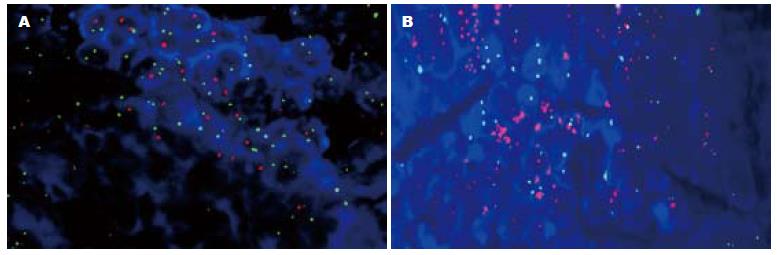
180例胃癌原发灶中, HER-2蛋白IHC染色0、1+、2+及3+的例数分别为139(77.2%)、16(8.9%)、15(8.3%)及10(5.6%), 即阳性表达率(2+/3+)为13.9%(图1); 112例淋巴结转移灶中HER-2蛋白IHC染色0、1+、2+及3+的例数分别为80(71.5%)、9(8.0%)、14(12.5%)及9(8.0%), 即阳性表达率为20.5%(图2), 两组之间无显著性差异(P>0.05). FISH检测示在原发灶和淋巴结转移灶中所有IHC染色0及1+的病例均未发现HER-2基因扩增(图3A), 所有IHC染色3+病例均存在HER-2基因扩增(图3B); 15例IHC染色为2+的原发灶组织中有11例存在基因扩增, 14例IHC染色为2+的淋巴结转移灶中有10例存在基因扩增. 胃癌原发灶和淋巴结转移灶中HER-2基因扩增与过表达的符合率分别为84.0%、82.6%.
HER-2蛋白表达与患者年龄、性别、肿瘤大小无关(P>0.05); 与有无淋巴结转移、TNM分期、有无浆膜浸润、分化程度、Lauren分型有关(P<0.05, 表1).
| 临床病理特征 | n | HER-2蛋白的表达(n) | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 性别 | 0.4123 | 0.5208 | |||
| 男 | 112 | 17 | 95 | ||
| 女 | 68 | 8 | 60 | ||
| 年龄(岁) | 0.5184 | 0.4715 | |||
| ≤60 | 84 | 10 | 74 | ||
| >60 | 96 | 15 | 81 | ||
| 肿瘤大小 | 0.7866 | 0.3751 | |||
| ≤5 cm | 94 | 11 | 83 | ||
| >5 cm | 86 | 14 | 72 | ||
| 浸润深度 | 0.04081 | ||||
| 未及浆膜 | 64 | 4 | 60 | ||
| 浸及浆膜 | 116 | 21 | 95 | ||
| 淋巴结转移 | 3.9035 | 0.0482 | |||
| 无 | 68 | 5 | 63 | ||
| 有 | 112 | 20 | 92 | ||
| 组织学分级 | 7.0096 | 0.0301 | |||
| G1 | 19 | 3 | 16 | ||
| G2 | 55 | 13 | 42 | ||
| G3/G4 | 106 | 9 | 97 | ||
| Lauren分型 | 7.6861 | 0.0214 | |||
| 肠型 | 62 | 13 | 49 | ||
| 弥漫型 | 102 | 7 | 95 | ||
| 混合型/未知 | 26 | 5 | 21 | ||
| TNM分期 | 0.03181 | ||||
| Ⅰ | 17 | 1 | 16 | ||
| Ⅱ | 45 | 4 | 41 | ||
| Ⅲ | 103 | 14 | 89 | ||
| Ⅳ | 15 | 6 | 9 | ||
112例淋巴结转移灶与对应原发灶经IHC及FISH检测显示共有6例HER-2结果不一致, 其中3例原发灶HER-2蛋白IHC染色1+, 其转移淋巴结HER-2蛋白IHC染色2+, 即发生了阳性转变. 2例基因状态发生阳性转变, 其中1例原发灶HER-2蛋白IHC染色为1+, 其淋巴结转移灶中为2+, 另外1例原发灶与转移灶HER-2蛋白IHC染色均为2+. 在所有HER-2发生改变的病例中, 未见HER-2蛋白表达与基因状态的阴性转变(表2).
| 病例 | 性别 | Lauren分型 | TNM分期 | 原发灶 | 淋巴结转移灶 | ||
| IHC | FISH | IHC | FISH | ||||
| 1 | 女 | 肠型 | Ⅲb | 0 | - | 1+ | - |
| 2 | 女 | 肠型 | Ⅲa | 1+ | - | 2+ | - |
| 3 | 男 | 弥漫型 | Ⅱa | 1+ | - | 2+ | - |
| 4 | 女 | 肠型 | Ⅱb | 1+ | - | 2+ | + |
| 5 | 男 | 弥漫型 | Ⅱb | 2+ | + | 3+ | + |
| 6 | 女 | 肠型 | Ⅲa | 2+ | - | 2+ | + |
HER-2蛋白是一种分子量为185 kDa的络氨酸激酶受体, 是人类表皮生长因子受体家族的第2个成员[3]. 过度表达的HER-2蛋白通过激活Ras/MAPK、PI3K/Akt等一系列细胞内信号转导通路, 参与肿瘤细胞的增殖、分化、浸润和转移过程[4,5]以及相关基因的调控[6]; 由于样本量大小、检测方法、评分标准的不同, 以往报道的胃癌HER-2蛋白的表达率高低不均, 大多在6%-38%之间, 但在Allgayer等[7]的研究中HER-2蛋白的表达率高达91%. HER-2蛋白的过表达对胃癌预后的影响尚无定论, 许多研究认为其是导致胃癌预后不良的独立因素[8,9], 而在另一些研究中, 尽管HER-2阳性患者较阴性患者有着更低的生存率, 但两者之间的差异无统计学意义[10]; 几乎所有研究均发现HER-2蛋白在肠型胃癌中的表达显著高于弥漫型胃癌[11,12].
在我们的研究中, 所有IHC染色3+病例均存在HER-2基因扩增, 15例IHC染色为2+的原发灶组织中有11例存在基因扩增, 14例IHC染色为2+的淋巴结转移灶中有10例存在基因扩增. 胃癌原发灶及淋巴结转移灶HER-2的IHC检测结果与FISH的阳性符合率分别为84.0%、82.6%, HER-2蛋白过表达与基因扩增有较好的一致性, IHC可作为HER-2的初步筛查手段, 若IHC染色为2+, 应进一步行FISH检测筛查. 与以往报道[11,12]一致, HER-2蛋白在肠型胃癌中的表达显著高于弥漫型胃癌, 在高、中分化胃癌中的表达显著高于低、未分化胃癌; 本研究尚发现HER-2蛋白表达与淋巴结转移情况、浆膜浸润情况有关, 其在有淋巴结转移、浆膜浸润的胃癌中的表达显著性增高, 与之前一些研究[13,14]一致, 提示HER-2蛋白的过表达可能增加了胃癌细胞的侵袭能力, 促进了癌细胞的转移.
在ToGA临床试验[1]中, HER-2表达阳性的进展期胃癌患者, 使用标准化疗方案联合赫塞汀(针对HER-2蛋白的人源单抗)治疗后, 中位生存时间达到13.8 mo, 有效率达47.3%. 这无疑对进展期胃癌患者具有重要意义, 然而能否使用赫塞汀取决于癌灶HER-2的状态. 对于许多失去手术机会的晚期肿瘤患者或复发转移患者, 往往无法取到肿瘤组织或者难以获得足够的组织样本以进行必要的分子病理检查, 因而人们多依据原发灶HER-2状态来制定转移性肿瘤患者的治疗方案. 但肿瘤发生发展过程中的每一步都可能伴随着遗传学的改变, 肿瘤细胞转移能力的形成是由肿瘤转移异质性决定的. Bozzetti等[15]曾通过IHC和FISH检测72例胃癌原发灶及并发转移灶, 发现了1例淋巴结转移灶Her-2扩增及蛋白过表达, 而在其原发灶没有. Kim等[16]进行了一项胃癌原发灶及对应转移灶HER-2的对比研究后, 认为HER-2基因在胃癌原发灶与对应转移灶中状态出现不一致是HER-2在原发灶中异质性扩增的结果. 由于原发灶与转移灶出现HER-2状态不一致的比例大小不等, 得出的结论也有差异, 对于是否检测转移灶的HER-2状态尚有争议.
本研究中胃癌组织HER-2蛋白阳性表达率低于转移性淋巴结HER-2阳性表达率, 但差异无统计学意义(P>0.05), 并且有6例HER-2基因状态和/或表达情况在胃癌转移过程中发生了改变, 3例HER-2蛋白表达发生阳性转变, 2例发生了HER-2基因的阳性转变, 其中1例原发灶HER-2蛋白IHC染色为1+, 其淋巴结转移灶中为2+, 另外1例原发灶与转移灶HER-2蛋白IHC染色均为2+. 提示HER-2基因扩增及表达在胃癌原发灶与转移灶之间具有异质性; 但未见原发灶HER-2阳性的胃癌转移后发生阴性转变, 因而对于原发灶HER-2阳性的患者, 可以依据原发灶HER-2的情况来指导转移性胃癌的靶向治疗; 而对于原发灶HER-2阴性患者, 我们建议应进一步检测转移灶, 以免遗漏适合HER-2靶向治疗的转移性胃癌患者.
总之, 我们研究发现HER-2的IHC检测与FISH有较好的一致性, IHC可作为HER-2的初步筛查手段, IHC结果为2+时应进一步行FISH检测; HER-2的过表达参与了胃癌的浸润、转移过程; HER-2基因扩增及表达在胃癌原发灶与转移灶之间具有异质性, 原发灶HER-2阴性的患者应进一步检测转移灶.
ToGA试验的成功使HER-2基因检测成为胃癌的常规检查, 但人们多依据原发灶HER-2状态来制定转移性肿瘤患者的治疗方案, 探讨其在胃癌原发灶与转移灶中的异质性表达, 为HER-2靶点治疗药物的临床应用及精确筛选适合靶向治疗的患者提供理论依据.
张锦生, 教授, 复旦大学上海医学院病理学系
HER-2异质性扩增和表达在乳腺癌中已经证实, 并被认为可能是针对HER-2的靶向治疗未达到预期疗效的原因之一, 在胃癌中的研究较少, 结论也不一致, 检测转移灶是否必要尚无定论.
Bozzetti等曾通过免疫荧光染色(IHC)和荧光原位杂交(FISH)检测72例胃癌原发灶及并发转移灶, 发现了1例淋巴结转移灶Her-2扩增及蛋白过表达, 而在其原发灶没有表达.
本研究通过IHC和FISH法检测HER-2在胃癌原发灶和淋巴结转移灶的表达, 分析其与胃癌常见临床病理特征的关系, 比较其在胃癌原发灶与淋巴结转移灶中的差异.
本文比较HER-2在胃癌原发灶与淋巴结转移灶中的差异, 论著资料较全, 结果明确, 并有一定新意, 具有较好的临床应用价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697. [PubMed] [DOI] |
| 2. | Wu JM, Halushka MK, Argani P. Intratumoral heterogeneity of HER-2 gene amplification and protein overexpression in breast cancer. Hum Pathol. 2010;41:914-917. [PubMed] [DOI] |
| 3. | Akiyama T, Sudo C, Ogawara H, Toyoshima K, Yamamoto T. The product of the human c-erbB-2 gene: a 185-kilodalton glycoprotein with tyrosine kinase activity. Science. 1986;232:1644-1646. [PubMed] [DOI] |
| 4. | Klos KS, Wyszomierski SL, Sun M, Tan M, Zhou X, Li P, Yang W, Yin G, Hittelman WN, Yu D. ErbB2 increases vascular endothelial growth factor protein synthesis via activation of mammalian target of rapamycin/p70S6K leading to increased angiogenesis and spontaneous metastasis of human breast cancer cells. Cancer Res. 2006;66:2028-2037. [PubMed] [DOI] |
| 5. | Goueli BS, Janknecht R. Upregulation of the Catalytic Telomerase Subunit by the Transcription Factor ER81 and Oncogenic HER2/Neu, Ras, or Raf. Mol Cell Biol. 2004;24:25-35. [PubMed] [DOI] |
| 6. | Finkenzeller G, Weindel K, Zimmermann W, Westin G, Marmé D. Activated Neu/ErbB-2 induces expression of the vascular endothelial growth factor gene by functional activation of the transcription factor Sp 1. Angiogenesis. 2004;7:59-68. [PubMed] [DOI] |
| 7. | Allgayer H, Babic R, Gruetzner KU, Tarabichi A, Schildberg FW, Heiss MM. c-erbB-2 is of independent prognostic relevance in gastric cancer and is associated with the expression of tumor-associated protease systems. J Clin Oncol. 2000;18:2201-2209. [PubMed] |
| 8. | Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tommola S, Soini Y, Helin H, Salo J, Joensuu H, Sihvo E. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase IIalpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol. 2005;16:273-278. [PubMed] [DOI] |
| 9. | Park DI, Yun JW, Park JH, Oh SJ, Kim HJ, Cho YK, Sohn CI, Jeon WK, Kim BI, Yoo CH. HER-2/neu amplification is an independent prognostic factor in gastric cancer. Dig Dis Sci. 2006;51:1371-1379. [PubMed] [DOI] |
| 10. | Grabsch H, Sivakumar S, Gray S, Gabbert HE, Müller W. HER2 expression in gastric cancer: Rare, heterogeneous and of no prognostic value conclusions from 924 cases of two independent series. Cell Oncol. 2010;32:57-65. [PubMed] |
| 12. | Hsu JT, Chen TC, Tseng JH, Chiu CT, Liu KH, Yeh CN, Hwang TL, Jan YY, Yeh TS. Impact of HER-2 overexpression/amplification on the prognosis of gastric cancer patients undergoing resection: a single-center study of 1,036 patients. Oncologist. 2011;16:1706-1713. [PubMed] [DOI] |
| 13. | Yan SY, Hu Y, Fan JG, Tao GQ, Lu YM, Cai X, Yu BH, Du YQ. Clinicopathologic significance of HER-2/neu protein expression and gene amplification in gastric carcinoma. World J Gastroenterol. 2011;17:1501-1506. [PubMed] [DOI] |
| 14. | 王 仰坤, 高 春芳, 贠 田, 张 现伟, 赵 文召, 郑 国宝, 刘 广洛. HER2和EGFR基因在胃癌组织中的状态及其与临床病理的关系. 世界华人消化杂志. 2010;18:2642-2647. |
| 15. | Bozzetti C, Negri FV, Lagrasta CA, Crafa P, Bassano C, Tamagnini I, Gardini G, Nizzoli R, Leonardi F, Gasparro D. Comparison of HER2 status in primary and paired metastatic sites of gastric carcinoma. Br J Cancer. 2011;104:1372-1376. [PubMed] [DOI] |
| 16. | Kim MA, Lee HJ, Yang HK, Bang YJ, Kim WH. Heterogeneous amplification of ERBB2 in primary lesions is responsible for the discordant ERBB2 status of primary and metastatic lesions in gastric carcinoma. Histopathology. 2011;59:822-831. [PubMed] [DOI] |