修回日期: 2012-08-20
接受日期: 2012-08-21
在线出版日期: 2012-09-18
目的: 观察腹腔感染大鼠肠屏障损伤后肠通透性的变化, 及其与E-cadherin蛋白表达的相关性.
方法: 健康成年♂Wistar大鼠40只, 随机分为空白对照组(仅行单纯剖腹手术)和腹腔感染组(采用盲肠结扎穿孔法制作腹腔感染模型), 术后12、24、36、48 h取材, 每组8只, 处死后, 距回盲部10 cm处取回肠进行常规病理检查, 同时测定肠绒毛高度、肠上皮损伤指数及相应时间点血浆D-乳酸含量, 应用Western blot方法测定肠黏膜E-cadherin蛋白的水平.
结果: 腹腔感染12 h后肠屏障开始出现明显损伤性改变: 肠绒毛高度明显降低, 肠黏膜损伤评分增加, 血浆D-乳酸含量明显增加(P<0.01); 24 h损伤达到高峰: 肠绒毛高度最低, 肠黏膜损伤评分最大, 血浆D-乳酸含量明显增高(P<0.05); 随后肠屏障逐渐恢复, 但48 h组损伤程度仍显著高于对照组(P<0.01). 与对照组比较, 腹腔感染组E-cadherin蛋白表达量降低(P<0.01); 实验组各组相比较, 24 h组E-cadherin蛋白水平最低, 36 h和48 h时E-cadherin蛋白表达量开始降升高, 但仍较对照组低(P<0.01). 相关性检验发现血浆D-乳酸水平与E-cadherin蛋白含量具有明显负相关(r = -0.605, P<0.01).
结论: 腹腔感染状态下, 肠屏障严重受损, 肠黏膜通透性的改变与E-cadherin蛋白水平具有显著的相关性.
引文著录: 成红刚, 丁连安, 曲林林, 牛冬光. 腹腔感染大鼠肠黏膜通透性的改变与E-cadherin蛋白表达的关系. 世界华人消化杂志 2012; 20(26): 2479-2484
Revised: August 20, 2012
Accepted: August 21, 2012
Published online: September 18, 2012
AIM: To observe the correlation between intestinal permeability and the expression levels of E-cadherin protein in the intestinal mucosa in rats with intraperitoneal infection.
METHODS: Forty healthy adult Wistar rats were randomly divided into control group (n = 8) and abdominal infection group (n = 32). The control group underwent celiotomy only, while the abdominal infection group was further equally divided into four subgroups and underwent cecal ligation and puncture to induce abdominal infection at 12, 24, 36, and 48 h after celiotomy. All the rats were sacrificed, and ileum tissue 10 cm away from the ileocecal junction was sampled for histological examination and evaluation of mucosal damage. Plasma D-lactate was measured at various time points. The expression of E-cadherin protein in the intestinal mucosa was detected using Western blot.
RESULTS: Intestinal barrier began to show significant changes 12 h after induction of infection. At 12 h, the abdominal infection group had lower villous thickness, higher mucosal damage index and plasma levels of D-lactat (all P < 0.01) than the control group. The damage reached the peak at 24 h, and lowest villus height, maximum mucosal injury score, and highest lever of D-lactate were observed at this time point (all P < 0.05). The level of D-lactate began to fall at 36 h but remained higher than that in the control group (P < 0.01). The expression level of E-cadherin protein was lowest at 24 h (P < 0.05), and began to rise at 36 and 48 h but remained lower than those in the control group (both P < 0.01). D-lactate levels had a significant correlation with the expression levels of E-cadherin protein (r = -0.605, P < 0.01).
CONCLUSION: There is a significant correlation between intestinal permeability and the expression levels of E-cadherin protein in the intestinal mucosa in rats with intraperitoneal infection.
- Citation: Cheng HG, Ding LA, Qu LL, Niu DG. Correlation between intestinal permeability and expression of E-cadherin protein in intestinal mucosa in rats with intraperitoneal infection. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2479-2484
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2479.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2479
肠黏膜不仅有消化和吸收功能, 而且具有重要的防御性屏障功能, 具有选择性渗透吸收营养物质和防御肠道内微生物及致炎因子入侵等作用; 然而, 在多种应激情况下或肠黏膜受损破坏时, 这种屏障功能减弱, 导致肠通透性增加, 即可出现细菌易位, 甚至触发炎性级联反应, 导致多脏器功能障碍(mutiple organ dysfunction syndrme, MODS)因此肠道被称作机体应激的中心器官、多器官功能障碍的发达机[1]. 业已证明, D-乳酸由胃肠道固有细菌产生, 且哺乳动物体内无快速代谢他的酶系统. 因此, 血液中D-乳酸水平升高可能反映肠黏膜屏障功能的异常[2]. 文献报道腹腔感染时血浆D-乳酸水平增高[3], 但其与肠黏膜屏障功能受损的关系尚不清楚. E-cadherin蛋白是肠上皮细胞黏附连接的主要成分, E-cadherin蛋白介导的黏附连接对肠上皮细胞的屏障功能非常重要[4], 而且在炎性肠病等一些疾病状态下, 黏附连接比紧密连接更容易受到损害[5,6], 在肠屏障功能障碍的发病机制中占有重要的作用[7]. 为此, 我们通过制作腹腔感染模型, 对体循环D-乳酸的变化规律及其与肠黏膜E-cadherin蛋白的相关性进行了研究, 为临床针对性地采取有效防治措施提供理论依据.
健康♂Wistar大鼠购自青岛药品检验所动物中心, 40只, 清洁级, 体质量260 g±20 g, 随机分对照组和腹腔感染组, 腹腔感染组分别以术后12、24、36、48 h取材, 每个时间点8只大鼠. 所有动物实验前均在青岛大学医学院动物饲养中心适应性饲养1 wk, 且经青岛大学伦理委员会批准. 实验前禁食12 h, 自由饮水, 按照100 mg/kg氯胺酮腹腔注射麻醉.
1.2.1 造模: 采用盲肠结扎穿孔术(cecal ligation and puncture, CLP)制作腹腔感染模型[8]. 麻醉后, 以腹正中纵行切口, 逐层进入腹腔, 辨认盲肠并暴露于腹腔外, 小心分离盲肠系膜, 避免损伤回盲肠血管. 在盲肠远端与盲肠根部1/2处用3-0丝线结扎, 将盲肠内容物轻轻挤向盲肠远端, 用18G针头在已结扎盲肠与盲肠末端中间贯通穿刺, 注意避免损伤血管. 移去针头, 轻挤出少量肠内容物从两侧针孔溢出, 以保证穿孔开放, 注意使挤出的内容物少且一致. 将盲肠还纳入腹腔, 分层缝合腹壁切口, 术毕皮下注射预热(37 ℃)9.0 mg/mL氯化钠溶液(按鼠质量5 mL/100 mg体质量给药)抗休克. 术后各组动物均自由进食饮水. 对照组仅行剖腹手术, 翻动肠道后关腹, 术毕处理同实验组.
1.2.2 血标本的采集与检测: 实验组于术后12、24、36、48 h腹主动脉取血3-5 mL后放血处死, 血液推入EDTA抗凝的试管中, 离心分离血浆, 分装于EP管中, -70 ℃保存待检. 对照组于术后24 h采血后相同处理. 根据Brandt等[9]建立的分光光度法检测血浆D-乳酸的含量.
1.2.3 肠黏膜的组织学观察及测量: 距回盲部10 cm处取回肠2 cm, 10%甲醛固定2 h, 石蜡包埋, HE染色, 光镜下观察肠黏膜的形态结构的变化. 低倍镜下, 用台微尺(OLYMPUS)测量回肠绒毛高度变化, 每个肠标本随机选取10根绒毛, 取平均值.
1.2.4 观察回肠黏膜损伤程度: 采用四级评分系统对肠损伤程度进行判定[10]. 0分: 正常; 0.5分: 肠黏膜水肿、充血, 无坏死性病变; 1分: 病变局限于肠黏膜, 有散在性出血点; 2分: 坏死累及表浅黏膜, 黏膜中有多区域出血; 3分: 全层坏死伴有肠腔出血.
1.2.5 Western blot分析: 取临近回盲部的回肠约15 cm, 冰上刮去肠黏膜, 冰上超声破碎后, 12 000 r/min离心15 min, 分装于EP管中, -80 ℃冻存. 取适量肠黏膜组织, 加入RIPA裂解液(强), 按照每20 mg组织加入150-250 mL裂解液的比例加入裂解液, 匀浆至充分裂解, 12 000 g离心5 min, 取上清, BCA法测定蛋白浓度, 使样品中总蛋白的浓度为5 μg/μL. 取50 μg总蛋白进行SDS-PAGE电泳, 并原位电转印至PVDF膜上. 膜经封闭液处理, 含150 mmol/L氯化钠、0.1%SDS、20 mmoL/L Tris-Hcl(pH 7.6)、0.1% Tween-20和5%脱脂奶粉. 与兔抗鼠E-cadherin多克隆抗体(稀释1:200, abcam公司)和兔抗β-actin抗体(稀释1:500, 北京博奥森公司)分别孵育, 膜经PBST漂洗后再与辣根过氧化物酶(HRP)标记的羊抗兔IgG(稀释1:8 000, 北京中杉金桥生物技术公司)反应, 增强化学发光液(ECL)发光试剂显影得到蛋白印记条带, 将胶片进行扫描, 用Quantity one V462软件对各条带灰度值进行半定量分析.
统计学处理 采用SPSS17.0统计软件包进行分析, 计量资料用mean±SD表示, 多组均数比较采用单因素方差分析, 均数间两两比较采用LSD-t检验; 完全随机设计多个样本的等级资料比较采用Kruskal-Wallis秩和检验, 用Pearon相关性检验进行相关性分析, P<0.05为差异有显著性, P<0.01为差异有高度显著性.
大体见对照组大鼠腹腔内各器官无明显炎症表现, 肠管无明显充血水肿. 12 h组大鼠可见肠管充血水肿, 腹腔少量渗出; 24 h组可见肠管充血水肿加重, 部分肠管坏死, 并腹膜包裹局限, 血性渗出较多; 36 h组和48 h组大鼠可见肠管粘连严重, 腹腔渗出减少.
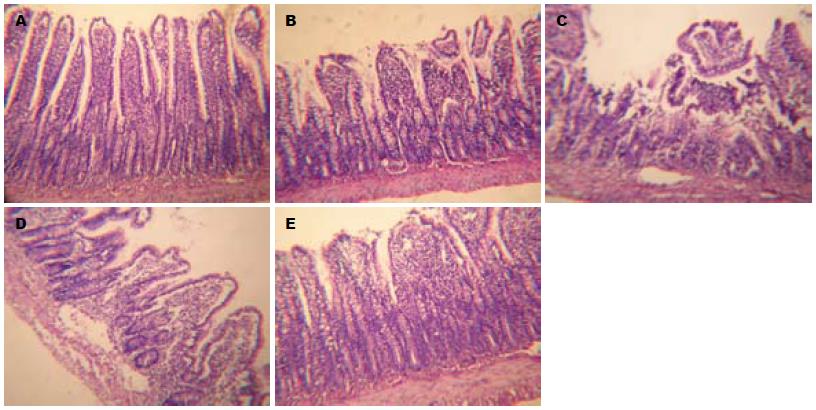
对照组空肠黏膜各层结构完整, 肠绒毛排列整齐, 未见淋巴细胞增生及炎细胞浸润(图1A); 实验组出现明显的病理改变: 12 h即出现肠黏膜和黏膜下层间质水肿、血管充血, 黏膜层有中性粒细胞浸润, 肠绒毛毛细血管充血, 浆膜层明显炎性渗出(图1B); 24 h肠绒毛排列紊乱, 高矮不一, 部分倒伏、融合, 部分绒毛尖端破溃, 黏膜上皮大量脱落, 部分肠黏膜固有层内腺体灶性区域坏死(图1C); 36 h光镜下亦可见黏膜水肿、充血及炎细胞浸润, 但肠黏膜上皮脱落减少(图1D), 48 h损伤明显减轻, 部分肠黏膜恢复其连续性(图1E).
实验组大鼠从12 h起小肠绒毛高度开始下降(P<0.01), 至24 h时下降最明显(P<0.05); 36 h和48 h时小肠绒毛高度开始增高, 但仍较对照组低(P<0.01, 表1).
各组动物小肠黏膜病理损伤等级采用Kruskal-Wallis秩和检验, P<0.01, 说明CLP后各时间点不同组间肠黏膜损伤病理等级评分有统计学差异, 因此可根据各组的平均秩次大小来评价其损伤程度, 实验组各组均比对照组严重, 实验组以术后24 h最严重(平均秩次为31.69), 12、36 h次之, 48 h最轻(表1).
对照组大鼠血浆中仅含有少量的D-乳酸; 实验组大鼠从12 h起血浆D-乳酸含量开始增加(P<0.01), 24 h时达到高峰(P<0.05), 36 h和48 h时D-乳酸开始降低, 但仍较对照组高(P<0.01, 表2).
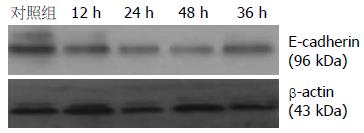
对胶片进行灰度值扫描, 以对应β-actin灰度值的比值作为E-cadherin蛋白的表达量. 与对照组比较, 实验组E-cadherin蛋白表达量降低(P<0.01); 实验组中24 h组E-cadherin蛋白表达量最低(P<0.05), 36 h和48 h时E-cadherin蛋白表达量开始降升高, 但仍较对照组低(P<0.01, 表2, 图2).
大鼠血浆D-乳酸水平与E-cadherin蛋白含量具有显著负相关(r = -0.605, P<0.01).
肠道是一个巨大的细菌库, 每克粪便含有约1010-1012个细菌, 并且如此庞大数量的细菌产生的毒素也是惊人的, 但肠道却能选择性的只吸收机体所需要的营养物质, 不让肠道内的细菌和毒素进入体内, 依靠的就是肠黏膜的屏障功能[11]. 一般说来, 肠黏膜屏障有3部分组成: 机械屏障即黏膜上皮、生物屏障即肠道内的正常菌群、免疫屏障即黏膜内和黏膜下的各种免疫细胞及其分泌的免疫物质. 其中, 小肠黏膜上皮细胞具有重要的屏障作用, 一般意义的肠屏障即指这层结构[12].
D-乳酸是肠道固有细菌的代谢终产物, 肠道内许多细菌均可产生, 包括大肠杆菌、乳酸菌、克雷伯杆菌等[13]. D-乳酸是L(+)乳酸的立体异构体, 在哺乳动物正常组织中不生成D-乳酸, 并且哺乳动物没有D-乳酸脱氢酶, 不能将D-乳酸快速代谢, 因此其全身清除率只有L-乳酸的1/5[14,15]. 在机体发生严重创伤、休克、重症感染、肠道缺血等损伤时, 一方面肠道内细菌大量繁殖, 发酵产生大量代谢终产物, D-乳酸含量明显增加; 另一方面, 肠绒毛顶端上皮脱落, 肠黏膜通透性增加. 两方面作用使得大量D-乳酸进入血循环, 在外周血中可见D-乳酸水平升高, 故检测血中D-乳酸水平可及时反映肠黏膜损害程度和通透性变化[14], 并且此方法操作简便, 并且不需要昂贵的仪器设备, 可以为临床上检测肠通透性提供可行的方法.
文献[8]报道, 通过CLP制作腹腔感染模型, 动物在开始阶段无明显异常反应, 术后12 h才表现发热、寒战、竖毛等明显的临床症状. 因此, 我们把术后12 h作为初始检测点. 我们发现与对照组比较, CLP术后12 h血浆中D-乳酸含量明显升高, 并且在24 h达到高峰, 36、48 h较24 h降低, 说明CLP术后大鼠肠通透性是一个先出现增加, 后缓慢修复的过程. 同时分析病理学结果, 二者描述的变化趋势一致.
肠上皮细胞间的连接有紧密连接(tight junctions, TJs)、黏附连接和桥粒等, 其中紧密连接被认为是肠上皮细胞间主要的连接方式. 近年来, 随着分子生物学和显微技术的不断发展, 紧密连接的分子结构及其在肠黏膜屏障功能中的作用逐渐受到重视, 已成为众多学者关注的热点. 随着研究的深入, 黏附连接在肠黏膜屏障功能中的作用正在受到重视, 一系列研究表明, 黏附连接不仅仅在相邻细胞间起加强细胞间连接的作用, 而且黏附连接的事先形成对紧密连接的装配是至关重要的, 黏附连接水平的变化可以调节紧密连接复合体的稳定性, 进而影响肠上皮细胞间的通透性[16-18].
本实验中, 我们通过制作腹腔感染模型, 检测腹腔感染不同时间点黏附连接破坏的情况, 以对应β-actin灰度值的比值作为E-cadherin蛋白的表达量, 发现感染后12 h E-cadherin蛋白的表达量即发生降低, 并且在24 h表达量达到最低, 并且在36、48 h时表达量开始升高, 但仍低于对照组, 说明36 h已开始修复, 但尚未恢复到正常水平, 腹腔感染时肠黏膜E-cadherin蛋白的表达量呈现一个先出现下降, 后逐渐恢复的过程. 本实验中, 我们对比了血浆D-乳酸水平和肠黏膜E-cadherin蛋白的表达量, 通过Pearon相关性检验发现二者存在显著的负相关, 即肠黏膜E-cadherin蛋白的表达量降低, 肠黏膜的通透性增大, 这与文献报道的结果相同.
肠上皮细胞是哺乳动物组织中更新速率最快的细胞之一, 新生的肠上皮细胞从隐窝基底部的增殖细胞中分化出来, 沿着隐窝-绒毛轴迁移, 大约经过2-6 d到达肠绒毛顶端, 然后脱落进入肠腔, 细胞凋亡在这一过程中起到双重的调节作用: 控制隐窝基底部的干细胞增殖和通过失巢凋亡控制肠绒毛顶端的肠细胞脱落; 失巢凋亡现象是细胞凋亡的一种, 最早在上皮细胞和内皮细胞中发现, 是由于丧失与细胞基质的联系进而导致细胞凋亡; E-cadherin下调即可引起肠上皮细胞发生失巢凋亡现象, 通过阻断E-cadherin表达可以增加失巢凋亡的发生, 活化E-cadherin表达可以减少凋亡的发生[19]. 在敲除E-cadherin基因的大鼠中观察到肠上皮细胞凋亡的增加, 这些结果证明E-cadherin参与控制肠绒毛细胞发生失巢凋亡的发生[20]. E-cadherin参与调节的失巢凋亡的机制主要通过Bcl-2和caspse-9调节的信号转导通路, 最终由溶酶体酶和蛋白酶体执行降解蛋白[19]. 因此, 我们推断在腹腔感染状态下, 由于E-cadherin蛋白表达量下降, 可以通过介导细胞内的信号转导通路, 进而调节肠上皮细胞发生失巢凋亡, 最终导致肠通透性改变.
综上所述, 通过制作腹腔感染模型, 发现肠黏膜出现先损伤后修复的过程, 肠通透性随着损伤程度的加重而增加, 检测腹腔感染病人血浆D-乳酸水平的变化可反映其肠屏障功能受损程度的改变, 对估计病情进展和预后有一定的意义; 同时, 腹腔感染的加重导致肠黏膜E-cadherin蛋白表达量下降, E-cadherin蛋白通过介导细胞内的信号转导通路, 进而调节肠上皮细胞发生失巢凋亡, 最终导致肠通透性改变. 这为我们临床上预防和治疗腹腔感染时肠通透性变化提供了理论依据.
肠道作为应激反应的中心器官之一, 在创伤、手术、严重感染等应激状态时, 起重要作用. 当机体应激反应过度或失调时, 肠黏膜功能受到损害, 原先寄生于肠道内的微生物及其毒素越过受损的肠黏膜屏障, 导致肠道细菌及毒素移位.
王正康, 教授, 中日友好医院普外科
肠黏膜屏障的具体机制非常复杂,至今尚不十分清楚, 可能与肠黏膜机械屏障、局部生物学因素、化学因素及免疫功能有关. 缺氧、炎症、外伤等损伤均可导致肠黏膜屏障功能障碍.
Michelle等在敲除E-cadherin基因的大鼠中观察到肠上皮细胞凋亡的增加, 结果证明E-cadherin参与控制肠绒毛细胞发生失巢凋亡的发生. E-cadherin参与调节的失巢凋亡的机制可能是通过Bcl-2和caspse-9调节的信号转导通路, 最终由溶酶体酶和蛋白酶体执行降解蛋白.
本研究首次阐述了腹腔感染时肠通透性的改变与E-cadherin蛋白的相关性, 为临床上防治腹腔感染时肠通透性变化提供了有意义的理论依据.
本文以实验大鼠研究腹腔感染时肠屏障障碍的机制, 结果显示腹腔感染后小肠黏膜E-cadherin蛋白表达量的下降与肠屏障障碍显著相关. 本研究内容不是很新, 但作者做了认真的工作, 思路正确, 结论可信, 提供了一定可供参考的信息.
编辑: 李军亮 电编:闫晋利
| 2. | Duzgun AP, Bugdayci G, Sayin B, Ozmen MM, Ozer MV, Coskun F. Serum D-lactate: a useful diagnostic marker for acute appendicitis. Hepatogastroenterology. 2007;54:1483-1486. [PubMed] |
| 4. | van Roy F, Berx G. The cell-cell adhesion molecule E-cadherin. Cell Mol Life Sci. 2008;65:3756-3788. [PubMed] [DOI] |
| 5. | Gassler N, Rohr C, Schneider A, Kartenbeck J, Bach A, Obermüller N, Otto HF, Autschbach F. Inflammatory bowel disease is associated with changes of enterocytic junctions. Am J Physiol Gastrointest Liver Physiol. 2001;281:G216-G228. [PubMed] |
| 6. | Hanby AM, Chinery R, Poulsom R, Playford RJ, Pignatelli M. Downregulation of E-cadherin in the reparative epithelium of the human gastrointestinal tract. Am J Pathol. 1996;148:723-729. [PubMed] |
| 7. | Liu L, Guo X, Rao JN, Zou T, Xiao L, Yu T, Timmons JA, Turner DJ, Wang JY. Polyamines regulate E-cadherin transcription through c-Myc modulating intestinal epithelial barrier function. Am J Physiol Cell Physiol. 2009;296:C801-C810. [PubMed] [DOI] |
| 8. | Rittirsch D, Huber-Lang MS, Flierl MA, Ward PA. Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc. 2009;4:31-36. [PubMed] [DOI] |
| 9. | Brandt RB, Siegel SA, Waters MG, Bloch MH. Spectrophotometric assay for D-(-)-lactate in plasma. Anal Biochem. 1980;102:39-46. [PubMed] [DOI] |
| 10. | Schlag G, Redl H, van Vuuren CJ, Davies J. Hyperdynamic sepsis in baboons: II. Relation of organ damage to severity of sepsis evaluated by a newly developed morphological scoring system. Circ Shock. 1992;38:253-263. [PubMed] |
| 12. | Daugherty AL, Mrsny RJ. Regulation of the intestinal epithelial paracellular barrier. Pharm Sci Technolo Today. 1999;2:281-287. [PubMed] [DOI] |
| 13. | Shimizu K, Ogura H, Goto M, Asahara T, Nomoto K, Morotomi M, Yoshiya K, Matsushima A, Sumi Y, Kuwagata Y. Altered gut flora and environment in patients with severe SIRS. J Trauma. 2006;60:126-133. [PubMed] [DOI] |
| 14. | Vella A, Farrugia G. D-lactic acidosis: pathologic consequence of saprophytism. Mayo Clin Proc. 1998;73:451-456. [PubMed] [DOI] |
| 15. | Herrera DJ, Morris K, Johnston C, Griffiths P. Automated assay for plasma D-lactate by enzymatic spectrophotometric analysis with sample blank correction. Ann Clin Biochem. 2008;45:177-183. [PubMed] [DOI] |
| 16. | Angst BD, Marcozzi C, Magee AI. The cadherin superfamily: diversity in form and function. J Cell Sci. 2001;114:629-641. [PubMed] |
| 17. | Guo X, Rao JN, Liu L, Zou TT, Turner DJ, Bass BL, Wang JY. Regulation of adherens junctions and epithelial paracellular permeability: a novel function for polyamines. Am J Physiol Cell Physiol. 2003;285:C1174-C1187. [PubMed] |
| 18. | Liu YN, Lee WW, Wang CY, Chao TH, Chen Y, Chen JH. Regulatory mechanisms controlling human E-cadherin gene expression. Oncogene. 2005;24:8277-8290. [PubMed] [DOI] |
| 19. | Fouquet S, Lugo-Martínez VH, Faussat AM, Renaud F, Cardot P, Chambaz J, Pinçon-Raymond M, Thenet S. Early loss of E-cadherin from cell-cell contacts is involved in the onset of Anoikis in enterocytes. J Biol Chem. 2004;279:43061-43069. [PubMed] [DOI] |
| 20. | Hermiston ML, Gordon JI. In vivo analysis of cadherin function in the mouse intestinal epithelium: essential roles in adhesion, maintenance of differentiation, and regulation of programmed cell death. J Cell Biol. 1995;129:489-506. [PubMed] [DOI] |