修回日期: 2012-08-10
接受日期: 2012-08-21
在线出版日期: 2012-09-18
目的: 构建人HSF2 pCMV-Myc真核表达载体, 研究其在人结肠上皮肿瘤细胞Caco-2内的表达和定位.
方法: 以HSF2 Human cDNA ORF clone为模板, PCR法扩增出全长HSF2编码系列, 用EcoRⅠ和KpnⅠ对HSF2 PCR纯化产物双酶切后, 采用基因重组技术将其插入至pCMV-Myc载体中. DNA测序正确后, 脂质体法将重组质粒转染到Caco-2细胞内, 提取细胞总RNA逆转录为cDNA后进行普通PCR检测HSF2 mRNA转录水平, 提取细胞蛋白进行Western blot检测HSF2蛋白质水平及融合蛋白表达. 采用激光共聚焦显微镜观察HSF2及融合蛋白在Caco-2内的表达和定位.
结果: 将人全长HSF2编码序列克隆到真核表达载体pCMV-Myc中, 酶切鉴定片段为1 557 bp, 重组质粒测序正确. 转染重组质粒后, PCR显示HSF2在mRNA水平较未转染组和空载组升高; Western blot检测到融合蛋白正确表达, 分子量约为70 kDa. 与未转染组和空载组相比, 重组质粒组HSF2蛋白质水平明显升高. 激光共聚焦显微镜下观察到HSF2和融合蛋白定位一致, 主要分布于Caco-2细胞质中, 少量聚集在细胞核膜.
结论: 成功构建了人全长HSF2编码序列的pCMV-HSF2-FLAG真核表达载体, 并在Caco-2细胞中成功表达, 为进一步研究HSF2在溃疡性结肠炎中的作用奠定了良好的基础.
引文著录: 缪应雷, 牛俊坤, 周丽峰, 童明霞. pCMV-HSF2-FLAG重组质粒的构建及其在Caco-2细胞中的表达. 世界华人消化杂志 2012; 20(26): 2453-2459
Revised: August 10, 2012
Accepted: August 21, 2012
Published online: September 18, 2012
AIM: To construct a eukaryotic expression plasmid encoding the human heat shock factor 2 (HSF2) gene and to examine its expression and localization in Caco-2 cells, a human colon adenocarcinoma cell line using FLAG tag as a reporter.
METHODS: The coding sequence of the HSF2 gene was amplified by PCR using human HSF2 cDNA as the template and subcloned into pCMV-Myc vector after digestion with EcoR I and Knp I. After the identity of recombinant plasmid was verified by direct sequencing, the plasmid was transfected into Caco-2 cells using Lipofectamine. Total RNA was extracted, reverse transcribed into cDNA, and tested by PCR. The expression of HSF2 and the recombinant fusion protein in Caco-2 cells was detected by Western blot. The expression and localization of HSF2 and the recombinant fusion protein in Caco-2 cells were observed by laser scanning confocal microscopy.
RESULTS: The coding sequence of the HSF2 gene was successfully inserted into the pCMV-Myc vector. Restriction enzyme digestion analysis showed that the length of the insert was 1557 bp, matching the expected size. The mRNA level of HSF2 in cells transfected with the recombinant plasmid was higher than those in non-transfected cells and cells transfected with empty vector. The expression of recombinant HSF2-FLAG fusion protein, which had a molecular weight of 70 kDa, was detected by Western blot. The expression of HSF2 in cells transfected with the recombinant plasmid increased dramatically in comparison with matched groups. The HSF2 and recombinant HSF2-FLAG protein were localized predominantly to the cytoplasm but partially aggregated around the nuclear envelope in Caco-2 cells.
CONCLUSION: The recombinant plasmid pCMV-HSF2-FLAG has been successfully constructed, which provides the basis for further study of possible roles of HSF2 in ulcerative colitis.
- Citation: Miao YL, Niu JK, Zhou LF, Tong MX. Construction of a eukaryotic expression plasmid encoding the human HSF2 gene and its expression in Caco-2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2453-2459
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2453.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2453
热休克反应是生物机体在温度升高、重金属、氧化剂以及病原微生物感染等应激环境下以热休克蛋白(heat shock proteins, HSPs)家族表达增加为特征的一种防御适应反应[1]. HSPs作为分子伴侣可以促进新生蛋白形成正常构象和正确定位, 修复或降解变性损伤蛋白, 维护细胞内环境稳定, 保证在应激条件下细胞的存活[2]. 热休克转录因子(heat shock factor, HSF)是HSPs的主要调控因子, 其结构和功能具有广泛同源性, 真核生物中已发现的HSF有4种亚型, 人体内有HSF1、2、4三种不同亚型, 不同亚型的HSF激活机制和功能既有交叉也有区别[3]. 脊椎动物中, HSF1具有高度的种属保守性, 对热刺激敏感, 是哺乳动物应答应激的主要热休克转录因子[4]. 不同于HSF1、HSF2对热刺激耐受, 在维持细胞生长、发育和分化的调控以及延长机体生命方面起着重要作用[5,6]. 另外, HSF2可抑制蛋白质的错误折叠, 并促进泛素化作用降解构象异常的蛋白, 从而减少老年痴呆征和帕金森症等蛋白错误折叠疾病的发生率及延缓疾病的进展[7,8]. 引起我们关注的是, 有学者认为HSF调控转录的HSP10、HSP70和HSP90在促进和维持溃疡性结肠炎中起着重要的作用[9,10]. 近年来对HSF2在疾病发生、发展中的作用的研究日益受到关注. 在本研究中我们利用基因重组技术成功构建了pCMV-HSF2-FLAG真核表达载体, 并在人结肠上皮腺癌细胞Caco-2内表达和定位, 为今后进一步研究HSF2在溃疡性结肠炎(ulcerative colitis, UC)中的生物学功能奠定了基础.
Caco-2细胞由中国科学院昆明动物所张云研究员实验室惠赠; HSF2 Human cDNA ORF clone(RG226533)购自Origene公司; pCMV-Myc载体购自Clontech公司; Taq聚合酶、限制性内切酶、T4 DNA连接酶、DNA Marker、DH5α感受态细胞、蛋白定量试剂盒、cDNA第一链合成试剂盒均购自TaKaRa公司; Monoclonal ANTI-FLAG M2 antibody、Hoechst33258购自Sigma公司; HSF2(721D1)mouse monoclonal antibody、HSF2 rabbit polyclonal antibody、β-actin mouse monoclonal antibody、Goat anti-mouse IgG-HRP购自Santa Cruz公司; Prestained Protein Molecular Weight Marker、ECL发光底物购自Thermo公司; LipofectamineTM2000 Reagent、Alexa Fluor® 594 Goat Anti-Mouse IgG(H+L)、Alexa Fluor® 488 Donkey Anti-Rabbit IgG(H+L)购自Invitrogen公司; 质粒大抽试剂盒、总RNA提取试剂盒、2×Tag PCR MasterMix、电泳凝胶回收试剂盒购自天根公司; 其他试剂均为国产分析纯; 引物合成及DNA测序由深圳华大基因公司完成.
1.2.1 人HSF2全长编码序列扩增: 以HSF2 Human cDNA ORF clone为模板, 利用PCR技术对HSF2进行扩增. 引物系列为Primer F: 5'-CCGGAATTCGGA TGAAGCAGAGTTCGAACGTGC-3', Primer R: 5'-CGGGGTACCTTATTA CTTGTCATCGTCGTCCTTGTAATCGCTATCTAAAAGTGGCATATCAC-3', 包括EcoRⅠ和KpnⅠ酶切位点. 50 μL PCR体系为: Taq 0.25 μL、10×PCR Buffer 5 μL、dNTP Mixture 4 μL、HSF2 Human cDNA ORF clone 1 μL、Primer F 1μL、Primer R 1 μL、ddH2O 37.5 μL. 反应条件为: 94 ℃变性5 min, 94 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 90 s, 72 ℃延伸7 min, 循环35次. 反应产物0.8%琼脂糖胶电泳, 1 557 bp目的条带处切胶, 天根电泳凝胶回收试剂盒回收纯化PCR产物.
1.2.2 Pcmv-HSF2-FLAG表达载体的构建、鉴定与测定: 用EcoRⅠ和KpnⅠ对HSF2 PCR纯化产物及pCMV-Myc分别进行酶切. 酶切反应体系为: EcoRⅠ1 μL, KpnⅠ1 μL, 10×H Buffer 2 μL, 纯化产物或者pCMV-Myc 16 μL, 37 ℃, 酶切反应2 h. 酶切产物经电泳、切胶、纯化后用T4 DNA连接酶16 ℃连接过夜. 连接产物10 μL转化50 μL感受态细胞E.coli DH5α, 转化产物接种于300 μL含1 mg/mL氨苄西林的灭菌LB培养基中, 37 ℃振荡培养1 h 8 000 r/min, 离心1 min, 弃150 μL上清, 取剩余200 μL菌液均匀涂布于含氨苄西林的LB琼脂平板, 37 ℃培养过夜. 挑选单克隆, PCR法鉴定, 选取阳性克隆接种含1 mg/mL氨苄西林的灭菌LB培养基中, 37 ℃振荡培养至A600值为0.6, 取菌液送深圳华大基因公司测序证实, 将构建的质粒命名为pCMV-HSF2-FLAG.
1.2.3 pCMV-HSF2-FLAG质粒提取与瞬时转染: 挑取测序正确的单克隆接种于5 mL含1 mg/mL氨苄西林的灭菌LB培养基中, 37 ℃振荡培养过夜. 取过夜菌液接种到1 L含1 mg/mL氨苄西林的灭菌LB培养基中, 37 ℃振荡培养至A600值为0.6, 收集菌液, 按天根质粒大抽试剂盒说明抽提质粒, -20 ℃保存待用. Caco-2细胞采用含10%FBS的DMEM高糖培养基, 在37 ℃、50 mL/L CO2条件下培养. 选取生长状态良好的Caco-2以1.5×105/mL密度接种于24孔板, 设未转染组, 转染pCMV-Myc空载体组和转染pCMV-HSF2-FLAG重组质粒组. 待细胞融合至70%-80%时, 用LipofectamineTM2000转染0.8 μg pCMV-Myc空载体及pCMV-HSF2-FLAG重组质粒DNA入转染组Caco-2细胞. 转染方法按LipofectamineTM2000说明书进行.
1.2.4 总RNA提取与普通PCR鉴定: 转染36 h后, 将未转染、转染pCMV-Myc空载体和转染pCMV-HSF2-FLAG的细胞培养板置于冰上, 弃掉培养基, 4 ℃无菌PBS清洗3次, 天根总RNA提取试剂盒提取总RNA, TaKaRa cDNA第一链合成试剂盒逆转录cDNA, 以cDNA为模板, 普通PCR法扩增HSF2, 以GAPDH为内参. 引物序列为: HSF2 Primer F: 5'-AAGGTTGAGCTGTTGGA-3', Primer R: 5'-GATTTTCTTCCCTCTTC-3', 长度为178 bp. GAPDH Primer F: 5'-ACAGTCAGCCGCATCTTCTT-3', Primer R: 5'-GACAAGCTTCCCGTTCTCAG-3', 长度232 bp. 25 μL PCR体系为: 2×Tag PCR MasterMix 12.5 μL、cDNA 1 μL、Primer F 1 μL、Primer R 1 μL、ddH2O 9.5 μL. 反应条件为: 94 ℃变性5 min, 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 72 ℃延伸7 min, 循环35次. 反应产物3%琼脂糖胶电泳, BIO-RAD凝胶成像系统采集图像, 处理分析.
1.2.5 蛋白提取与Western blot鉴定: 转染36 h后, 将未转染、转染pCMV-Myc空载体和转染pCMV-HSF2-FLAG的细胞培养板置于冰上, 弃掉培养基, 4 ℃无菌PBS清洗3次, 用含有蛋白酶抑制剂的RIPA裂解液裂解细胞, 12 000 r/min, 4 ℃离心30 min, 取上清液蛋白定量后, 取50 μg总蛋白经10%SDS-PAGE凝胶35 mA恒流电泳分离, 4 ℃, 200 mA恒流转移至PVDF膜上, 3%BSA封闭2 h, 1:4 000 β-actin mouse antibody, 1:3 000 ANTI-FLAG M2 antibody, 1:1 000 HSF2 mouse monoclonal antibody, 4 ℃孵育过夜, TBST洗膜5 min, 3次, 1:4 000 Goat anti-mouse IgG-HRP, 室温孵育2 h, TBST洗膜5 min, 3次, ECL显影, 压片.
1.2.6 激光共聚焦显微镜观察HSF2及pCMV-HSF2-FLAG融合蛋白在Caco-2细胞中的定位: 将玻璃片置于24孔板中, 接种细胞, 分别转染pCMV-Myc空载体和pCMV-HSF2-FLAG重组质粒. 转染36 h后, 弃培养基, PBS漂洗5 min, 3次, 用4%多聚甲醛固定20 min, PBS漂洗5 min, 3次, 加入0.1%Triton X-100透膜处理15 min, PBS漂洗5 min, 3次, 3%BSA室温封闭1 h, 1:200 HSF2 Rabbit polyclonal antibody, 1:200 ANTI-FLAG M2 antibody, 4 ℃孵育过夜, PBST漂洗5 min, 3次, 1:250 Alexa Fluor® 594 Goat Anti-Mouse IgG(H+L), 1:250 Alexa Fluor® 488 Donkey Anti-Rabbit IgG(H+L)室温避光孵育1 h, PBST漂洗5 min, 25 μg/mL Hoechst染核5 min, PBST漂洗5 min, 蒸馏水洗后用甘油封片, 激光共聚焦显微镜下观察拍照, 图片用Olympus FV10-ASW 2.1 Viewer处理.
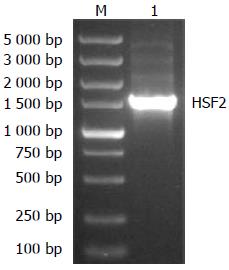
目的条带约为1 557 bp, 片段大小与已经明确的基因片段大小相同(图1).
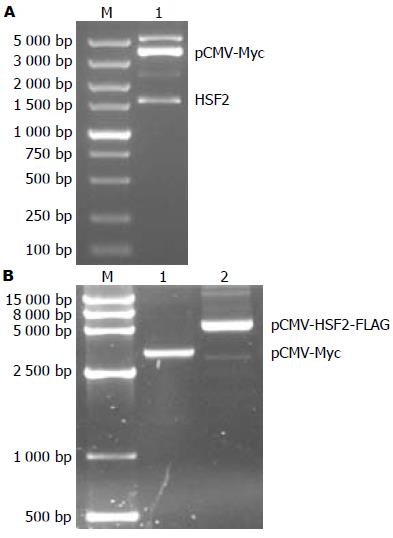
将pCMV-HSF2-FLAG经EcoRⅠ和KpnⅠ双酶切后琼脂糖凝胶电泳显示, 得到1 557 bp左右HSF2条带, 与目的条带相似. 将pCMV-Myc空载体和pCMV-HSF2-FLAG经琼脂糖凝胶电泳, 在相应位置分别显示清晰的条带. 对pCMV-HSF2-FLAG重组质粒正反双向测序, BioEdit软件查对碱基序列, 结果正确, 未见突变碱基. 上述结果证实pCMV-HSF2-FLAG重组质粒构建成功(图2).
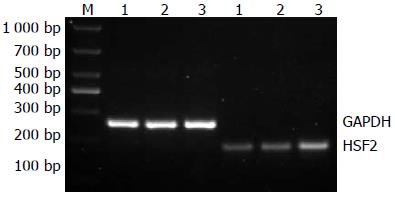
经PCR扩增后, 未转染, 转染空载体及重组质粒的细胞均转录出178 bp的HSF2. 与未转染及转染空载体组对比, 转染重组质粒的细胞HSF2 mRNA明显升高(图3).
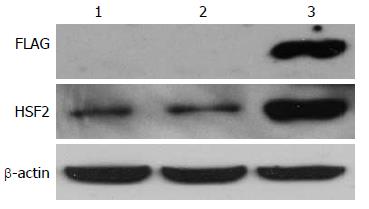
pCMV-HSF2-FLAG重组质粒在Caco-2细胞中表达, 融合蛋白在70 kDa附近显现特异的FLAG标签条带, 而未转染组和转染空载体组均未出现该特异性条带. 3组细胞在69 kDa附近均显现特异性的HSF2条带, 其分子量与目的条带相符, 与未转染和转染空载体组对比, 转染重组质粒组HSF2蛋白质表达水平明显升高. 结果表明所构建的pCMV-HSF2-FLAG重组质粒在Caco-2细胞中成功表达(图4).
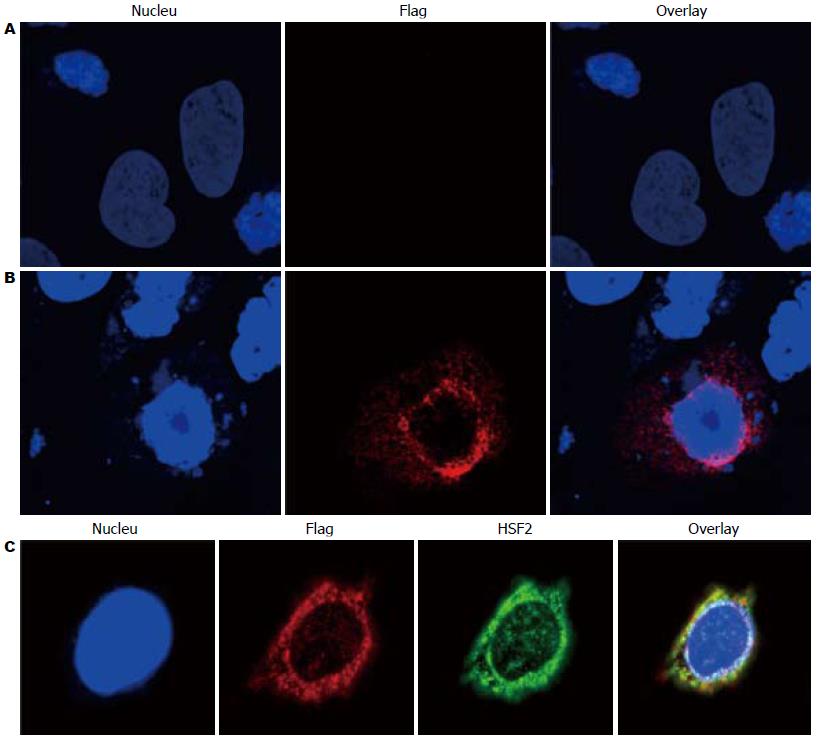
激光共聚焦显微镜显示转染空载体组的Caco-2细胞中仅显现Hoechst沾染的蓝色的细胞核. 而转染pCMV-HSF2-FLAG的Caco-2细胞中可见HSF2绿色荧光和融合蛋白红色荧光分布于细胞质, 特别是细胞核膜周围显现相对强烈的荧光信号. 共聚焦结果表明HSF2及融合蛋白在细胞中定位一致, 其广泛分布于细胞质中, 但在细胞核膜上较富集(图5).
HSF最初是因为调控HSP表达而进入人们视线的, 但日益广泛的研究打破这一狭隘的认识, 从胚胎发育、代谢、寿命到神经退行性变、癌症等各种生理病理的变化都与其有着紧密的联系[11-13]. 目前对HSF2的研究多集中在蛋白质错误折叠的疾病, 延缓衰老, 胚胎及精子发育等方向上, 但其对诸如UC等炎症性疾病研究相对较少.
本研究小组前期通过双向电泳及质谱分析等系列研究筛选出9个UC差异蛋白质, 发现HSF2为表达上调的蛋白, 推测其可能与UC发病机制有关[14]. 为了能在结肠上皮细胞中过表达HSF2, 深入探讨其在溃疡性结肠炎发生发展中的分子机制, 本研究利用基因重组技术将HSF2插入到pCMV-Myc载体中, 利用酶切鉴定保证扩增片段的正确性, 通过基因测序分析证实了pCMV-HSF2-FLAG重组质粒构建成功; 应用普通PCR技术确定转染后HSF2在mRNA水平上转录增加; 通过Western blot方法证实融合蛋白的正确性及HSF2在蛋白质水平表达升高;利用激光共聚焦显微镜观察到绿色荧光代表的HSF2和红色荧光所代表的融合蛋白在细胞内的表达与定位. 从mRNA、蛋白质水平和蛋白定位3方面证实了重组质粒在Caco-2细胞中成功表达. 基因重组及质粒转染是一种研究特定基因的有效的分子生物学技术, 质粒转染过表达联合免疫荧光成像等技术, 在研究基因表达, 蛋白质在细胞内定位和信号转导等方面起着重要的作用[15,16]. 用含有强启动子pCMV的pCMV-Myc载体构建pCMV-HSF2-FLAG质粒能保证插入的目的基因高效持续表达[17,18]. 与目的蛋白融合的FLAG标签蛋白编码8个氨基酸的亲水性多肽(DYKDDDDK), FLAG作为融合表达标签, 通常不会与目的蛋白相互作用并且不会影响目的蛋白的性质、功能[19]. 应用anti-FLAG单克隆抗体, 可通过Western blot及激光共聚焦显微镜等方法对含有FLAG的融合蛋白进行特异性的检测、鉴定, 因此现FLAG标签已广泛的应用于蛋白表达、纯化、鉴定、功能研究及其蛋白相互作用等相关领域[20,21]. 激光共聚焦显微镜已成熟应用于原位鉴定细胞或组织内生物大分子, 观察细胞及亚细胞形态结构等领域, 通过荧光共振能量转移技术, 许多有关蛋白分子的共定位、蛋白分子聚合体、转录机制和蛋白折叠等分子生物学问题都可得到解决[22,23]. 通过构建pCMV-HSF2-FLAG真核表达载体, 联合RNA干扰和免疫共沉淀等技术, 我们可以比较过表达和沉默后HSF2对细胞在应激条件下的炎症, 凋亡和生存的影响, 以及HSF2介导这些变化时的转录调控机制和信号通路, 为UC的发病机制提供新的分子生物学线索.
HSF2大量表达于胚胎和精子等快速生长的组织, 我们的结果显示HSF2主要分布于细胞质, 与Kim等[24]关于HSF蛋白质定位的研究结果一致. 当细胞处于应激条件下时, 增加的变性蛋白竞争性地结合HSP70, 导致HSF从HSF-HSP70复合体中解离; 解离的HSF被蛋白激酶C或其他丝氨酸/苏氨酸激酶磷酸化形成同源三聚体, 暴露出DNA结合区和NLS(核定位序列); 在NLS介导下, 经一主动转运过程, HSF三聚体进入胞核, 通过DNA结合区结合HSP基因启动子内的特定区域开启HSP的转录以对抗应激和维持细胞稳态[25,26]. 激光共聚焦显示HSF2在细胞核膜处富集, 少量荧光信号在核中显示, 也验证应激时HSF2入核这一机制.
近年来对HSF1及HSP的功能及其在炎症中的作用已较为深入, HSF1可通过调节HSP的表达以及影响炎症相关的转录因子等途径, 抑制TNFα、IL-1等致炎因子的表达, 并抑制炎症信号通路中NF-κB、AP-1等关键转录因子的活性, 产生抗炎效应[27,28]. 然而国内外还未深入研究HSF2在炎症性疾病中的作用的, 其在UC发生发展中的分子机制, 转录调控信号通路还不明确. 探索UC的发病机制, 寻找特异的生物标记物及生物治疗靶点是当前研究的趋势[29,30]. 采用Caco-2细胞建立Transwell模型, 用LPS、IL-1β等炎症因子刺激细胞, 模拟结肠内环境, 联合质粒转染过表达或干扰沉默技术, 可以比较不同的HSF2水平对细胞炎症, 增殖、凋亡以及结肠屏障功能的影响, 为研究UC的发病机制和开发生物治疗靶点提供新的思路.
热休克转录因子(HSF)是调节内原性保护蛋白-热休克蛋白表达的主要调控因子. HSF2对热刺激耐受, 在维持细胞生长、发育和分化的调控以及延长机体生命方面起着重要作用. 本研究小组前期通过双向电泳及质谱分析等系列研究筛选出9个UC差异蛋白质, 发现HSF2为表达上调的蛋白, 推测其可能与UC发病机制有关.
高英堂, 研究员, 天津市第三中心医院
目前对HSF2的研究多集中在蛋白质错误折叠的疾病, 延缓衰老, 胚胎及精子发育等方向, 但其在诸如溃疡性结肠炎等炎症性疾病中的作用机制仍不明确.
目前对HSF2在疾病中的分子机制受到了广泛关注, 2011年有研究显示HSF2缺失后通过增加αB-crystallina的表达和多谷氨酰胺蛋白质的积累, 缩短 R6/2亨廷顿症小鼠的寿命. 另外, 其研究确认HSF2是维持蛋白质内稳态的主要调控者, 他可以作为神经退行性等蛋白质错误折叠疾病的一个潜在治疗靶点. 但HSF2在UC作用机制中的研究还未见报道.
基于前期双向电泳和质谱分析的结果, 将HSF2构建到真核表达载体pCMV-Myc中, 并在结肠上皮细胞Caco-2中表达, 为研究HSF2在溃疡性结肠炎发生发展中的分子机制奠定了实验基础.
采用Caco-2细胞建立Transwell模型, 用LPS, IL-1β等炎症因子刺激细胞, 模拟结肠内环境, 联合pCMV-HSF2-FLAG质粒转染过表达或干扰沉默技术, 可以比较不同的HSF2水平对细胞炎症, 增殖、凋亡以及结肠屏障功能的影响, 为研究UC的发病机制和开发生物治疗靶点提供新的思路.
本文具有一定的学术价值和意义.
编辑: 李军亮 电编:闫晋利
| 1. | Morimoto RI. The heat shock response: systems biology of proteotoxic stress in aging and disease. Cold Spring Harb Symp Quant Biol. 2011;76:91-99. [PubMed] [DOI] |
| 2. | Kondo T, Koga S, Matsuyama R, Miyagawa K, Goto R, Kai H, Araki E. Heat shock response regulates insulin sensitivity and glucose homeostasis: pathophysiological impact and therapeutic potential. Curr Diabetes Rev. 2011;7:264-269. [PubMed] [DOI] |
| 3. | Fujimoto M, Nakai A. The heat shock factor family and adaptation to proteotoxic stress. FEBS J. 2010;277:4112-4125. [PubMed] [DOI] |
| 4. | He H, Soncin F, Grammatikakis N, Li Y, Siganou A, Gong J, Brown SA, Kingston RE, Calderwood SK. Elevated expression of heat shock factor (HSF) 2A stimulates HSF1-induced transcription during stress. J Biol Chem. 2003;278:35465-35475. [PubMed] [DOI] |
| 5. | Björk JK, Sistonen L. Regulation of the members of the mammalian heat shock factor family. FEBS J. 2010;277:4126-4139. [PubMed] [DOI] |
| 6. | Abane R, Mezger V. Roles of heat shock factors in gametogenesis and development. FEBS J. 2010;277:4150-4172. [PubMed] [DOI] |
| 7. | Luo W, Sun W, Taldone T, Rodina A, Chiosis G. Heat shock protein 90 in neurodegenerative diseases. Mol Neurodegener. 2010;5:24. [PubMed] [DOI] |
| 8. | Shinkawa T, Tan K, Fujimoto M, Hayashida N, Yamamoto K, Takaki E, Takii R, Prakasam R, Inouye S, Mezger V. Heat shock factor 2 is required for maintaining proteostasis against febrile-range thermal stress and polyglutamine aggregation. Mol Biol Cell. 2011;22:3571-3583. [PubMed] [DOI] |
| 9. | Tomasello G, Sciumé C, Rappa F, Rodolico V, Zerilli M, Martorana A, Cicero G, De Luca R, Damiani P, Accardo FM. Hsp10, Hsp70, and Hsp90 immunohistochemical levels change in ulcerative colitis after therapy. Eur J Histochem. 2011;55:e38. [PubMed] [DOI] |
| 10. | Tanaka K, Mizushima T. Protective role of HSF1 and HSP70 against gastrointestinal diseases. Int J Hyperthermia. 2009;25:668-676. [PubMed] [DOI] |
| 11. | Akerfelt M, Morimoto RI, Sistonen L. Heat shock factors: integrators of cell stress, development and lifespan. Nat Rev Mol Cell Biol. 2010;11:545-555. [PubMed] [DOI] |
| 12. | Calderwood SK, Murshid A, Prince T. The shock of aging: molecular chaperones and the heat shock response in longevity and aging--a mini-review. Gerontology. 2009;55:550-558. [PubMed] [DOI] |
| 13. | Anckar J, Sistonen L. Regulation of HSF1 function in the heat stress response: implications in aging and disease. Annu Rev Biochem. 2011;80:1089-1115. [PubMed] [DOI] |
| 15. | Nieminen M, Tuuri T, Savilahti H. Genetic recombination pathways and their application for genome modification of human embryonic stem cells. Exp Cell Res. 2010;316:2578-2586. [PubMed] [DOI] |
| 16. | Gopalakrishnan B, Wolff J. siRNA and DNA transfer to cultured cells. Methods Mol Biol. 2009;480:31-52. [PubMed] [DOI] |
| 17. | Lai MD, Chen CS, Yang CR, Yuan SY, Tsai JJ, Tu CF, Wang CC, Yen MC, Lin CC. An HDAC inhibitor enhances the antitumor activity of a CMV promoter-driven DNA vaccine. Cancer Gene Ther. 2009;17:203-211. [PubMed] [DOI] |
| 18. | Magnusson T, Haase R, Schleef M, Wagner E, Ogris M. Sustained, high transgene expression in liver with plasmid vectors using optimized promoter-enhancer combinations. J Gene Med. 2011;13:382-391. [PubMed] [DOI] |
| 19. | Lakamp AS, Ouellette MM. A ssDNA Aptamer That Blocks the Function of the Anti-FLAG M2 Antibody. J Nucleic Acids. 2011;2011:720798. [PubMed] |
| 20. | Sasaki F, Okuno T, Saeki K, Min L, Onohara N, Kato H, Shimizu T, Yokomizo T. A high-affinity monoclonal antibody against the FLAG tag useful for G-protein-coupled receptor study. Anal Biochem. 2012;425:157-165. [PubMed] [DOI] |
| 21. | Abu-Farha M, Elisma F, Figeys D. Identification of protein-protein interactions by mass spectrometry coupled techniques. Adv Biochem Eng Biotechnol. 2008;110:67-80. [PubMed] [DOI] |
| 22. | Stehbens S, Pemble H, Murrow L, Wittmann T. Imaging intracellular protein dynamics by spinning disk confocal microscopy. Methods Enzymol. 2012;504:293-313. [PubMed] [DOI] |
| 23. | Wessels JT, Yamauchi K, Hoffman RM, Wouters FS. Advances in cellular, subcellular, and nanoscale imaging in vitro and in vivo. Cytometry A. 2010;77:667-676. [PubMed] [DOI] |
| 24. | Kim SA, Yoon JH, Ahn SG. Heat shock factor 4a (HSF4a) represses HSF2 expression and HSF2-mediated transcriptional activity. J Cell Physiol. 2012;227:1-6. [PubMed] [DOI] |
| 25. | Sakurai H, Enoki Y. Novel aspects of heat shock factors: DNA recognition, chromatin modulation and gene expression. FEBS J. 2010;277:4140-4149. [PubMed] [DOI] |
| 26. | Nishizawa-Yokoi A, Nosaka R, Hayashi H, Tainaka H, Maruta T, Tamoi M, Ikeda M, Ohme-Takagi M, Yoshimura K, Yabuta Y. HsfA1d and HsfA1e involved in the transcriptional regulation of HsfA2 function as key regulators for the Hsf signaling network in response to environmental stress. Plant Cell Physiol. 2011;52:933-945. [PubMed] [DOI] |
| 27. | Shimp SK, Parson CD, Regna NL, Thomas AN, Chafin CB, Reilly CM, Nichole Rylander M. HSP90 inhibition by 17-DMAG reduces inflammation in J774 macrophages through suppression of Akt and nuclear factor-κB pathways. Inflamm Res. 2012;61:521-533. [PubMed] [DOI] |
| 28. | Knowlton AA. NFkappaB, heat shock proteins, HSF-1, and inflammation. Cardiovasc Res. 2006;69:7-8. [PubMed] [DOI] |
| 29. | Florholmen J, Fries W. Candidate mucosal and surrogate biomarkers of inflammatory bowel disease in the era of new technology. Scand J Gastroenterol. 2011;46:1407-1417. [PubMed] [DOI] |
| 30. | Perrier C, Rutgeerts P. Cytokine blockade in inflammatory bowel diseases. Immunotherapy. 2011;3:1341-13524. [PubMed] [DOI] |