修回日期: 2012-08-12
接受日期: 2012-09-03
在线出版日期: 2012-09-18
根哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)所介导的细胞信号通路参与基因转录、蛋白翻译、核糖体合成、细胞凋亡等生物活动, 是细胞内重要信号通路之一. 其异常活化对某些遗传性疾病、肿瘤和糖尿病的发生关系密切. 如何通过各种生物学手段影响该信号传导通路, 从而对相关疾病的发生、治疗、转归、预后进行干预也成为现在研究的热点. 本文结合近年来学者对mTOR信号通路的组成结构、功能及其在常染色体显性遗传病-Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)中作用的研究进展进行综述, 以期能为以mTOR信号通路为靶点的分子靶向治疗应用于PJS的预防性治疗提供理论参考.
引文著录: 陆相吉, 顾国利. mTOR通路与Peutz-Jeghers综合征. 世界华人消化杂志 2012; 20(26): 2443-2447
Revised: August 12, 2012
Accepted: September 3, 2012
Published online: September 18, 2012
The mammalian target of rapamycin (mTOR) signaling pathway is one of the most important intracellular signal transduction pathways and is involved in a series of biological activities, such as gene transcription, protein translation, ribosome synthesis, and cell apoptosis. The abnormal activation of the mTOR signaling pathway has a close relationship with the development of some hereditary diseases, tumors and diabetes. Intervention with biological processes of these diseases by influencing the mTOR signalling pathway with all kinds of biological means has become a hot area of research for several years. This article reviews the recent advances in understanding the composition and function of the mTOR signaling pathway and its role in the pathogenesis of Peutz-Jeghers syndrome. It is expected that molecular therapy targeting the mTOR signalling pathway can be used for preventive therapy of Peutz-Jeghers syndrome.
- Citation: Lu XJ, Gu GL. mTOR signaling pathway and Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2012; 20(26): 2443-2447
- URL: https://www.wjgnet.com/1009-3079/full/v20/i26/2443.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i26.2443
Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS), 又称黑斑息肉病, 是一种以皮肤黏膜色素斑、胃肠道多发错构瘤息肉为特征的常染色体显性遗传病[1-3]. PJS息肉具有发病早、病程迁延的特点, 可引发肠套叠、出血、梗阻、恶变等并发症[4-6]. 目前PJS息肉的治疗以手术为主, 辅以内镜下切除. 这些手段仅能暂时延缓息肉发展, 无法达到预防息肉发生发展的目的. 众多PJS患者往往陷入"息肉反复治疗却反复生长, 最终恶变转移而致命"的悲惨境遇. 研究发现[7-9]: 哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路的异常活化在PJS息肉发生发展过程中扮演着重要角色. 如果能对PJS息肉中异常活化的mTOR信号通路加以阻断或抑制, 就能够达到预防息肉发生或延缓息肉发展的目的. 因此, 研究mTOR信号通路在PJS息肉发生发展中的作用具有重要的临床意义.
皮肤黏膜色素斑、胃肠道多发错构瘤息肉和家族遗传性是PJS的3大临床特征.
1.1.1 色素斑: PJS色素斑一般在幼儿时即发生, 好发于口唇周围、颊黏膜、指(趾)端、手足掌面; 可呈圆形、椭圆形、长条形及不规则型等, 无毛发、无瘙痒, 不会高出皮肤, 也不会恶变. 因黑色素含量的不同, PJS色素斑可呈黑色、黑蓝色、棕色及棕黄色; 除了颊黏膜色素斑终生不变外, 其他部位的色素斑多于青年时逐渐消失或变淡. 除了美容的要求外, PJS色素斑一般无需治疗.
1.1.2 胃肠道息肉: PJS息肉由正常的肠黏膜腺体组成, 腺体间有平滑肌束, 属于错构瘤. 具有数目多、大小不一、有或无蒂、全胃肠道分布的特点, 可引起急慢性腹痛、肠套叠、肠扭转、肠梗阻、胃肠道出血、息肉恶变等并发症, 这是导致PJS患者反复住院治疗的主要原因. 其好发部位依次为空肠、回肠、直肠、结肠、十二指肠、胃, 也可见于阑尾、输尿管、膀胱、尿道等. 研究发现: PJS不仅存在着由错构瘤→腺瘤→腺癌的演变过程, 还可通过其他恶变途径发生乳腺癌、胰腺癌、女性生殖系统肿瘤、睾丸支持细胞瘤、神经结胶质瘤等肠外肿瘤, 而且这些肠外肿瘤可作为PJS的首发表现. 因此, 临床上遇到上述PJS相关肿瘤患者时, 应警惕其是否为PJS.
1.1.3 家族遗传性: PJS是常染色体显性遗传病, 外显率高达90%. 流行病学调查显示: 约有60%的PJS患者具有明确或可疑的家族史; 部分可出现隔代遗传现象, 真正散发性PJS非常罕见. 因此, 临床上面对疑似PJS病例时, 除注意调查其父母发病情况外, 也应注意调查其祖父母、外祖父母有无PJS病例. 目前, 我国家庭规模趋于小型化, 家庭成员数目的减少将使PJS的遗传表现更加隐匿.
很多医疗机构和医生视PJS为少见病, 对其临床诊治并不重视. 然而, 流行病学调查显示: PJS发病率为1/25 000. 因此, PJS可能并不少见.
目前PJS的治疗以手术为主, 辅以内镜治疗, 尚无统一的治疗规范可循. 但是, 手术和内镜治疗都只是一种解救性的局部治疗手段, 仅能毁损致病基因的靶器官, 无法达到预防息肉发生、延缓息肉发展的目的. 这使PJS患者往往陷入"息肉反复治疗却反复生长、最终恶变转移而致命"的悲惨境遇; PJS患者及其家庭需要承受着巨大的精神痛苦和沉重的经济负担. 因此, 探索PJS息肉的预防性治疗方法具有重要的临床意义, 这也是PJS临床科研的方向[10,11].
近年研究发现[7-9]: 众多的细胞信号通路、细胞因子参与了PJS的生物学发展过程, 其中mTOR信号通路的异常活化在PJS发生发展过程中扮演着重要的促进角色. 如果能对PJS息肉中异常活化的mTOR信号通路加以阻断或抑制, 就能够达到预防息肉发生或延缓息肉发展的目的. 因此, mTOR信号通路的关键环节有可能成为PJS息肉治疗的分子靶点, 其相关抑制剂的临床应用将使PJS息肉的治疗进入预防性治疗和靶向治疗阶段.
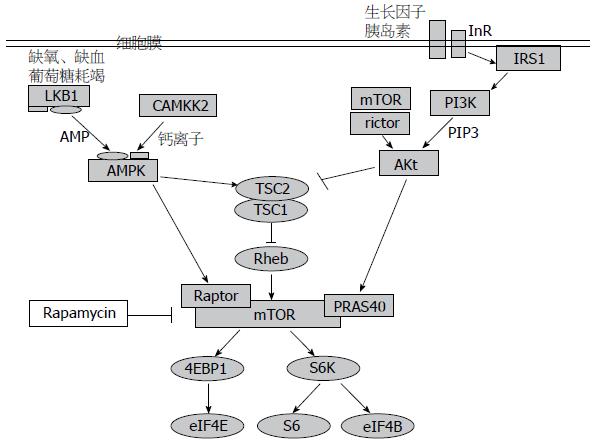
雷帕霉素靶蛋白(target of rapamycin, TOR)是一种丝氨酸/苏氨酸蛋白激酶[12], 属于磷脂酰肌醇3-激酶相关激酶(phosphatidylinositol 3-kinase-related kinase, PIKK)蛋白家族成员. 研究显示[13]: TOR广泛存在于从酵母到哺乳动物中, 且进化十分保守, 在调节细胞生长、增殖、调控细胞周期等多个方面起到重要作用. 哺乳动物中的TOR称为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR). 人类的mTOR基因位于染色体lp36.2, 其表达产物mTOR蛋白由2 459个氨基酸组成, 分子量为289 kDa; 主要存在于细胞内的内质网和高尔基体上[14]. mTOR相当于一个中继站, 通过整合氨基酸、能量、生长因子所激发的上游信号通路来控制其下游信号通路中与翻译、转录有关的多种蛋白的磷酸化, 从而调控细胞生长增殖和细胞周期. 其转导的信号通路的异常活化及突变与某些遗传性疾病、肿瘤和糖尿病的形成密切相关, 也成为某些遗传性疾病和肿瘤理想的治疗靶点之一[15-18](图1).
mTOR在细胞内主要是以两种复合体形式存在: mTORC1(mTOR-raptor)和mTORC2(mTOR-rictor); 前者对雷帕霉素(rapamycin)敏感, 而后者对雷帕霉素不敏感[19]. 研究发现[20-23]: mTORC1是通过感受和整合细胞内外营养因子、细胞因子及其他刺激的信号来调节转录水平、翻译水平时核糖体的形成及蛋白质的合成, 从而影响细胞的生长和增殖.
目前研究认为mTOR可被生长因子与胰岛素、营养因子、能量以及压力4类上游刺激因子激活. 其中经典的PI3K/AKT/mTOR通路可由生长因子和胰岛素激活. 而LKB1/AMPK/mTOR通路由营养因子、能量(低能)和压力(缺氧)因素激活. 但研究发现[24]: 可能还存在细胞外氨基酸通路, 当氨基酸缺乏, 特别是亮氨酸缺乏时, mTORC1可接受氨基酸信号, 游离出PRAS40而被激活, 从而使下游信号S6K1和4EBP1去磷酸化.
2.2.1 PI3K/AKT/mTOR通路: 当接受来自酪氨酸激酶和G蛋白偶联受体的信号后, PI3K的p85调节亚基即被募集到临近质膜的部位, 并将信号传递到p110亚基, 激活PI3K, PI3K激活后的产物PI-3,4-P2及PI-3,4,5-P3继续激活磷脂酰肌醇依赖激酶PDK-1/2, 使得位于Akt的Ser473和Thr308位点磷酸化激活, 实现Akt完全活化, 发挥其抑制TSC1/TSC2的作用. TSC1/TSC2作为结节性脑硬化复合物, 是mTOR活化所必需的刺激蛋白小GTP酶Rheb的抑制剂, 正常情况下对mTOR起到抑制作用[25]. 研究发现[26]: 在PI3K/AKT/mTOR通路中, 位于人染色体10q23的PTEN有诱导细胞周期停止和细胞凋亡, 调节细胞的粘连、移动和分化的功能, 可使PI3K激活后的产物PI-3,4-P2及PI-3,4,5-P3去磷化, 从而负性调节PI3K/AKT/mTOR通路.
2.2.2 LKB1/AMPK/mTOR通路: 抑癌基因LKB1又被称为STK11, 是丝氨酸/苏氨酸蛋白激酶家族的成员之一, 最初在人类PJS患者体内发现. LKB1通过磷酸化磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase, AMPK), 从而激活AMPK, 实现对mTOR活性的负性调控.而在细胞间压力改变、葡萄糖耗竭、缺氧和局部缺血等情况下, 细胞内AMP/ATP比例增大, 也可激活体内的能量调节器的AMPK. 从而实现对mTOR的调控[27].
激活后的mTOR可作用于下游的两个主要靶蛋白, 即核糖体蛋白p70S6K和真核细胞始动因子4E结合蛋白1(4E binding protein 1, 4EBP1), 两者均是蛋白翻译的关键调节因子. 正常情况下4EBP1与eIF-4E结合起到翻译抑制作用, 当mTOR信号通路磷酸化4EBP1后, 使得eIF-4E与其解离并活化, 启动蛋白质翻译. 而p70S6K磷酸化后激活其翻译功能, 提高翻译效率, 加速蛋白质的合成[28]. 正是这两个靶蛋白使得mTOR在G1期向S期转换过程中起了重要作用.
正常情况下, LKB1蛋白通过磷酸化AMPK使其激活, 激活的AMPK负性调控mTOR的活性. 然而, PJS的遗传学病因是LKB1的种系突变, 而LKB1突变将造成其编码产物-LKB1蛋白失活. 因此, PJS中的LKB1/AMPK/mTOR信号通路将处于异常活化状态, 这可能在PJS的发生和发展中扮演着非常重要的角色.
Shackelford等[27]证实: mTOR参与介导PJS小鼠模型的肿瘤代谢. Kuwada等[28]详细阐述了mTOR抑制剂治疗PJS的基本原理. Klümpen等[29]用mTOR抑制剂-依维莫司治疗1例由PJS而诱发的晚期胰腺癌患者, 其胰腺癌灶明显缩小. Robinson等[30]和Wei等[31]研究均证实: PJS小鼠模型在口服雷帕霉素后, 其肿瘤负荷明显减少, 并且其息肉的血管形成明显受抑制.
预防性治疗是PJS临床科研的焦点. mTOR抑制剂兼具预防性治疗和靶向治疗的双重作用, 是近年来国内外针对PJS胃肠道息肉治疗的研究热点之一, 具有广阔的应用前景[32]. 特别是新近合成的众多小分子mTOR抑制剂为PJS的预防性治疗提供更多的选择.
雷帕霉素(也称西罗莫司, Sirolimus)是最早研究出的mTOR特异抑制剂[30], 能有效抑制mTOR信号传导[31-33], 其通过阻断S6的磷酸化从而抑制蛋白质翻译、合成及引起细胞周期阻滞和细胞凋亡; 具有抗生素、免疫抑制及抗肿瘤的作用[30-34]. 研究发现[35-39]: mTOR抑制剂及衍生物对乳腺癌、肝癌、结肠癌、卵巢癌、白血病、肺癌、肾癌均有抑制作用. 其中新一代衍生物有坦西莫司(Temsirolimus)已被FDA批准试用于晚期肾癌的治疗. 而依维莫司(everolimus)作为新型口服的衍生物也已进入Ⅲ期临床研究阶段. 但这些大分子mTOR抑制剂的临床应用有典型的剂量依赖性, 同时可能出现头晕、头疼、恶心等症状, 以及红细胞、白细胞、血小板、血钾降低和血糖、血脂升高的现象.
大分子mTOR抑制剂存在人工合成困难、药物不稳定、用药途径不便、价格昂贵、免疫抑制等缺点. 近年来, 人们发现并人工合成了许多小分子mTOR抑制剂, 他们具有稳定性好、可完全人工合成、服用方便、价格便宜、不良反应较小的优点. 有些小分子mTOR抑制剂同时具有mTOR通路相关分子靶标的抑制功能, 特别是PI3K的双重或多重抑制剂将比单靶点抑制剂有更大的临床治疗优势. 其中NVP-BEZ235、PKI587、PKI179、GSK2126458、AZD8055、WYE-354等小分子mTOR抑制剂已进入临床阶段[40].
由于细胞信号通路的复杂性及对PJS认识的局限性, 针对mTOR的分子靶向治疗应用于PJS的临床治疗尚有许多问题需深入研究. (1)靶点问题: 除了mTOR靶点外, mTOR上下游通路的关键酶是否也能成为PJS治疗的新靶点; (2)用药规范问题: 分子靶向药物的使用时机、疗程和剂量; (3)疗效评价标准问题: 如何形成统一的检测标准来评价疗效? (4)药物不良反应: 大分子的雷帕霉素及其衍生物的免疫抑制不良反应比较严重, 是否会引发其他的疾病? (5)药物性价比问题: 大分子mTOR抑制剂目前价格昂贵, 长期吃药、定期检查及疗效评估的费用能否为普通家庭所承受? 这些问题也都是需要我们认真考虑的.
我们相信, 随着对mTOR信号通路在PJS中作用的认识加深和转化医学的进步, 通过以mTOR信号通路关键位点为靶点的抑制剂来实现对PJS发生、发展、治疗的调控方法有可能成为PJS治疗的研究趋势. 这种无创伤、选择性强、疗效好的方法有可能为众多PJS患者解除痛苦
Peutz-Jeghers综合征(PJS)是常染色体显性遗传病, 目前其临床治疗以手术为主, 辅以内镜治疗. 但是, 手术和内镜治疗都只是一种解救性的局部治疗手段, 仅能毁损致病基因的靶器官, 无法达到预防息肉发生、延缓息肉发展的目的. 这使PJS患者常常陷入"息肉反复治疗却反复生长、最终恶变转移而致命"的悲惨境遇. 哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的异常活化在PJS发生发展过程中扮演着重要的促进角色. 如果能对PJS息肉中异常活化的mTOR信号通路加以阻断或抑制, 就能够达到预防息肉发生或延缓息肉发展的目的. 因此, mTOR信号通路的关键环节有可能成为PJS息肉治疗的分子靶点, 其相关抑制剂的临床应用将使PJS息肉的治疗进入预防性治疗和分子靶向治疗阶段.
朱亮, 副教授, 大连医科大学生理教研室
应 mTOR信号通路的关键环节可能成为PJS息肉治疗的分子靶点, 其相关抑制剂的临床应用将使PJS息肉的治疗进入预防性治疗和分子靶向治疗阶段. 这将使众多PJS患者摆脱目前的临床治疗困境, 获得最大的临床受益.
Peutz-Jeghers综合征(PJS): 又称黑斑息肉病, 是一种以皮肤黏膜色素斑、胃肠道多发错构瘤息肉为特征的常染色体显性遗传病.
哺乳动物雷帕霉素靶蛋白(mTOR): 是一种丝氨酸/苏氨酸蛋白激酶, 属于磷脂酰肌醇3-激酶相关激酶(PIKK)蛋白家族成员. mTOR相当于一个中继站, 通过整合氨基酸、能量、生长因子所激发的上游信号通路来控制其下游信号通路中与翻译、转录有关的多种蛋白的磷酸化, 从而调控细胞生长增殖和细胞周期. 其转导的信号通路的异常活化及突变与某些遗传性疾病、肿瘤和糖尿病的形成密切相关, 也成为某些遗传性疾病和肿瘤理想的治疗靶点.
本文总结了近年来国内外关于PJS和mTOR信号通路及其抑制剂的研究进展, 提出了将mTOR信号通路抑制剂应用于PJS的预防性治疗的设想, 具有一定的创新性和临床使用价值.
编辑: 曹丽鸥 电编:闫晋利
| 2. | Kopacova M, Tacheci I, Rejchrt S, Bures J. Peutz-Jeghers syndrome: diagnostic and therapeutic approach. World J Gastroenterol. 2009;15:5397-5408. [PubMed] [DOI] |
| 3. | Wang Z, Chen Y, Wu B, Zheng H, He J, Jiang B. A novel mutation in STK11 gene is associated with Peutz-Jeghers syndrome in Chinese patients. BMC Med Genet. 2011;12:161. [PubMed] [DOI] |
| 5. | Li LJ, Wang ZQ, Wu BP. Peutz-Jeghers syndrome with small intestinal malignancy and cervical carcinoma. World J Gastroenterol. 2008;14:7397-7399. [PubMed] [DOI] |
| 6. | 顾 国利, 魏 学明, 徐 丽梅, 王 石林. Peutz-Jeghers综合征预防性治疗的研究. 胃肠病学和肝病学杂志. 2012;21:380-383. |
| 7. | Sebbagh M, Olschwang S, Santoni MJ, Borg JP. The LKB1 complex-AMPK pathway: the tree that hides the forest. Fam Cancer. 2011;10:415-424. [PubMed] [DOI] |
| 8. | Haidinger M, Werzowa J, Weichhart T, Säemann MD. Targeting the dysregulated mammalian target of rapamycin pathway in organ transplantation: killing 2 birds with 1 stone. Transplant Rev (Orlando). 2011;25:145-153. [PubMed] [DOI] |
| 9. | 王 石林, 顾 国利. Peutz-Jeghers综合征胃肠道息肉的药物干预性治疗的进展. 中国普外基础与临床杂志. 2009;16:333-335. |
| 11. | 王 石林, 顾 国利, 魏 学明, 毛 高平, 宁 守斌. Peutz-Jeghers综合征临床综合治疗模式初探(附71例报道). 中国普外基础与临床杂志. 2012;19:502-506. |
| 12. | Bolukbasi E, Vass S, Cobbe N, Nelson B, Simossis V, Dunbar DR, Heck MM. Drosophila poly suggests a novel role for the Elongator complex in insulin receptor-target of rapamycin signalling. Open Biol. 2012;2:110031. [PubMed] [DOI] |
| 13. | Schmukler E, Shai B, Ehrlich M, Pinkas-Kramarski R. Neuregulin promotes incomplete autophagy of prostate cancer cells that is independent of mTOR pathway inhibition. PLoS One. 2012;7:e36828. [PubMed] [DOI] |
| 15. | 杨 鹏宇, 张 建生. mTOR抑制剂治疗胶质瘤的研究进展. 国际神经病学神经外科学杂志. 2009;36:548-551. |
| 17. | Martelli AM, Chiarini F, Evangelisti C, Cappellini A, Buontempo F, Bressanin D, Fini M, McCubrey JA. Two hits are better than one: targeting both phosphatidylinositol 3-kinase and mammalian target of rapamycin as a therapeutic strategy for acute leukemia treatment. Oncotarget. 2012;3:371-394. [PubMed] |
| 18. | Shaw RJ. LKB1 and AMP-activated protein kinase control of mTOR signalling and growth. Acta Physiol (Oxf). 2009;196:65-80. [PubMed] [DOI] |
| 19. | Huynh H. Molecularly targeted therapy in hepatocellular carcinoma. Biochem Pharmacol. 2010;80:550-560. [PubMed] [DOI] |
| 20. | Ekstrand AI, Jönsson M, Lindblom A, Borg A, Nilbert M. Frequent alterations of the PI3K/AKT/mTOR pathways in hereditary nonpolyposis colorectal cancer. Fam Cancer. 2010;9:125-129. [PubMed] [DOI] |
| 21. | The class I PI3K/Akt pathway is critical for cancer cell survival in dogs and offers an opportunity for therapeutic intervention. BMC Vet Res. 2012;8:73. [PubMed] |
| 22. | Lam KK, Zheng X, Forestieri R, Balgi AD, Nodwell M, Vollett S, Anderson HJ, Andersen RJ, Av-Gay Y, Roberge M. Nitazoxanide stimulates autophagy and inhibits mTORC1 signaling and intracellular proliferation of Mycobacterium tuberculosis. PLoS Pathog. 2012;8:e1002691. [PubMed] [DOI] |
| 23. | Talos DM, Sun H, Zhou X, Fitzgerald EC, Jackson MC, Klein PM, Lan VJ, Joseph A, Jensen FE. The interaction between early life epilepsy and autistic-like behavioral consequences: a role for the mammalian target of rapamycin (mTOR) pathway. PLoS One. 2012;7:e35885. [PubMed] [DOI] |
| 24. | 郑 鹏生, 冀 静. mTOR信号通路与肿瘤的研究进展. 西安交通大学学报(医学版). 2010;31:1-9. |
| 25. | González-Estévez C, Felix DA, Smith MD, Paps J, Morley SJ, James V, Sharp TV, Aboobaker AA. SMG-1 and mTORC1 act antagonistically to regulate response to injury and growth in planarians. PLoS Genet. 2012;8:e1002619. [PubMed] [DOI] |
| 26. | Yoshimi A, Goyama S, Watanabe-Okochi N, Yoshiki Y, Nannya Y, Nitta E, Arai S, Sato T, Shimabe M, Nakagawa M. Evi1 represses PTEN expression and activates PI3K/AKT/mTOR via interactions with polycomb proteins. Blood. 2011;117:3617-3628. [PubMed] [DOI] |
| 27. | Shackelford DB, Vasquez DS, Corbeil J, Wu S, Leblanc M, Wu CL, Vera DR, Shaw RJ. mTOR and HIF-1alpha-mediated tumor metabolism in an LKB1 mouse model of Peutz-Jeghers syndrome. Proc Natl Acad Sci U S A. 2009;106:11137-11142. [PubMed] [DOI] |
| 28. | Kuwada SK, Burt R. A rationale for mTOR inhibitors as chemoprevention agents in Peutz-Jeghers syndrome. Fam Cancer. 2011;10:469-472. [PubMed] [DOI] |
| 29. | Klümpen HJ, Queiroz KC, Spek CA, van Noesel CJ, Brink HC, de Leng WW, de Wilde RF, Mathus-Vliegen EM, Offerhaus GJ, Alleman MA. mTOR inhibitor treatment of pancreatic cancer in a patient With Peutz-Jeghers syndrome. J Clin Oncol. 2011;29:e150-e153. [PubMed] [DOI] |
| 30. | Robinson J, Lai C, Martin A, Nye E, Tomlinson I, Silver A. Oral rapamycin reduces tumour burden and vascularization in Lkb1(+/-) mice. J Pathol. 2009;219:35-40. [PubMed] [DOI] |
| 31. | Wei C, Amos CI, Zhang N, Zhu J, Wang X, Frazier ML. Chemopreventive efficacy of rapamycin on Peutz-Jeghers syndrome in a mouse model. Cancer Lett. 2009;277:149-154. [PubMed] [DOI] |
| 32. | Shuch B, Vourganti S, Friend JC, Zehngebot LM, Linehan WM, Srinivasan R. Targeting the mTOR pathway in Chromophobe Kidney Cancer. J Cancer. 2012;3:152-157. [PubMed] [DOI] |
| 33. | Advani SH. Targeting mTOR pathway: A new concept in cancer therapy. Indian J Med Paediatr Oncol. 2010;31:132-136. [PubMed] [DOI] |
| 34. | Roulin D, Waselle L, Dormond-Meuwly A, Dufour M, Demartines N, Dormond O. Targeting renal cell carcinoma with NVP-BEZ235, a dual PI3K/mTOR inhibitor, in combination with sorafenib. Mol Cancer. 2011;10:90. [PubMed] [DOI] |
| 36. | Zhang Y, Zhang JW, Lv GY, Xie SL, Wang GY. Effects of STAT3 gene silencing and rapamycin on apoptosis in hepatocarcinoma cells. Int J Med Sci. 2012;9:216-224. [PubMed] [DOI] |
| 37. | Matsubara H, Sakakibara K, Kunimitsu T, Matsuoka H, Kato K, Oyachi N, Dobashi Y, Matsumoto M. Non-small cell lung carcinoma therapy using mTOR-siRNA. Int J Clin Exp Pathol. 2012;5:119-125. [PubMed] |
| 38. | Elfiky AA, Aziz SA, Conrad PJ, Siddiqui S, Hackl W, Maira M, Robert CL, Kluger HM. Characterization and targeting of phosphatidylinositol-3 kinase (PI3K) and mammalian target of rapamycin (mTOR) in renal cell cancer. J Transl Med. 2011;9:133. [PubMed] [DOI] |
| 39. | Wang Y, Wang XY, Subjeck JR, Shrikant PA, Kim HL. Temsirolimus, an mTOR inhibitor, enhances anti-tumour effects of heat shock protein cancer vaccines. Br J Cancer. 2011;104:643-652. [PubMed] [DOI] |