修回日期: 2012-08-03
接受日期: 2012-08-11
在线出版日期: 2012-09-08
目的: 探讨胆总管结扎(bile duct ligation, BDL)大鼠肝硬化不同阶段肾组织中水通道蛋白2(aquaporins-2, AQP2)表达的变化; 用丹参注射液干预肝硬化腹水大鼠, 观察丹参注射液对其表达的影响.
方法: 将70只♂SD大鼠随机分成假手术组、模型组. 模型组分别于结扎后1、2、3、4 wk麻醉10只动物. 假手术组与4 wk模型组同批麻醉. 4 wk末时, 再从剩余存活造模大鼠中, 随机选取16只腹腔穿刺证实有腹水的大鼠, 随机分为治疗组和对照组. 从造模第5周开始进行治疗观察. 治疗组给予丹参注射液2 mL腹腔注射, 1次/d, 连用2 wk. 对照组给予蒸馏水2 mL腹腔注射, 1次/d, 连用2 wk, 6 wk末2组同批麻醉. 采用HE染色、Masson三色染色确定模型建立情况; 肾脏组织标本采用HE染色, 光镜下观察组织学变化, 应用免疫组织化学方法测定AQP2的表达及分布.
结果: 造模1-4 wk大鼠肾组织AQP2的阳性染色平均吸光度A值(皮质: 0.4703±0.0313, 0.4832±0.0212, 0.5081±0.0417, 0.6802±0.0531; 髓质: 0.4320±0.0237, 0.4724±0.0284, 0.4796±0.0451, 0.5187±0.0612)均高于假手术组(皮质: 0.4197±0.0295; 髓质: 0.4139±0.0152, P<0.05), 提示肝硬化进程中, AQP2在肾皮质和肾髓质的表达均逐渐增强. 治疗组(皮质: 0.4233±0.0521, 髓质: 0.4158±0.0413)大鼠肾组织AQP2的阳性染色平均A值显著低于对照组(皮质: 0.5536±0.0476, 髓质: 0.4764±0.0536, P<0.05).
结论: 以BDL法制备的大鼠肝硬化模型中存在着肾脏AQP2表达的上调, 提示在肝硬化进程中, 肾脏集合管可能参与了水重吸收的增加; 而丹参注射液可以下调肝硬化腹水大鼠肾脏AQP2的高表达.
引文著录: 王建华, 郭永泽, 张晓岚. 水通道蛋白2在胆总管结扎大鼠肝硬化肾组织中的表达及丹参注射液对其表达的影响. 世界华人消化杂志 2012; 20(25): 2393-2396
Revised: August 3, 2012
Accepted: August 11, 2012
Published online: September 8, 2012
AIM: To detect the expression of aquaporin 2 (AQP2) in kidney tissue of rats with BDL-induced cirrhosis and to observe the effect of treatment with salvia miltiorrhiza on AQP2 expression in this animal model.
METHODS: Seventy SD rats were randomly divided into sham operation group and model group. To induce biliary cirrhosis, SD rats underwent double ligation and sectioning of the common bile duct (BDL). Animals in the model group were sacrificed at weeks 1, 2, 3 and 4. At week 5, the model group was divided into two groups: treatment group and control group. Rats in the treatment group were treated with salvia miltiorrhiza, while those in the control group was treated with vehicle. Liver histopathological changes were evaluated by hematoxylin and eosin (H&E) staining and Masson's trichrome staining. Kidney histopathological changes were evaluated by H&E staining. Immunohistochemistry was employed to investigate the expression of AQP2 in kidney tissue of cirrhotic rats.
RESULTS: With the progression of hepatic cirrhosis, the expression of AQP2 increased gradually. The optical density (OD) of renal AQP2 at weeks 1 to 4 was significantly higher in the model group than in the sham operation group (cortex: 0.4703 ± 0.0313, 0.4832 ± 0.0212, 0.5081 ± 0.0417, 0.6802 ± 0.0531 vs 0.4197 ± 0.0295; medulla: 0.4320 ± 0.0237, 0.4724 ± 0.0284, 0.4796 ± 0.0451, 0.5187 ± 0.0612 vs 0.4139 ± 0.0152; all P < 0.05). The expression of AQP2 in the control group was higher than that in the treatment group. The OD of renal AQP2 in the control group was significantly higher than that in the treatment group (cortex: 0.5536 ± 0.0476 vs 0.4233 ± 0.0521; medulla: 0.4764 ± 0.0536 vs 0.4158 ± 0.0413, both P < 0.05).
CONCLUSION: The expression of AQP2 is up-regulated in kidney tissue of cirrhotic rats. Salvia miltiorrhiza treatment reduced the expression of AQP2 in kidney tissue of cirrhotic rats.
- Citation: Wang JH, Guo YZ, Zhang XL. Salvia miltiorrhiza reduces expression of aquaporin 2 in kidney tissue of cirrhotic rats. Shijie Huaren Xiaohua Zazhi 2012; 20(25): 2393-2396
- URL: https://www.wjgnet.com/1009-3079/full/v20/i25/2393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i25.2393
肝硬化是多种肝病终末期的共同病理变化, 其失代偿阶段的标志之一是腹水生成. 腹水的发生有多种病理生理因素参与, 其机制尚未完全阐明, 但目前普遍认为水钠潴留是腹水发生的重要因素. 本文将研究水调节的关键蛋白-水通道蛋白2(aquaporins-2, AQP2)在肝硬化腹水模型肾组织的表达, 同时观察丹参注射液对其的影响.
成年健康♂SD大鼠70只, 体质量350-400 g, 清洁级, 由河北医科大学实验动物中心提供(DK0410-0054). 丹参注射液(Salvia Miltiorrhiza injection, SMI)(正大集团公司, 批号Z30020177, 10 mL/支, 相当于含生药15 g). 羊抗AQP2多克隆抗体、SP9003试剂盒、DAB显色剂及多聚赖氨酸均购自美国Santa Cruze公司.
1.2.1 造模及实验动物分组: 将70只大鼠随机分成假手术组、模型组. 应用胆总管结扎(bile duct ligation, BDL)方法建立胆汁淤积性肝硬化大鼠模型. 模型组共60只, 分别于结扎后1、2、3、4 wk麻醉10只动物. 假手术组10只, 与4 wk模型组同批麻醉. 第4周末肝病理学检查提示肝硬化模型复制成功. 4 wk末时, 再从剩余存活造模大鼠中, 随机选取16只腹腔穿刺证实有腹水的大鼠, 随机分为治疗组和对照组, 每组8只.
1.2.2 治疗: 从造模第5周开始进行治疗观察. 治疗组给予丹参注射液2 mL腹腔注射, 1次/d, 连用2 wk. 对照组给予蒸馏水2 mL腹腔注射, 1次/d, 连用2 wk, 6 wk末2组同批麻醉.
1.2.3 取材: 各组动物麻醉后, 于无菌条件下切开皮肤进入腹腔, 留取双侧肾组织, 4%多聚甲醛固定, 石蜡包埋、切片, 送HE染色和免疫组织化学染色; 同时切取部分肝脏左叶, 4%多聚甲醛固定, 常规石蜡切片, 用于HE染色和Masson三色染色.
1.2.4 HE染色和Masson三色染色: 肝肾组织做5 µm连续切片, 按常规程序进行染色.
1.2.5 肾组织AQP2免疫组织化学染色: 采用SP方法. 石蜡包埋的肝组织以5 µm的厚度连续切片, 二甲苯脱蜡, 乙醇梯度水化; 3%甲醇-过氧化氢室温下孵育20 min, 消除内源性过氧化物酶, 0.01 mol/L枸橼酸缓冲液(pH 6.0)微波炉内抗原修复, 100 mL/L山羊血清封闭非特异性染色. 加入一抗(羊抗AQP2, 1:100), 4 ℃过夜; 滴加生物素化二抗工作液, 37 ℃温箱湿盒内孵育30 min, 0.01 mol/L PBS清洗3次, 每次5 min; 滴加辣根过氧化物酶标记链酶卵白素工作液, 37 ℃温箱湿盒内孵育30 min; DAB显色2-5 min, 自来水充分冲洗, 终止显色, 梯度乙醇脱水, 二甲苯透明, 中性树胶封固. 免疫组织化学染色对照设置: 以PBS代替一抗进行上述染色作为空白对照, 结果为阴性. 棕黄色为阳性染色.
1.2.6 图像分析: 采用Motic 6.0数码医学图像分析系统, 各组织采用相同放大倍数(肝组织×200, 肾皮质×400, 肾髓质×200), 每个切片计数10个视野, 以阳性染色的积分吸光度(IA)值来表示抗原表达量, 对AQP2免疫阳性染色的A值进行测定, 然后用Nikon尼康光镜显微照相机摄片. 光镜标本制成后, 直接在光镜下观察病理改变并摄片.
统计学处理 数据利用SPSS13.0统计软件进行分析. 计量资料以mean±SD表示, 多组间比较采用单因素方差分析(One-way ANOVA)及q检验, 两组间采用t检验. P<0.05为差异有统计学意义.
假手术组大鼠皮毛光泽, 体质量稳定增加. 模型组于造模2-3 d开始, 全身色泽变黄, 小便颜色加深; 造模1 wk以后, 食欲逐渐减退, 体质量下降, 嗜睡, 活动减少, 至造模4 wk多数模型大鼠发生腹水. 实验过程中由于麻醉、手术出血及疾病进展, 先后有4只大鼠死亡, 分别在假手术组、造模1 wk及4 wk时.
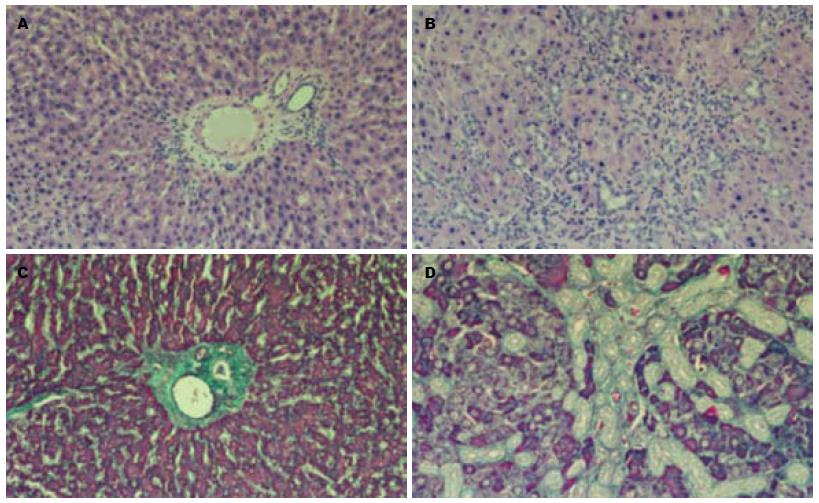
模型大鼠肝脏肉眼观呈褐绿色或棕色, 表面呈细颗粒状, 明显增大, 质地变硬, 边缘变钝. HE及Masson三色染色显示, 造模3-4 wk肝脏广泛纤维结缔组织增生, 增生的纤维间隔互相连接、包绕、分割, 改建原来的肝小叶甚至形成假小叶. 假手术组肝小叶结构完整, 肝板排列整齐, 少量结缔组织局限于门管区(图1).
假手术组大鼠肾脏肉眼观察色泽红润, 大小正常, 光镜下肾小球结构清晰, 肾小管上皮细胞排列整齐, 基底膜完整. 模型组大鼠肾脏肉眼观呈棕褐色, 随造模时间延长, 色泽有所加深; 但表面光滑. HE染色显示大鼠肝硬化进程中肾脏病理组织学与假手术组比较无明显差异.
免疫组织化学显示, 正常大鼠肾组织中有少量表达; 随着肝硬化的发展, 大鼠肾组织中AQP2阳性细胞明显增多, 主要分布于集合管, 造模1-4 wk大鼠肾组织AQP2的A值均高于假手术组(表1, P<0.05).
AQPs是一组介导不同类型细胞膜跨膜转运水的通道蛋白[1]. 迄今哺乳动物中已发现13个AQPs[2]. 肾脏作为整个机体调节水平衡的主要器官, 其AQPs含量最丰富, 至少表达7种AQPs(AQP1-4, AQP6-8), 其中AQP2又被称为集合管水通道, 是调节肾集合管对水通透性的主要水通道蛋白[3]. 我们通过用BDL方法制备肝硬化大鼠模型, 应用免疫组织化学方法检测大鼠肝硬化过程中肾组织AQP2表达, 探讨AQP2在肝硬化腹水形成中的作用; 然后, 我们用丹参注射液干预肝硬化腹水大鼠, 初步了解其对AQP2表达的影响.
本研究结果显示, 随着肝硬化的进展, 大鼠肾脏皮质、髓质中AQP2阳性细胞明显增多, 主要分布于集合管. 造模1-4 wk大鼠肾脏皮质、髓质AQP2阳性面积依次增高, 均显著高于假手术组, 提示肾脏集合管可能参与了水的重吸收的增加. 与我们的研究相一致, 孙剑勇等[4]用40% CCl4-橄榄油溶液皮下注射14 wk造模, 制备肝硬化腹水大鼠模型, 发现腹水大鼠AQP2蛋白及mRNA全面上调. 但是, 也有相反的报道, 在多项采用由BDL制备的肝硬化(代偿)动物模型的实验中发现, 血浆AVP水平正常, AQP2在肾皮质中的表达降低, 而在内髓中无明显改变, 作者对这种改变的解释是"AQP2表达的下调可能是肝硬化代偿阶段对于水潴留的一种适当反应, 当进展至失代偿阶段时, 伴随着血浆AVP水平的增高才会出现AQP2的上调[5-7]". AQP2表达主要受AVP的调节, AVP与主细胞管周膜上受体结合, 使主细胞内腺苷酸水平增高[8], 后者激活蛋白激酶A, 激活的蛋白激酶A使AQP2磷酸化, 然后AQP2转移至管腔膜, 致管腔膜上AQP2密度增加, 从而提高对水的通透性[9].
丹参的脂溶性成分主要是丹参酮, 水溶性成分包括丹参素、原儿茶醛、丹参酚酸. 丹参注射液以水溶性成分为主. 已有研究证实, 丹参有利尿作用. 胡波等[10,11]发现, 丹参能显著降低糖尿病大鼠肾组织中AQP2的蛋白表达和基因表达. 但是, 丹参是否影响肝硬化腹水时肾组织中AQP2的表达, 目前尚缺乏研究.
我们采用丹参注射液干预肝硬化腹水大鼠2 wk, 结果显示治疗组AQP2染色阳性细胞数量明显少于对照组, 提示丹参可以下调肝硬化腹水时肾组织中AQP2的高表达. 但是有关通过哪些信号通路来调节肾组织AQP2的表达, 有待进一步深入研究. 因此, 深入探讨丹参注射液对AQP-2的调控机制, 将为我们临床治疗肝硬化腹水提供新的治疗方向.
腹水是肝硬化由代偿转化为失代偿的一个重要标志, 难治性腹水则是失代偿早中期转化为晚期的重要表现. 肝移植是肝硬化难治性腹水及其并发症最终的有效治疗手段, 但是费用昂贵并且肝源有限, 限制了他在基层医院的应用. 因此, 选择一种具有利尿作用而且经济实用的药物是当务之急.
高润平, 教授, 吉林大学第一医院肝胆胰内科
肝硬化难治性腹水的治疗一直是临床上所感兴趣的话题. 其机制尚未完全阐明, 但目前普遍认为水钠潴留是腹水发生的重要因素. 最近研究发现水调节的关键蛋白-水通道蛋白2(AQP2)可能与肝硬化腹水的发生有关.
已有研究证实丹参增加肾血流, 有利尿和抗炎作用, 调节肾组织局部微循环, 改善肾功能. 最近研究证实, 丹参治疗能显著降低糖尿病大鼠肾组织中的AQP2蛋白表达, 推测丹参对糖尿病大鼠肾脏的保护作用可能与降低AQP2的表达有关.
本研究发现, AQP2参与了肝硬化腹水的发生发展, 丹参可以下调肝硬化腹水时肾组织中AQP2的表达, 为临床治疗肝硬化腹水提供新的治疗方向.
本研究内容新颖, 研究方法具有一定的科学性, 其对于肝硬化腹水形成机制的探讨具有参考价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Hachez C, Chaumont F. Aquaporins: a family of highly regulated multifunctional channels. Adv Exp Med Biol. 2010;679:1-17. [PubMed] [DOI] |
| 2. | Ishibashi K, Hara S, Kondo S. Aquaporin water channels in mammals. Clin Exp Nephrol. 2009;13:107-117. [PubMed] [DOI] |
| 3. | Bonilla-Felix M. Development of water transport in the collecting duct. Am J Physiol Renal Physiol. 2004;287:F1093-F1101. [PubMed] [DOI] |
| 5. | Fernández-Llama P, Turner R, Dibona G, Knepper MA. Renal expression of aquaporins in liver cirrhosis induced by chronic common bile duct ligation in rats. J Am Soc Nephrol. 1999;10:1950-1957. [PubMed] |
| 6. | Jonassen TE, Nielsen S, Christensen S, Petersen JS. Decreased vasopressin-mediated renal water reabsorption in rats with compensated liver cirrhosis. Am J Physiol. 1998;275:F216-F225. [PubMed] |
| 7. | Jonassen TE, Promeneur D, Christensen S, Petersen JS, Nielsen S. Decreased vasopressin-mediated renal water reabsorption in rats with chronic aldosterone-receptor blockade. Am J Physiol Renal Physiol. 2000;278:F246-F256. [PubMed] |
| 8. | Wang W, Li C, Summer S, Falk S, Schrier RW. Interaction between vasopressin and angiotensin II in vivo and in vitro: effect on aquaporins and urine concentration. Am J Physiol Renal Physiol. 2010;299:F577-F584. [PubMed] [DOI] |
| 9. | Moeller HB, Praetorius J, Rützler MR, Fenton RA. Phosphorylation of aquaporin-2 regulates its endocytosis and protein-protein interactions. Proc Natl Acad Sci U S A. 2010;107:424-429. [PubMed] [DOI] |