修回日期: 2012-07-23
接受日期: 2012-08-08
在线出版日期: 2012-08-28
目的: 构建转录因子HIF-1α表达的RNA干扰(RNA interference, RNAi)质粒, 为研究HIF-1α参与的细胞信号通路及以HIF-1α为靶点的基因治疗提供稳定转染细胞的RNAi.
方法: 选取HIF-1α基因的19 nt特异性序列, 设计针对HIF-1α的shRNA序列, 应用基因重组技术克隆到pSilencer 1.0-U6表达载体中, 利用EcoRⅠ和ApaⅠ双酶切和DNA测序鉴定重组克隆. 低氧条件下, 将包含HIF-1α基因RNAi序列的重组载体转染人胃癌细胞SGC-7901, 转染48 h后, 收集细胞裂解液, Western blotting分析低氧条件下对照组与转染组HIF-1α蛋白的表达水平.
结果: 双酶切证实shRNA插入pSilencer 1.0-U6质粒, DNA测序证实插入的序列正确; HIF-1α基因RNAi质粒转染胃癌细胞SGC-7901成功; Western blotting结果显示与空质粒对照组比转染组细胞HIF-1α表达下调.
结论: 成功构建人HIF-1α基因RNAi质粒, 为研究HIF-1α参与的细胞信号通路提供了稳定转染细胞的干扰质粒. 同时, 阻断HIF-1α的信号通路将为肿瘤基因治疗提供一个较好的靶点, 研究结果为以HIF-1α为靶向的基因治疗提供了有利工具.
引文著录: 龚青, 方淑环, 高国全. HIF-1α基因RNA干扰质粒在胃癌细胞中的构建与鉴定. 世界华人消化杂志 2012; 20(24): 2254-2258
Revised: July 23, 2012
Accepted: August 8, 2012
Published online: August 28, 2012
AIM: To construct a plasmid carrying a small hairpin RNA (shRNA) targeting the HIF-1α gene and to observe its expression in gastric cancer SGC-7901 cells.
METHODS: SHIF-1α-specific shRNA sequence was designed, synthesized and cloned into the expression vector pSilencer 1.0-U6. The recombinants were identified by double digestion with EcoRⅠ+ ApaⅠand DNA sequencing, and then transfected into SGC-7901 cells under hypoxia. Forty-eight hours after transfection, HIF-1α expression was detected by Western blotting.
RESULTS: Restriction enzyme digestion and DNA sequencing confirmed that the shRNA was correctly inserted into the plasmid pSilencer 1.0-U6. The recombinant plasmid carrying the shRNA targeting HIF-1α was successfully transfected into SGC-7901 cells. Western blot analysis suggested that HIF-1α expression was knocked down in transfected cells compared to control cells.
CONCLUSION: A plasmid carrying a shRNA targeting HIF-1α has been constructed successfully, and SGC-7901 cells stably transfected with this recombinant vector have been obtained. These will offer favorable tools for studying HIF-1α-targeted gene therapy.
- Citation: Gong Q, Fang SH, Gao GQ. Construction of a vector carrying a small hairpin RNA targeting the HIF-1α gene and its expression in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2012; 20(24): 2254-2258
- URL: https://www.wjgnet.com/1009-3079/full/v20/i24/2254.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i24.2254
1955年, Thomlinson等[1]发现恶性肿瘤组织内存在缺氧的现象. 早期缺氧在研究中受到重视是因为其对放疗具有抗性作用, 近年来与低氧相关的分子作为治疗靶点也日益受到重视. 肿瘤细胞因生长失控使其增殖、代谢异常旺盛, 耗氧量随之大幅增加, 这些高度新陈代谢的肿瘤组织在得不到所需要的氧气时就造成了肿瘤组织低氧或缺氧的微环境. 实体肿瘤内部这种广泛存在的缺氧现象, 与肿瘤的远处转移、不良预后以及放化疗的耐受性关系密切[2]. 1995年, Wang等[3]利用Epo基因启动子内部的缺氧反应元件(Hypoxia-responsive element, HRE)及其亲和力第一次纯化出低氧诱导因子1(Hypoxia-inducible factor-1, HIF-1). HIF-1是一种由异源二聚体组成的转录因子, 由HIF-1α和HIF-1β两个亚单位构成[4]. 其中, HIF-1α是主要的功能亚基, 受多种因素的调控; HIF-1β是一种组成型表达的亚基, 主要起结构性作用, 在细胞内稳定表达[3]. 常氧下, HIF-1α在脯氨酸羟化酶(prolyl hydroxylases, PHDs)的作用下, 肿瘤抑制蛋白VHL(von Hippel-Lindau tumor suppressor protein, pVHL)能作为一种特异性的E3泛素化蛋白酶携带泛素直接与HIF-1α结合, 并随之募集Elongin B、Elongin C、Cullin2和RBX1(Ring-Box 1)形成E3泛素-蛋白酶复合体, 泛素化的HIF-1α立即被26S蛋白酶复合体结合并降解[5-8]. 低氧下, 由于HIF-1α泛素化降解减少, 转入核内与HIF-1β结合, 募集CBP/P300形成转录起始复合物, 从而启动目标基因的转录[9,10]. 近年来大量的研究表明, HIF-1可以识别许多基因启动子内部的HRE, 从而控制基因的表达, 参与多条信号通路的调控, 目前发现受转录因子HIF-1调控的基因多达60多种, 如红细胞生成素(erythrogenin, EPO)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等, 在肿瘤的生长、血管生成、转移等方面起着十分重要的作用[11-13]. RNA干扰(RNA interference, RNAi)是双链RNA介导的特异性基因沉默现象,是目前研究基因功能强有力的工具之一[14]. 自从RNAi现象被发现以来, 作为自然界生物中广泛存在的一种保守的自我保护现象, RNAi已成为近几年来基因组学研究的热点内容之一, 研究领域也已拓展到基因治疗范围. RNAi技术不仅在基因治疗研究中应用日渐广泛, 也已成为重要的分子研究工具. 本研究以siRNA介导HIF-1α表达沉默, 采用脂质体作为转染试剂, 观察siRNA导入后对人胃癌细胞SGC-7901内的HIF-1α表达的抑制作用, 为研究HIF-1α参与的细胞信号通路及以HIF-1α为靶点的基因治疗提供了稳定的转染细胞干扰质粒.
载体质粒为pSilencer 1.0-U6; SGC-7901细胞株购自美国ATCC; 大肠杆菌DH25α为本实验室保存; 限制性内切酶EcoRⅠ、ApaⅠ、T4DNA连接酶购自美国Invitrogen公司; DNA胶回收试剂盒购自美国Qiagen公司; DNA Maker购自广州东盛生物科技有限公司; 1640、脂质体Lipofectamine 2000、Gibco胎牛血清购自美国Invitrogen公司; 质粒抽提试剂盒为NucleoBond Xtra MiDi EF(美国).
1.2.1 RNA干扰质粒的设计、构建和鉴定: pSilencer 1.0-U6 Vector为RNAi专用载体. 按照siRNA靶序列设计原则, 选取基因mRNA序列中的19个寡核苷酸作为siRNA干扰区域, 自行设计一对针对HIF-1α的shRNA互补序列, 插入pSilencer 1.0-U6, pSilencer 1.0-U6 Vector含有mouse U6 promoter, 进入哺乳细胞后能转录产生发夹状的siRNA, 有特定的转录起始位点(U6启动子决定)和特定转录终止位点(转录模板链为下链, 转录终止位点在antisense strand后"TT↓TTTT"中), 转录产物为茎环结构: 3'端有UU突出. Dicer酶水解产生SiRNA(反以链). (1)RNAi序列的设计: 确定靶基因的CDS, 进入广州锐博SiRNA在线设计软件(http://www.sirna.cn)设计RNAi序列, 根据上述软件得到多个软件认为可行的19 bp的序列, 要根据下列条件进行进一步筛选: GC含量36%-52%; sense链的第3碱基为A; sense链的第6碱基为A; sense链的第10碱基为U; sense链的第13碱基不是G; sense链的第18、19碱基不是G/C; 不含有反向重复序列; 不能形成环; sense链的5'端第1个碱基为G/C. 此外, sense链的15-19碱基中至少含有3个A/U. 上述条件中可以有2个以内不相符. 找出符合条件的序列后, 用T置换其中的U(本设计中是以U6为载体构建, 先构建重组DNA). 一般选择2条, 结合载体的结构特征, 形成需要合成的序列(ApaⅠ+Sense 19 nt+Loop(TTCAAGAGA)+Antisense 19 nt+TTTTT+EcoRⅠ)交由公司合成, 本研究构建了HIF-1α干扰序列见表1. (2)RNAi的构建及提取: 利用分子克隆的方法将目的序列退火连接入pSilencer 1.0-U6载体, 获得siRNA重组质粒U6-HIF-1α-shRNA, 转化感受态细胞获得重组菌, 挑选阳性克隆, 培养并制备质粒, 用EcoRⅠ和ApaⅠ双酶切鉴定. 酶切鉴定正确的克隆送公司测序证实. 重组菌大规模扩增后用去内毒素的质粒DNA制备试剂盒(NucleoBond Xtra MiDi EF)按说明书步骤提取质粒, -80 ℃保存.
| HIF-1α | A sequence |
| (+)5'-CCCTATATCCCAATGGATGA TTCAAGAGATCATCCATTGGGATATAGGTTTTTTG-3' | |
| (-)5'-AATTCAAAAAACCTATATCCCAATGGATGA TCTCTTGAATCATCCATTGGGATATAGGGGGCC-3' | |
| HIF-1α | B sequence |
| (+)5'-CGCAGACTCA AATACA AGAATTCAAGAGATTCTTGTATTTGAGTCTGCTTTTTTG-3' | |
| (-)5'-AATTCAAAAAAGCAGACTCA AATACA AGAATCTCTTGAATTCTTGTATTTGAGTCTGCGGGCC-3' |
1.2.2 RNA干扰质粒转染细胞: 采用脂质体试剂Lipofectamine 2000进行培养细胞转染(参考invitrogen的说明书), 质粒DNA(μg)与脂质体Lipofectamine 2000(μL)的比例为1:2.5. 转染细胞6 h后, 吸出无血清培养液, 换成含10%FBS的培养液过夜, 在特定的时间点收细胞进行Western blotting相应检测.
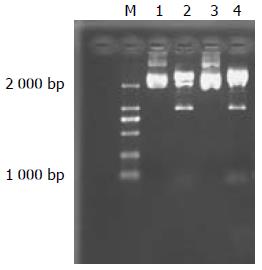
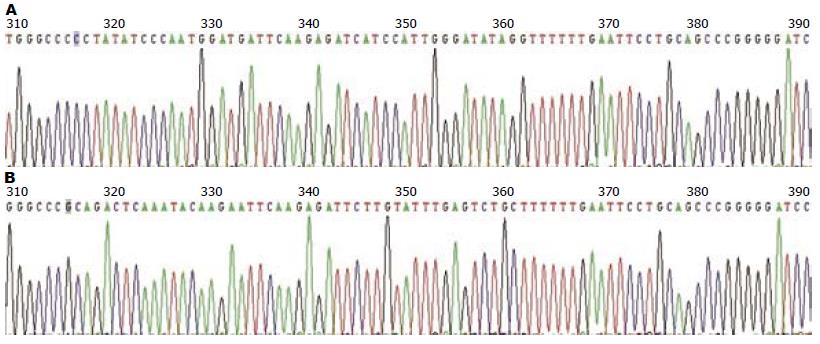
2个干扰序列各挑取1个阳性克隆进行扩增抽提质粒, 使用限制性内切酶EcoRⅠ/ApaⅠ双酶切过夜, 进行电泳, 酶切结果表明序列插入质粒(图1); DNA测序结果证实正确插入, 序列与预期序列完全一致(图2).
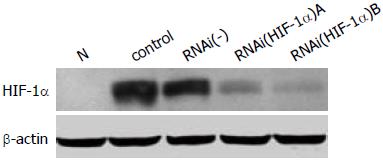
HIF-1α基因RNAi质粒转染人胃癌细胞SGC-7901, 低氧培养; 收集细胞裂解液, Western blotting分析对照组与转染组低氧下HIF-1α蛋白的表达水平, 结果显示与空质粒对照组比转染组细胞HIF-1α表达下调, 其中干扰质粒B效果更明显(图3).
由于目前胃癌治疗的局限性和预后的不乐观, 胃癌依然是我们临床所面临一个重要挑战. 实体瘤快速增长造成肿瘤组织缺氧的微环境, 与肿瘤的发展、远处转移、放化疗的耐受性以及不良预后关系密切[2]. 近年来, 针对肿瘤缺氧信号途径的治疗策略大受瞩目, 如抑制肿瘤血管新生的肿瘤治疗得到了极大的重视.
肿瘤细胞因生长失控使其增殖、代谢异常旺盛, 耗氧量随之大幅增加, 这些高度新陈代谢的肿瘤组织在得不到所需要的氧气时就造成了肿瘤组织低氧或缺氧的微环境. HIF-1在细胞缺氧信号途径中处于核心位置, 他能增强细胞在缺氧环境下的生存能力, 促进血管的增生及肿瘤的恶性转化.
近年来大量的研究表明, HIF-1α可以识别许多基因启动子内部的HRE, 从而控制基因的表达, 目前发现受转录因子HIF-1调控的基因多达60多种, 如EPO、VEGF等, 在肿瘤的生长、血管生成、转移等方面起着十分重要的作用[11-13]. 临床组织学研究发现, HIF-1α在很多人类癌症中过量表达, HIF-1α的高表达和患者预后之间存在一定的联系, 这一点在脑癌、乳腺癌、宫颈癌、卵巢癌、咽癌和子宫癌得到了证实[15]. HIF-1α调控并促进了VEGF的转录, 所以肿瘤组织中高表达的HIF-1α往往伴随VEGF的高表达. VEGF以自分泌的形式作用于VEGF的受体促进肿瘤细胞本身的生长, 或以旁分泌的形式作用于内皮细胞VEGF受体来刺激肿瘤血管新生, 为缺氧的肿瘤组织运输更多的氧气和营养物质, 从而促进肿瘤生长, 这是血管新生抑制因子在肿瘤生长的早期通过抑制肿瘤血管新生从而抑制肿瘤的生长的机制[16-19]. 研究表明HIF-1α、VEGF和胃癌血管新生具有相关性, 导致了VEGF介导的肿瘤血管新生, 与胃癌患者的预后密切相[19].
RNAi技术因其特异性和高效性, 近年来已成为研究基因功能的重要工具. RNAi技术是通过将19 nt-23 nt的siRNA导入细胞, 降解与其同源的mRNA, 特异、高效的阻断目的基因表达[14]. 质粒载体可在胞内持续产生siRNA抑制靶基因的表达, 适于长期实验研究. 本实验使用的为质粒载体pSilencer 1.0-U6, 该质粒以U6作为启动子, 其优点在于转录起始点、终止点明确. 此外, 该载体中含有氨苄耐药基因, 利于筛选阳性重组质粒和阳性克隆.
本研究将针对人HIF-1α设计构建的小干扰RNA转染入胃癌细胞株SGC-7901中, 通过Western blotting法检测siRNA的干扰效率, 结果显示低氧条件下目标细胞中HIF-1α的表达受到明显抑制(P<0.05), 表明所设计的siRNA起到了明显沉默目的基因表达的作用. 成功构建人HIF-1α基因RNAi质粒, 为研究HIF-1α参与的细胞信号通路研究提供了稳定的转染细胞干扰质粒. 阻断HIF-1α的信号通路将为肿瘤基因治疗提供一个较好的靶点, 研究结果为以HIF-1α为靶向的基因治疗提供了有利工具, 为进一步应用RNAi技术探明HIF-1α在肿瘤增殖转移中的作用打下基础.
由于目前胃癌治疗的局限性和预后的不乐观, 胃癌依然是我们临床所面临一个重要挑战. 实体瘤快速增长造成肿瘤组织缺氧的微环境, 与肿瘤的发展、远处转移、放化疗的耐受性以及不良预后关系密切. 近年来, 针对肿瘤缺氧信号途径的治疗策略大受瞩目, 如抑制肿瘤血管新生的肿瘤治疗得到了极大的重视.
邓昊, 副教授,江汉大学医学院病理学与病理生理学教研室
自从RNAi现象被发现以来, 作为自然界生物中广泛存在的一种保守的自我保护现象, RNAi已成为近几年来基因组学研究的热点内容之一, 研究领域也已拓展到基因治疗范围. RNAi技术不仅在基因治疗研究中应用日渐广泛, 也已成为重要的分子研究工具.
近年来大量的研究表明, HIF-1可以识别许多基因启动子内部的HRE, 从而控制基因的表达, 参与多条信号通路的调控, 目前发现受转录因子HIF-1调控的基因多达60多种, 如红细胞生成素(EPO)、血管内皮生长因子(VEGF)等, 在肿瘤的生长、血管生成、转移等方面起着十分重要的作用. RNA干扰(RNAi)是双链RNA介导的特异性基因沉默现象,是目前研究基因功能强有力的工具之一.
本研究选题尚可, 具有一定的参考价值..
编辑: 曹丽鸥 电编:闫晋利
| 1. | Thomlinson RH, Gray LH. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br J Cancer. 1955;9:539-549. [PubMed] [DOI] |
| 2. | Brown JM, Giaccia AJ. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer Res. 1998;58:1408-1416. [PubMed] |
| 3. | Wang GL, Semenza GL. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 1995;270:1230-1237. [PubMed] [DOI] |
| 4. | Ke Q, Costa M. Hypoxia-inducible factor-1 (HIF-1). Mol Pharmacol. 2006;70:1469-1480. [PubMed] [DOI] |
| 5. | Maxwell PH, Wiesener MS, Chang GW, Clifford SC, Vaux EC, Cockman ME, Wykoff CC, Pugh CW, Maher ER, Ratcliffe PJ. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature. 1999;399:271-275. [PubMed] [DOI] |
| 6. | Ivan M, Kaelin WG. The von Hippel-Lindau tumor suppressor protein. Curr Opin Genet Dev. 2001;11:27-34. [PubMed] [DOI] |
| 7. | Ivan M, Kondo K, Yang H, Kim W, Valiando J, Ohh M, Salic A, Asara JM, Lane WS, Kaelin WG. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing. Science. 2001;292:464-468. [PubMed] [DOI] |
| 8. | Epstein AC, Gleadle JM, McNeill LA, Hewitson KS, O'Rourke J, Mole DR, Mukherji M, Metzen E, Wilson MI, Dhanda A. C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation. Cell. 2001;107:43-54. [PubMed] [DOI] |
| 9. | Pagé EL, Robitaille GA, Pouysségur J, Richard DE. Induction of hypoxia-inducible factor-1alpha by transcriptional and translational mechanisms. J Biol Chem. 2002;277:48403-48409. [PubMed] [DOI] |
| 10. | Huang LE, Gu J, Schau M, Bunn HF. Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci U S A. 1998;95:7987-7992. [PubMed] [DOI] |
| 11. | Gordan JD, Simon MC. Hypoxia-inducible factors: central regulators of the tumor phenotype. Curr Opin Genet Dev. 2007;17:71-77. [PubMed] [DOI] |
| 12. | Rapisarda A, Uranchimeg B, Scudiero DA, Selby M, Sausville EA, Shoemaker RH, Melillo G. Identification of small molecule inhibitors of hypoxia-inducible factor 1 transcriptional activation pathway. Cancer Res. 2002;62:4316-4324. [PubMed] |
| 13. | Hewitson KS, Schofield CJ. The HIF pathway as a therapeutic target. Drug Discov Today. 2004;9:704-711. [PubMed] [DOI] |
| 15. | Semenza GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer. 2003;3:721-732. [PubMed] [DOI] |
| 16. | Folkman J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med. 1995;333:1757-1763. [PubMed] |
| 17. | Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;13:9-22. [PubMed] |
| 18. | Folkman J. What is the evidence that tumors are angiogenesis dependent? J Natl Cancer Inst. 1990;82:4-6. [PubMed] [DOI] |
| 19. | Stoeltzing O, McCarty MF, Wey JS, Fan F, Liu W, Belcheva A, Bucana CD, Semenza GL, Ellis LM. Role of hypoxia-inducible factor 1alpha in gastric cancer cell growth, angiogenesis, and vessel maturation. J Natl Cancer Inst. 2004;96:946-956. [PubMed] [DOI] |