修回日期: 2012-06-03
接受日期: 2012-08-07
在线出版日期: 2012-08-18
目的: 探讨原癌蛋白18(Oncoprotein 18, Op18)在肝癌侵袭转移过程中的作用机制.
方法: 采用RNA干扰, 抑制人肝癌细胞HCCLM3中Op18的表达, RT-PCR和Western blot评价干扰效率; 通过细胞粘附分析、体外Transwell分析法检测Op18表达缺失后对HCCLM3细胞粘附、运动和侵袭能力的改变; RT-PCR和免疫组织化学分别在48例未伴转移的肝癌组织和48例伴转移的肝癌组织中解析Op18表达与肝癌侵袭转移的关系.
结果: RT-PCR和Western blot结果显示: 在HCCLM3细胞中行RNAi后Op18表达被有效抑制, 抑制率达到80%以上; Op18表达缺失后, 在不同时间点(20、40和60 min)实验组细胞粘附能力(0.616±0.057、0.740±0.0713和1.001±0.083)较阴性对照组(0.944±0.068、1.196±0.115和1.441±0.053)明显下降(P<0.05); Transwell实验结果提示: 经RNAi后实验组细胞运动、侵袭能力(运动: 0.145±0.011, 侵袭0.127±0.008)较阴性对照组(运动: 0.206±0.008, 侵袭: 0.168±0.012)显著降低(P<0.01); 分别在伴转移和未伴转移的肝癌组织中检测Op18的表达, RT-PCR(Op18与GAPDH相对比值: 0.560±0.128 vs 0.414±0.086)和IHC(积分吸光度值为: 624.771±100.032 vs 413.786±71.833)实验结果均提示Op18在伴转移的肝癌组织中的表达更高(P<0.01).
结论: Op18在肝癌的侵袭转移过程中发挥重要作用.
引文著录: 甘淋, 段承刚, 龚舒, 郭坤, 舒宏, 刘银坤. Oncoprotein 18在肝癌侵袭转移过程中的作用. 世界华人消化杂志 2012; 20(23): 2151-2156
Revised: June 3, 2012
Accepted: August 7, 2012
Published online: August 18, 2012
AIM: To explore the role of Oncoprotein 18 (Op18) in metastasis of hepatocellular carcinoma (HCC).
METHODS: Op18 expression was repressed in HCCLM3 cells by RNA interference, and interference effect was evaluated by RT-PCR and Western blot. Cell adhesion, migration and invasion were analyzed by cell adhesion assay and Transwell assay in vitro. Op18 expression was detected by RT-PCR and immunohistochemistry in 96 HCC specimens with or without metastasis.
RESULTS: Op18 expression was effectively inhibited by RNA interference in HCCLM3 cells. Cell adhesion was significantly suppressed in the RNAi group compared to the mock group (20 min: 0.616 ± 0.057 vs 0.944 ± 0.068; 40 min: 0.740 ± 0.0713 vs 1.196 ± 0.115; 60 min: 1.001 ± 0.083 vs 1.441 ± 0.053; all P < 0.05). Transwell assay revealed that cell migration and invasion decreased in the RNAi group compared to the mock group (migration: 0.145 ± 0.011 vs 0.206 ± 0.008; invasion: 0.127 ± 0.008 vs 0.168 ± 0.012; both P < 0.01). Op18 expression was detected in 96 HCC tissues with or without metastasis. RT-PCR demonstrated that Op18 was overexpressed in HCC tissues with metastasis (n = 48) compared with HCC tissues without metastasis (n = 48, Op18/GAPDH relative ratio: 0.560 ± 0.128 vs 0.414 ± 0.086); and IHC results also indicated that Op18 expression was up-regulated in HCC tissues with metastasis in comparison with HCC tissues without metastasis (integrated density: 624.771 ± 100.032 vs 413.786 ± 71.833, P < 0.01).
CONCLUSION: Overexpression of Op18 may play an important role in HCC metastasis.
- Citation: Gan L, Duan CG, Gong S, Guo K, Shu H, Liu YK. Role of Oncoprotein 18 in metastasis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2151-2156
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2151
肝细胞癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤, 死亡率在我国恶性肿瘤中居第2位, 其高转移高复发是导致死亡率居高不下的主要原因[1-4]. 原癌蛋白18(Oncoprotein 18, Op18), 也称Op17、Op19、stathmin等, 是一种重要的微管解离蛋白, 参与微管二聚体的形成[5-7]. 本研究采用RNA干扰技术, 在HCCLM3细胞中抑制Op18的表达后, 观察Op18表达缺失对HCCLM3细胞粘附、侵袭和运动能力的影响; 并进一步在伴转移和未伴转移的肝癌组织中探讨Op18表达与肝癌侵袭转移的关系, 解析Op18在肝癌侵袭转移过程中发挥的作用.
人HCCLM3肝癌细胞由复旦大学肝癌研究所建系; 所有HCC组织标本(广西医科大学附属第一人民医院, 2004-01/2004-12)均经术后病理检查证实, 其中伴转移肝癌(由病理和临床检查证实患者在肝外存在源于肝癌细胞的转移病灶)和未伴转移的肝癌组织各48例; TRIzol和lipofectamineTM 2000均购自美国Invotrogene公司; 逆转录试剂盒购自Promega公司; 半定量PCR试剂盒购自莱枫生化; 增强化学发光试剂盒购自美国Pierce公司; Op18单抗购自ABcam公司; GAPDH抗体购自上海KANGCHEN; Transwell孔板购自美国Costa公司.
1.2.1 小干扰(small interference, si)RNA序列的设计和合成: 人Op18基因的siRNA由上海吉凯公司设计合成. Op18 siRNA正义链: 5'-GAA ACG AGA GCA CGA GAA Att-3', 反义链: 5'-UUU CUC GUG CUC UCG UUU Ctt-3'; 阴性对照双链小RNA正义链: 5'- UUC UCC GAA CGU GUC ACG Utt-3', 反义链: 5'-ACG UGA CAC GUU CGG AGA Att-3'.
1.2.2 细胞培养、转染和干扰效率的鉴定: 方法如前所示, 详见文献[8], 即人肝癌细胞HCCLM3在含100 mL/L胎牛血清的DMEM培养液中, 置37 ℃、50 mL/L CO2的细胞培养箱内培养; 消化计数后按3×105个/孔接种于6孔板; 至细胞融合率达60%左右, 按lipofectamineTM 2000试剂说明书进行转染, 以80 nmol/L Op18 siRNA转染HCCLM3细胞48 h, 收集细胞检测RNA和蛋白质表达, 鉴定Op18干扰效率. 设转染Op18 siRNA的为实验组, 设转染非编码序列双链小RNA为阴性对照组, 设不作转染的为空白对照组.
1.2.3 细胞粘附实验: 用FN(20 μg/mL)包埋96孔板, 置37 ℃、50 mL/L CO2孵箱中放置1 h. 分别将RNA干扰实验组、空白对照组和阴性对照组细胞(每组各设3个复孔)消化计数, 按2×104细胞/孔加入孔板, 37 ℃分别培养20、40、60 min后40g/L多聚甲醛固定10 min; 龙胆紫染色15 min; 加入龙胆紫溶解液37 ℃温育30 min, 用酶标仪检测其A540.
1.2.4 体外Transwell分析: 侵袭实验先在Transwell侵袭上室中用1 mg/mL Matrigel基质铺板, 置37 ℃、50 mL/L CO2孵箱中培养6 h. 将Op18 RNA干扰的实验组、空白对照组和阴性对照组细胞(每组各设3个复孔)按1×105细胞/孔加入上室. 同时在Transwell孔板的下室中加入600 μL含20% FBS的培养基. 培养30 h弃去上室细胞培养液, 拭净上室细胞. 4%多聚甲醛固定, 结晶紫染色15 min, 33%醋酸脱去染液, 用酶标仪测定A570. 运动实验除Transwell侵袭上室不用Matrigel基质包被外, 其余步骤同侵袭实验.
1.2.5 RT-PCR: TRIzol试剂提取肝癌组织的RNA, 测定RNA浓度行逆转录. PCR扩增Op18基因和内参. 引物序列如下, Op18基因: 正义链5'-ATGAGGCAAACCCTGTGAAC-3', 反义链5'-AGCTTGGCACAGATCCTTGT-3'(158 bp); GAPDH正义链为5'-ATGACCCCTTCATTGACC-3', 反义链为5'-GAAGATGGTGATGG GATTTC-3'(131 bp). PCR反应条件: 94 ℃ 5 min, 94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 30 s, 共30个循环. 2%琼脂糖电泳分离, 观察结果.
1.2.6 免疫组织化学: 将HCC石蜡切片烤片脱蜡, 微波抗原修复10 min, 5%山羊血清封闭1 h, 加入Op18抗体(1:200)4 ℃过夜, 二抗室温孵育30 min. DAB显色, 苏木精复染、脱水、封片. 并用ImagePro Plus 6.0(IPP)软件分析结果.
统计学处理 所有统计分析应用SPSS13.0软件进行. 数据用mean±SD表示, 均数两两比较应用配对t检验, 多样本均数比较采用单因素方差分析. P<0.05视差异有统计学意义.
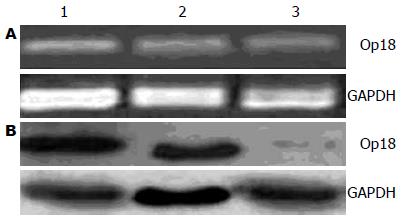
选择高表达Op18的人肝癌细胞株HCCLM3中行Op18的siRNA干扰. 转染siRNA 48 h后分别提取空白对照组、阴性对照组和RNAi实验组细胞的总RNA和蛋白质, 用RT-PCR和Western blot检测Op18的表达. RT-PCR结果显示在空白对照组、阴性对照组和实验组细胞中Op18与GAPDH的相对表达量分别为0.568±0.045、0.579±0.038、0.199±0.022, 与PCR结果相似, WB结果显示在空白对照组、阴性对照组和实验组细胞中Op18与GAPDH蛋白相对表达量为0.841±0.048、0.887±0.078、0.154±0.016. 以上结果提示: 无论是RNA水平还是蛋白质水平, RNAi都能明显抑制HCCLM3实验组细胞中Op18表达(P<0.01), 干扰率达到80%以上; 而空白对照组和阴性对照组之间没有统计学差异(图1).
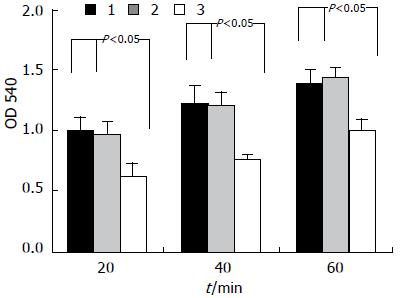
在HCCLM3细胞中行RNA干扰后, 收集空白对照组、阴性对照组和实验组细胞, 计数后铺入96孔板中, 分别在不同时间点(20、40和60 min)检测细胞粘附能力. 实验发现: 与3个时间点阴性对照组细胞粘附(0.944±0.068、1.196±0.115、1.441±0.053)相比较, 实验组细胞粘附能力(0.616±0.057、0.740±0.0713、1.001±0.083)降低(P<0.05); 而空白对照组和阴性对照组之间没有明显统计学差异(图2).
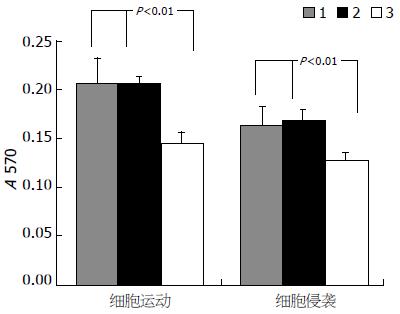
在HCCLM3细胞中行RNA干扰后, 采用Transwell实验检测RNAi对HCCLM3细胞侵袭、运动的影响. 运动实验的结果发现与空白对照组和阴性对照组(0.208±0.01、0.206±0.008)相比较, RNAi实验组细胞的运动能力明显降低(0.145±0.011, P<0.01), 而空白对照与阴性对照之间没有差异. 侵袭实验结果与运动实验一致, 和空白组与阴性对照组相比较(0.163±0.019、0.168±0.012), RNAi后实验组细胞的侵袭能力(0.127±0.008)也被显著抑制(P<0.01, 图3).
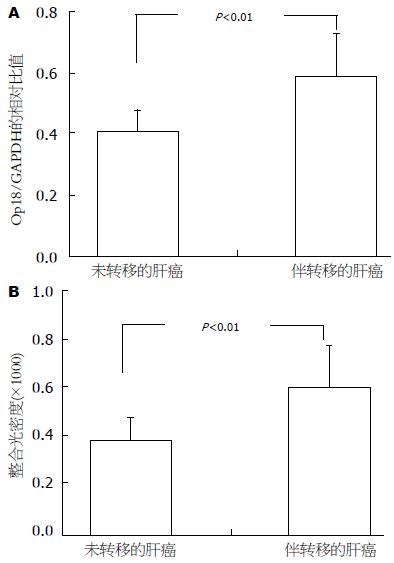
采用RT-PCR分别检测10例未伴转移肝癌和10例伴转移肝癌组织中Op18的表达, 发现伴转移的肝癌组织中Op18表达更高(Op18/GAPDH: 0.560±0.128 vs 0.414±0.086), 二者具有统计学意义(P<0.01, 图4A). 另采用免疫组织化学的方法在肝癌组织(未伴转移肝癌和伴转移肝癌各48例)的石蜡切片中检测Op18的表达, 以细胞胞浆中出现棕褐色的颗粒为阳性. IPP软件系统分析免疫组化结果, 计算阳性区域的积分光密度. 发现伴转移的肝癌组织中Op18表达更高(积分光密度为624.771±100.032 vs 413.786±71.833). 用SPSS13.0分析发现: Op18在未伴转移和伴转移的肝癌组织中表达具有显著的差异(P<0.01, 图4B).
肝癌是我国最常见的高致死率的恶性肿瘤, 目前尚缺乏敏感高效的HCC转移复发的分子标志物, 其发病机制仍不清楚[9]. 提示探讨HCC侵袭转移的分子机制, 对降低肝癌患者的转移率和复发率, 提高患者的生存率和预后具有重要临床和现实意义.
Op18是重要的微管解离蛋白, 主要通过结合微管蛋白二聚体, 参与微管稳态平衡的维持、纺锤体和极体的形成分离、细胞分裂运动等多种细胞生物过程, 并作为信号传导因子在信号通路中发挥重要作用[10-13]. 研究发现在乳腺癌、前列腺癌、肉瘤、白血病等多种肿瘤中Op18蛋白高表达, 提示Op18的表达可能参与了肿瘤的发生, 可作为肿瘤辅助诊断、治疗分子标志物和药物靶点[14-18]. 而本小组前期实验也发现在HCC组织中Op18高表达, 提示Op18与肝癌的发生相关, 这和Kung小组的实验结果一致[19,20]. 但是Op18是否参与肝癌的侵袭转移过程, 目前尚不清楚, 有待进一步研究.
我们在高表达Op18的人肝癌细胞HCCLM3中, 通过RNA干扰的方法, 使Op18的表达缺失后发现: Op18的表达抑制可明显抑制HCCLM3的粘附、运动和侵袭能力. 在2002年Ozon小组第一次报道在果蝇中如果降低Op18的表达能抑制精子的运动, 另有多个研究都发现在直肠癌、子宫内膜癌等多种属多类型细胞中stathmin的表达可以增加细胞的运动, 改变细胞的形态, 参与肿瘤的侵袭运动等[21-24]. 这些研究都支持我们的实验结果, 即Op18的表达缺失的确可以抑制肿瘤细胞的侵袭、运动. 我们在细胞实验的基础上, 进一步在肝癌组织检测Op18的表达, 验证我们假设, 即Op18在肝癌的侵袭转移过程中发挥重要作用. 选择未转移的肝癌组织和伴转移的肝癌组织各48例, 用PCR和IHC的方法检测Op18的表达. 实验显示无论是mRNA水平还是蛋白质水平, Op18在伴转移的肝癌组织中表达显著增高, 提示Op18的表达可能预示肝癌的侵袭转移. Kasper小组在前列腺肿瘤组织中研究Op18表达时发现: 较未转移的前列腺肿瘤组织, Op18在转移、复发的肿瘤中表达更高, 且Op18的表达上调与肿瘤体积大小、病理分级、血管侵犯、肝内播散和5年生存率密切相关, 暗示Op18可能与肿瘤的发展过程有关; Mikihiro小组报道Op18的高表达与滋层细胞的转移侵袭相关; 同时在乳腺癌、内分泌肿瘤和卵巢癌等组织中实验也发现了相似的结果[17,25-29]. 这些研究都与我们的实验结果相吻合, 即Op18的高表达可能与肿瘤的发展过程相关, 能预示肿瘤的侵袭、转移, 成为肝癌转移的一个潜在诊断标志物.
Baldassarre小组进一步探讨了Op18参与肿瘤运动侵袭的分子机制, 研究发现Op18能与胞浆中的p27skip(一个细胞素依赖性蛋白激酶)相结合后, 失去解离微管的能力, 从而抑制肉瘤细胞HT-1080的侵袭运动能力. 还有研究发现鸟苷磷酸酶PhoA、Stat3也能结合Op18, 直接或者间接调节微管的动态变化, 最终通过对微管动态平衡的调节发挥对细胞的运动能力的重要作
用[30,31]. 这些都可能提示了Op18参与肿瘤侵袭转移的分子机制.
总之, 本研究从细胞和组织标本中都发现Op18表达上调参与肝癌的侵袭转移过程, 在肝癌发展过程中发挥重要作用. 但是, Op18是否能作为一个新的诊断肝癌侵袭转移、预测肝癌预后转归的分子标志物, 或者成为一个肝癌药物治疗的分子靶点还有待进一步研究.
肝细胞癌(HCC)是一种常见的恶性肿瘤, 死亡率在我国恶性肿瘤中居第2位, 其高转移高复发是导致死亡率居高不下的主要原因, 目前尚缺乏一种高效敏感的HCC转移复发的诊断标志物.
代智, 副研究员, 复旦大学附属中山医院肝癌研究所; 田字彬, 教授, 青岛大学医学院附属医院
最近研究发现在乳腺癌、前列腺癌、肉瘤、肝癌、白血病等多种肿瘤中原癌蛋白(Op18)的表达参与了肿瘤的发生, 可作为肿瘤辅助诊断、治疗分子标志物和药物靶点.
有多个研究小组发现, 在直肠癌、子宫内膜癌、乳腺癌等多种属多类型的肿瘤细胞中Op18的蛋白表达可以促进肿瘤细胞的运动, 改变细胞的形态, 并参与肿瘤的侵袭运动.
该研究进一步研究Op18蛋白表达与肝癌侵袭转移的关系,为探讨HCC侵袭转移的分子机制, 筛选肝癌转移的诊断标志物提供了实验基础.
侵袭转移是肝癌恶性程度的具体表现, Op18基因表达沉默可抑制肝癌细胞的粘附、运动和侵袭; 肝癌组织中Op18蛋白表达水平与肝癌的转移呈正相关, 提示Op18的表达可能预示肝癌的侵袭转移.
本论文从细胞水平研究显示Op18表达能促进肝癌细胞的侵袭运动, 在肝癌发展中发挥作用, 实验设计比较完善, 有一定创新性.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Carmi L, Georgiades C. Combination percutaneous and intraarterial therapy for the treatment of hepatocellular carcinoma: a review. Semin Intervent Radiol. 2010;27:296-301. [PubMed] [DOI] |
| 2. | Gu Z, Zhang C, Wang J. Gene regulation is governed by a core network in hepatocellular carcinoma. BMC Syst Biol. 2012;6:32. [PubMed] [DOI] |
| 3. | Tazi el M, Essadi I, M'rabti H, Touyar A, Errihani PH. Systemic treatment and targeted therapy in patients with advanced hepatocellular carcinoma. N Am J Med Sci. 2011;3:167-175. [PubMed] |
| 4. | Bethge A, Schumacher U, Wree A, Wedemann G. Are metastases from metastases clinical relevant? Computer modelling of cancer spread in a case of hepatocellular carcinoma. PLoS One. 2012;7:e35689. [PubMed] [DOI] |
| 5. | Holmfeldt P, Sellin ME, Gullberg M. Upregulated Op18/stathmin activity causes chromosomal instability through a mechanism that evades the spindle assembly checkpoint. Exp Cell Res. 2010;316:2017-2026. [PubMed] [DOI] |
| 6. | Hu JY, Chu ZG, Han J, Dang YM, Yan H, Zhang Q, Liang GP, Huang YS. The p38/MAPK pathway regulates microtubule polymerization through phosphorylation of MAP4 and Op18 in hypoxic cells. Cell Mol Life Sci. 2010;67:321-333. [PubMed] [DOI] |
| 7. | Houghtaling BR, Yang G, Matov A, Danuser G, Kapoor TM. Op18 reveals the contribution of nonkinetochore microtubules to the dynamic organization of the vertebrate meiotic spindle. Proc Natl Acad Sci U S A. 2009;106:15338-15343. [PubMed] [DOI] |
| 8. | Gan L, Li J, Guo K, Li Y, Shu H, Wang L, Song J, Liu YK. [The effects of stathmin on cell proliferation and tumor-related genes expressions in HCCLM3 cells]. Zhonghua Ganzangbing Zazhi. 2011;19:571-576. [PubMed] |
| 9. | Alves RC, Alves D, Guz B, Matos C, Viana M, Harriz M, Terrabuio D, Kondo M, Gampel O, Polletti P. Advanced hepatocellular carcinoma. Review of targeted molecular drugs. Ann Hepatol. 2011;10:21-27. [PubMed] |
| 10. | Manna T, Thrower DA, Honnappa S, Steinmetz MO, Wilson L. Regulation of microtubule dynamic instability in vitro by differentially phosphorylated stathmin. J Biol Chem. 2009;284:15640-15649. [PubMed] [DOI] |
| 11. | Ringhoff DN, Cassimeris L. Stathmin regulates centrosomal nucleation of microtubules and tubulin dimer/polymer partitioning. Mol Biol Cell. 2009;20:3451-3458. [PubMed] [DOI] |
| 12. | Dong B, Mu L, Qin X, Qiao W, Liu X, Yang L, Xue L, Rainov NG, Liu X. Stathmin expression in glioma-derived microvascular endothelial cells: a novel therapeutic target. Oncol Rep. 2012;27:714-718. [PubMed] |
| 13. | Lin X, Tang M, Tao Y, Li L, Liu S, Guo L, Li Z, Ma X, Xu J, Cao Y. Epstein-Barr virus-encoded LMP1 triggers regulation of the ERK-mediated Op18/stathmin signaling pathway in association with cell cycle. Cancer Sci. 2012;103:993-999. [PubMed] [DOI] |
| 14. | Shi X, Wang D, Ding K, Lu Z, Jin Y, Zhang J, Pan J. GDP366, a novel small molecule dual inhibitor of survivin and Op18, induces cell growth inhibition, cellular senescence and mitotic catastrophe in human cancer cells. Cancer Biol Ther. 2010;9:640-650. [PubMed] [DOI] |
| 15. | Sabherwal Y, Mahajan N, Helseth DL, Gassmann M, Shi H, Zhang M. PDEF downregulates stathmin expression in prostate cancer. Int J Oncol. 2012;40:1889-1899. [PubMed] |
| 16. | Belletti B, Baldassarre G. Stathmin: a protein with many tasks. New biomarker and potential target in cancer. Expert Opin Ther Targets. 2011;15:1249-1266. [PubMed] [DOI] |
| 17. | Morimura S, Takahashi K. Rac1 and Stathmin but Not EB1 Are Required for Invasion of Breast Cancer Cells in Response to IGF-I. Int J Cell Biol. 2011;2011:615912. [PubMed] |
| 18. | Wang F, Wang LX, He W, Li K, Wang RL, Zhao PR, Fan QX. [Up-regulation of stathmin induces growth arrest of esophageal squamous cell carcinoma EC9706 cell]. Zhonghua Yixue Zazhi. 2010;90:2140-2144. [PubMed] |
| 19. | Gan L, Guo K, Li Y, Kang X, Sun L, Shu H, Liu Y. Up-regulated expression of stathmin may be associated with hepatocarcinogenesis. Oncol Rep. 2010;23:1037-1043. [PubMed] |
| 20. | Wang X, Chen Y, Han QB, Chan CY, Wang H, Liu Z, Cheng CH, Yew DT, Lin MC, He ML. Proteomic identification of molecular targets of gambogic acid: role of stathmin in hepatocellular carcinoma. Proteomics. 2009;9:242-253. [PubMed] [DOI] |
| 21. | Tan HT, Wu W, Ng YZ, Zhang X, Yan B, Ong CW, Tan S, Salto-Tellez M, Hooi SC, Chung MC. Proteomic analysis of colorectal cancer metastasis: stathmin-1 revealed as a player in cancer cell migration and prognostic marker. J Proteome Res. 2012;11:1433-1445. [PubMed] [DOI] |
| 22. | Li N, Jiang P, Du W, Wu Z, Li C, Qiao M, Yang X, Wu M. Siva1 suppresses epithelial-mesenchymal transition and metastasis of tumor cells by inhibiting stathmin and stabilizing microtubules. Proc Natl Acad Sci U S A. 2011;108:12851-12856. [PubMed] [DOI] |
| 23. | Trovik J, Wik E, Stefansson IM, Marcickiewicz J, Tingulstad S, Staff AC, Njolstad TS, Vandenput I, Amant F, Akslen LA. Stathmin overexpression identifies high-risk patients and lymph node metastasis in endometrial cancer. Clin Cancer Res. 2011;17:3368-3377. [PubMed] [DOI] |
| 24. | Zheng P, Liu YX, Chen L, Liu XH, Xiao ZQ, Zhao L, Li GQ, Zhou J, Ding YQ, Li JM. Stathmin, a new target of PRL-3 identified by proteomic methods, plays a key role in progression and metastasis of colorectal cancer. J Proteome Res. 2010;9:4897-4905. [PubMed] [DOI] |
| 25. | Su D, Smith SM, Preti M, Schwartz P, Rutherford TJ, Menato G, Danese S, Ma S, Yu H, Katsaros D. Stathmin and tubulin expression and survival of ovarian cancer patients receiving platinum treatment with and without paclitaxel. Cancer. 2009;115:2453-2463. [PubMed] [DOI] |
| 26. | Björklund P, Cupisti K, Fryknäs M, Isaksson A, Willenberg HS, Akerström G, Hellman P, Westin G. Stathmin as a marker for malignancy in pheochromocytomas. Exp Clin Endocrinol Diabetes. 2010;118:27-30. [PubMed] [DOI] |
| 27. | Xi W, Rui W, Fang L, Ke D, Ping G, Hui-Zhong Z. Expression of stathmin/op18 as a significant prognostic factor for cervical carcinoma patients. J Cancer Res Clin Oncol. 2009;135:837-846. [PubMed] [DOI] |
| 28. | Zhang CY, Xiao ZA, Zeng YC, Yang XM, Xie DH, Xia K, Liu FY, Huang BY. [Expression of stathmin mRNA and protein in laryngeal squamous cell carcinoma and its clinical implication]. Zhonghua Er biyanhoutoujing Waike Zazhi. 2008;43:291-295. [PubMed] |
| 29. | Wang F, Wang LX, He W, Zhu LN, Zhao PR, Fan QX. [Expression of stathmin in esophageal squamous cell carcinoma and its biological significance]. Nanfang Yike Daxue Xuebao. 2010;30:1552-1557. [PubMed] |
| 30. | Verma NK, Dourlat J, Davies AM, Long A, Liu WQ, Garbay C, Kelleher D, Volkov Y. STAT3-stathmin interactions control microtubule dynamics in migrating T-cells. J Biol Chem. 2009;284:12349-12362. [PubMed] [DOI] |