修回日期: 2012-06-29
接受日期: 2012-07-20
在线出版日期: 2012-08-18
目的: 研究1个肝脏劈离成3个供肝单位的动物实验可行性.
方法: 普通级健康犬分成供体组(n = 30, 体质量20-25 kg)和受体组(n = 30, 体质量8-15 kg), 供受体随机配对. 供体手术断离右外叶和右中叶、左中叶和方叶之间的2处肝组织桥, 原位灌注后将左侧区、中央区和右侧区供肝各自的一级肝蒂在近主干处切断, 移植物受体体质量比(graft-to-recipient weight ratio, GRWR)>1.0%且最接近1.5%的供肝入选为移植物, 植入左侧区、中央区和右侧区供肝的受体分别分入A组、B组和C组. 供肝背驮式植入受体, 流出口和腔静脉壁端侧吻合, 供肝一级肝蒂分别和受体门管三联的主干端端吻合. 术后观察受体腹腔及胆汁引流, 死亡后进行尸检, 移植物取标本进行病理检查.
结果: 犬肝外观呈分叶状, 深陷的叶间裂将各叶分隔开来, 各叶间由较少的肝组织桥相连接, 右外叶和右中叶间的肝桥组织较左中叶和方叶间的肝桥组织更薄更少, 2处肝桥离断时均未发现有大的血管及胆管. 门静脉主要分成左支、中支和右支; 胆总管也由左、中及右肝管三支肝管汇合而成; 肝动脉可存在变异; 肝血液经由肝左、中、右3支静脉回流. 3组供体的平均体质量、手术时间及失血量差异的比较无统计学意义. 体内劈离技术全部得以完成, 供肝无热缺血损伤. 3组受体体质量、供肝质量和GRWR之间的差异均存在显著的统计学意义(P<0.01), 但手术时间、无肝期、失血量及输血量间的差异无统计学意义(P>0.05). 3组受体中无术中死亡者, 30个供肝均成功植入, 所有血管及胆道的吻合均不需要移植物间置, 门静脉和动脉重建后均能排泌胆汁, 各组新肝均无淤血、缺血区. 3组受体存活时间分别为128.3 h±48.5 h、102.7 h±59.8 h和98.7 h±36.8 h, 各组之间的差异无统计学意义(P = 0.234). 死亡后尸检均未发现有吻合口出血、血栓等外科技术性并发症者, 移植物标本病理检查肝细胞无淤血肿胀和缺血坏死者.
结论: 此项动物实验证明: 一个大受体的肝脏能劈离成3个部分, 且每一部分都能作为独立完整的供肝移植给不同体质量的小受体.
引文著录: 周峻, 王政, 李龙, 陈芳林, 崔龙, 谢华伟, 侯文英, 张金山, 刘树立, 明安晓, 李胜利, 王海斌. "一肝三受"动物实验的可行性. 世界华人消化杂志 2012; 20(23): 2138-2145
Revised: June 29, 2012
Accepted: July 20, 2012
Published online: August 18, 2012
AIM: To explore the feasibility of a strategy of tripartition of a whole deceased liver graft for use in 3 recipients in dogs to ultimately maximize donor organ use.
METHODS: Adult healthy mongrel dogs were selected to be donors (n = 30, weighing between 20-25 kg) and recipients (n = 30, weighing between 8-15 kg). Donor/recipient pairs were randomly matched. For donor operation, transection of the parenchymal bridge was performed between the right lateral lobe and right middle lobe, and between the left middle lobe and the quadrate lobe. After in vivo perfusion, the left, middle and right liver grafts were procured, and their primary branches were cut near the main stem. Among the three liver grafts, the one was chosen to be implanted if it's GRWR (graft-to-recipient weight ratio) was more than 1.0% and was nearest to 1.5%. Recipients entered Groups A, B and C if the left, middle and right grafts were chosen, respectively. With the piggyback technique, the outflow orifice of liver graft was anastomosed to the anterolateral wall of the recipient vena cava. The graft was revascularized via reconstructed hepatic vein and portal vein, and then the hepatic artery and bile duct were anastomosed both in an end-to-end manner. Biliary and abdominal drainage was inspected postoperatively. Autopsies were performed promptly after recipients' death to investigate the possibility of technical complications.
RESULTS: By prominent fissures, the canine liver was divided into 7 lobes, among which the parenchymal bridges were thin. The parenchymal bridge connecting the right lateral lobe to the right middle lobe was much thinner than that connecting the left middle lobe to the quadrate lobe. No major conduit was found during transection of these two parenchymal bridges. The portal vein was split into three branches. The common bile duct was formed by the union of three hepatic ducts-the left, middle and right hepatic ducts. The hepatic vein consisted of the left, median and right hepatic veins. Anatomical variations in the hepatic arteries could be found. Among three recipient groups, the operation time, anhepatic time and blood loss did not show significant differences (P > 0.05), but the mean recipient weight, liver graft weight, and GRWR differed significantly (all P < 0.01). In the three groups, none of the recipients died during surgery. Once the hepatic vein and the portal vein were anastomosed and declamped, the implanted liver regained its color soon and its appearance returned to normal following arterial revascularization. There was no statistical difference in survival duration among the three groups (128.3 h ± 48.5 h vs 102.7 h ± 59.8 h vs 98.7 h ± 46.8 h, P = 0.234). Ascites and liver necrosis were not found at autopsy. Bile was present in the bile duct and all anastomoses were patent.
CONCLUSION: Our experimental results indicate that the whole liver of a big dog can be split into three parts, every one of which can be transplanted to a small recipient as an independent allograft.
- Citation: Zhou J, Wang Z, Li L, Chen FL, Cui L, Xie HW, Hou WY, Zhang JS, Liu SL, Ming AX, Li SL, Wang HB. An experimental study of triple split-liver transplantation in dogs. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2138-2145
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2138.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2138
肝脏移植目前仍然是治疗终末期肝病的最有效手段, 但供肝匮乏的现状严重阻碍了肝脏移植的临床应用, 劈离式供肝的出现革命性地增加了供肝的绝对数量. 为了将劈离式肝移植(split liver transplantation, SLT)技术向前推进一步, 此项研究尝试将一个肝脏劈离成3个供肝单位, 用犬制作动物模型来探索这一新技术的可行性.
实验于2010-09/2011-01完成, 动物全部购自中国人民解放军总医院动物实验中心, 经过体检、血常规和肝功能筛查后, 选用普通级健康犬(外科手术用杂交犬), 犬龄1-4岁, 雌雄不限, 供体组30只(体质量20-25 kg), 受体组30只(体质量8-15 kg), 供血组另设. 供、受体随机配对, 动物实验方法符合动物伦理学要求.
1.2.1 实验设计及手术方法: 每次实验对一对配对的供受体进行手术, 将其安排在相邻的2个手术间内, 由供体手术组和受体手术组人员同时开始手术, 修肝台安置于供体手术间内. 供受体犬术前均禁食24 h、禁水12 h, 用25 mg/kg硫喷妥钠静脉注射诱导麻醉后, 取平卧位, 身下置加热垫, 固定头部和四肢, 气管内插管, 麻醉机维持呼吸, 吸入异氟醚维持麻醉. 颈外静脉插管输液/输血并监测中心静脉压, 受体犬取颈外静脉一段备门腔分流用. 术中连续监测心率、氧饱和度、动脉血压、心电及肛温. 设协调员1名, 负责手术中的记录、计算及两组间进度的协调等. 在供肝完全劈离之前, 2组手术人员及协调员对供受体犬的体质量均不知情, 2组手术人员对对方的术中情况也互不知情.
1.2.2 供体手术: 取上腹部屋顶状切口进腹, 先仔细解剖肝蒂, 分离出门静脉及肝固有动脉的主要分支, 并辨认各肝胆管之间的解剖关系, 胆总管远端结扎并切断. 然后游离第二肝门, 再翻转肝脏结扎、切断所有的肝短静脉, 将肝脏从后腔静脉(相当人类的下腔静脉, 下同)上完全游离, 只保留直径>4 mm的粗大副肝静脉. 结扎起自门静脉左支供应舌状叶乳突的小分支, 切除舌状叶. 用电刀先后断离右外叶和右中叶、左中叶和方叶之间的2处肝组织桥, 断面妥善止血. 于是, 除了肝蒂相连外, 整个供体肝已经被分割为左侧区、中央区和右侧区3个部分, 每区均包含2个肝叶. 肝总动脉和门静脉主干分别插管以4 ℃的上海多器官保存液(SMO液)重力灌注, 整体取出供体肝. 最后于腹主动脉穿刺采血供受体输血用, 麻醉下放血处死.
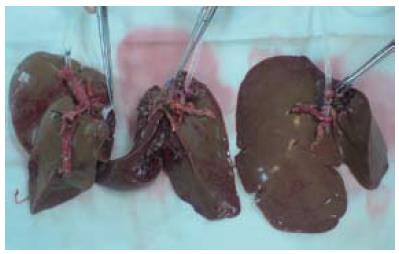
1.2.3 修肝台: 供体手术组取出供体肝后转入修肝台组, 将供肝迅速置入混合冰屑的SMO液中, 冲洗胆道. 一般将左侧区、中央区和右侧区供肝各自的一级肝蒂分别在接近主干处切断, 得到3份独立的供肝(图1), 如遇到有2支动脉供应同一区的情况, 则将肝固有动脉保留于此区. 修剪静脉出口, 3部分分别称取质量, 此时由协调员分别计算三区供肝和受体的移植物受体体质量比(graft-to-recipient weight ratio, GRWR), GRWR>1.0%且最接近1.5%的供肝入选为移植物. 受体如果植入左侧区供肝则分入A组, 植入中央区供肝的分入B组, 植入右侧区供肝的分入C组.
1.2.4 受体手术: 解剖第一、二肝门后, 将备用的颈外静脉在门腔静脉间架桥, 建立临时性门腔分流[1]. 肝脏自后腔静脉上充分分离后整体切除(术后进行解剖), 尽量保留门静脉主干、肝固有动脉和胆总管的长度以利于吻合. 如果预备植入的是左侧区或中央区供肝, 则缝闭肝右静脉根部, 在肝左、中静脉共干的根部以下部分阻断后腔静脉, 根据供肝流出道口径大小修剪侧壁[1]; 如果准备植入右侧区供肝, 则缝闭肝左、中静脉共干, 在肝右静脉根部进行相应修整. 供肝背驮式植入, 流出口和腔静脉壁行端侧吻合, 直径>4 mm的粗大副肝静脉予以重建. 供肝门静脉支和受体门静脉主干行端端吻合后恢复新肝血流, 结扎关闭临时门腔分流, 计算自门静脉开放血流至新肝排泌胆汁的时间. 在10×手术显微镜下, 供肝的肝动脉支和受体的肝固有动脉端端吻合, 供肝的一级肝管和受体胆总管端端吻合. 腹腔引流管置于肝断面附近, 胆囊造瘘置管观察胆汁分泌情况, 彩色多普勒超声仪(GE LOGIQ Book)确认各吻合口的通畅性后关腹.
1.2.5 免疫抑制剂及术后处理: 受体术中新肝门脉血流开放前静脉注射甲基强的松龙10 mg/kg预防急性排斥反应, 术后逐渐减半量至1 mg/(kg•d)后维持. 手术当日至术后5 d, 25 mg/kg头孢呋辛钠2次/d预防感染. 术后第1-3天, 强痛定12.5 mg/12 h肌肉注射镇痛. 术后每日输注葡萄糖盐水补充液体、电解质及热量, 直至能正常进食流质. 术后注意各项监测, 观察胆汁引流和腹腔引流, 死亡后及时进行尸体解剖查找死亡原因, 并检查各吻合口通畅情况, 取移植物标本进行病理检查.
统计学处理 数据用SPSS15.0软件包进行统计学处理, 计量资料均用mean±SD表示, 3组间的多重比较用单因素方差分析(One-Way ANOVA)方法(Scheffe法), 方差不齐时应用变量转换. P<0.05认为差异有统计学意义, P<0.01认为差异有显著的统计学意义.
犬肝外观呈明显的分叶状[2], 深陷的叶间裂将各叶分隔开来. 左外叶、左中叶位于脐裂的左侧, 自脐裂向右依次排列着方叶、右中叶、右外叶和尾状叶, 位于腔静脉左侧和尾状叶相连的部分是舌状叶乳突, 解剖较其他各叶更为独立, 一共7叶. 各叶之间由较少的肝组织桥相连接, 右外叶和右中叶间的肝桥组织较左中叶和方叶间的肝桥组织更薄更少, 供体组手术中2处肝桥离断时均未发现有大的血管及胆管通过. 胆囊附着于方叶和右中叶之间的胆囊床上. 在解剖和功能上, 各叶均保持着较高的独立性, 存在着专属的供应血管及引流系统. 除了舌状叶乳突的小分支外, 门静脉主要分成3大支: 左支、中支和右支, 而胆总管也由左肝管、中肝管及右肝管3支肝管汇合而成. 而肝动脉可存在变异, 30只供体犬中21只的肝左、肝中及肝右动脉各为1支, 5只无单一的肝右动脉, 右外叶及尾状叶的2支供应动脉分别起自肝固有动脉(尾状叶动脉均从门静脉后方绕过), 另外4只无肝左动脉, 左外叶及左中叶各有1支专属的动脉. 肝血液经由肝左、中、右3支静脉回流, 肝左静脉由左外叶和左中叶的两个属支汇合而成, 而肝中静脉接受方叶和右中叶的血液回流, 肝左、中静脉先形成共干后再开口于后腔静脉, 肝右静脉则收集右外叶和尾状叶的静脉血, 单独开口于后腔静脉的右侧壁. 13/30供体中存在直径>4 mm的副肝静脉, 9/30位于右侧区, 4/30位于中央区右中叶. 供肝劈离后左侧区供肝包含左外叶、左中叶, 一级肝蒂由门静脉左支、肝左动脉和左肝管组成, 流出口为肝左静脉; 中央区供肝包括方叶和右中叶, 门静脉中支、肝中动脉和中肝管构成其一级肝蒂, 肝中静脉收集静脉血液; 右侧区供肝则由右外叶及尾状叶组成, 由门静脉右支和肝右动脉营养, 静脉血经肝右静脉回流, 胆汁收集至右肝管. 经过所有供受体肝脏的解剖, 发现除了肝动脉分支存在上述变异外, 犬肝三分区的解剖特点相当恒定.
各组供体的平均体质量差异无统计学意义(P = 0.411), 取供肝过程中均无严重并发症者, 3组供体的平均手术时间和失血量差异的比较结果无统计学意义(P = 0.536, P = 0.154), 体内劈离技术全部得以完成, 原位灌注避免了供肝的热缺血损伤(表1).
| 左侧区供肝(A组) | 中央区供肝(B组) | 右侧区供肝(C组) | P值 | |
| n | 6 | 15 | 9 | / |
| 供体体质量(kg) | 20.8±0.5 | 22.8±1.9 | 20.5±7.8 | 0.411 |
| 供体手术时间(min) | 242.0±72.6 | 225.0±44.7 | 264.0±54.7 | 0.536 |
| 供体失血量(mL) | 231.5±75.1 | 203.0±57.7 | 278.8±45.7 | 0.154 |
| 供肝质量(g) | 256.3±28.8 | 176.5±20.0 | 113.9±7.2 | <0.01 |
| 冷缺血时间(min) | 40.9±6.9 | 46.1±10.7 | 48.7±9.1 | 0.213 |
| 受体体质量(kg) | 14.9±0.7 | 12.6±1.3 | 9.1±0.8 | <0.01 |
| GRWR(%) | 1.7±0.2 | 1.4±0.2 | 1.3±0.1 | <0.01 |
| 受体手术时间(min) | 394.0±69.6 | 306.5±55.3 | 330.4±85.5 | 0.201 |
| 受体失血量(mL) | 405.5±105.3 | 437.5±85.7 | 496.2±78.8 | 0.096 |
| 受体输血量(mL) | 336.5±105.3 | 412.3±138.9 | 389.7±83.4 | 0.186 |
| 无肝期(min) | 42.9±3.5 | 39.9±9.9 | 34.1±6.4 | 0.140 |
| 胆汁排出时间(min) | 8.8±3.3 | 10.0±5.1 | 12.2±6.1 | 0.338 |
| 存活时间(h) | 128.3±48.5 | 102.7±59.8 | 98.7±36.8 | 0.234 |
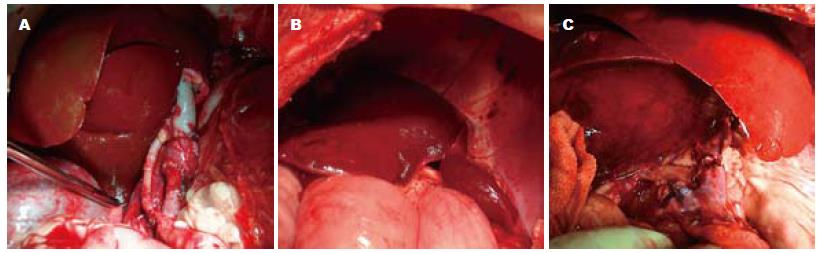
供肝劈离后三区肝块GRWR>1.0%且最接近1.5%者植入, 结果6只受体犬植入左侧区供肝(A组, n = 6), 15只受体植入中央区供肝(B组, n = 15), 9只受体接受右侧区供肝(C组, n = 9). 3组受体平均体质量、供肝质量之间的差异均存在显著的统计学意义(P<0.01), 但手术时间、无肝期、失血量及输血量间的差异无统计学意义(P>0.05). 3组中无术中死亡者, 30个供肝均成功植入, 所有血管及胆道的吻合均不需要移植物间置, 经重建的门静脉恢复灌注后新肝颜色逐渐转红, 开放动脉血流后新肝呈正常红润色(图2), 排泌胆汁时间差异的比较无统计学差异(P = 0.338).
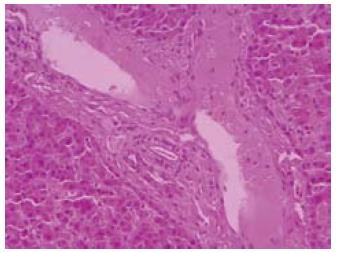
1/A和2/B术后3 d内出现胆漏, 3/B和2/C腹腔内少量渗血, 保守治疗后好转, 均非致死原因. 后48 h内死亡5只(1/B和1/A心跳骤停, 2/C肾功能衰竭, 1/B死于弥散性血管内凝血), 剩余25只均存活48 h以上, 最长存活9.8 d(死于严重肺部感染), 3组平均存活时间分别为128.3 h±48.5 h、102.7 h±59.8 h和98.7 h±36.8 h, 差异无统计学意义(P = 0.234). 死亡后尸检均未发现有死于外科技术性并发症者, 移植物标本病理检查肝细胞无淤血肿胀和缺血坏死者(图3).
对于终末期肝病的患者, 肝脏移植不仅是一种能够挽救生命的治疗方法, 还提供了使其长期健康存活的机会[3,4]. 但是由于全球范围内的供肝匮乏, 许多患者在等待中失去了生存的机会, 这一供需矛盾对于儿童受体更为突出[5-7]. 尽管现阶段活体供肝在亚洲国家被广泛采用, 但由于涉及到关键的伦理问题, 活体供肝肝移植注定也只能是一种临时性的、过渡性解决方案. 与之不同的是, SLT技术能增加供肝的绝对数量, 现已成为西方国家移植中心常规采用的方法, 劈离式供肝占各类型供肝总数量的比例逐年上升[8-10], 大有占领主导地位之势. 改良的SLT沿着肝圆韧带右侧0.5-1.0 cm断肝, 将供肝分割成一大一小两个部分[11,12], 能同时满足一个儿童受体和一个成人受体的需要, 同时成人和儿童患者的利益也得到了平衡. 随着外科技术的日趋进步, 现已出现了沿着肝中静脉的劈离方式, 两半肝都可以提供给成人受体[13-15]. 如此一来, 儿童受体可能得到的供肝总数无疑将会有所减少, 为了平衡儿童受体的潜在利益, 客观上要求开发出另外一种倾向于儿童受体的全新劈离技术, 于是本课题组设想将一个供肝分割成3份, 每一份供肝都能作为独立的器官用来移植, 这样1个成人供肝就可以满足3个小受体的移植需求.
肝脏外科的进步在很大程度上依赖于我们对于肝脏解剖认识的不断深入, 最初肝脏被看作是一个不成对的器官, 外科医师对很多肝脏外科疾病束手无策. 但自从Cantlie线被提出后, 左、右半肝的观念逐步被接受. 最早供肝劈离线也是沿着Cantlie线的[11,16], 经过不断改进后供肝劈离技术才逐渐成熟, 而实际上这一抽象的分界线在肝脏外观和实质内部并无解剖学标志[17]. 对肝脏的认识从一个浑然统一的整体发展到多个独立功能的肝段, 是另一个认识上的飞跃[18], 使肝脏手术有可能向更深、更细和更完善的领域发展. 在外科学和解剖学上"段"的含义是指在一个脏器内, 具有独立的功能、独立的血管供应及分泌物引流的一部分[18]. Couinaud功能性肝段8分法以及中华医学会的五叶六段法都是现在最常用的肝脏分段方法[19]. 理论上来说, 每个肝段都是一个独立的器官单位, 应该能单独分离出来, 且同时保持其解剖和功能的完整性[20], 但是目前的外科工具和技术都远远无法达到这一目标. 因此对现阶段的劈离式肝移植技术来说, 这些分段的理论尚缺乏真正的实际指导意义. 理论始终是要为实践服务的, 既然这些过于详细的肝段无法劈离出来, 那么在现有1分为2成熟劈离供肝技术的基础上, 本课题组提出肝脏为一个三分器官的定义, 经反复的犬肝解剖学观察, 证实这种分区方法是相当恒定的, 根据犬肝分叶和人类肝脏分段间的对应关系[2], 按照生物发育理论推论到人类肝脏[21], 类似地, 人肝可能也能分为3个区域, 三分法见表2.
| 三分法 | 左侧区 | 中央区 | 右侧区 | |
| 人肝 | 左外侧叶 | 左内侧叶+右前叶 | 右后叶 | 尾状叶 |
| 流出道 | 肝左静脉 | 肝中静脉 | 肝右静脉 | |
| 一级肝蒂 | 左肝蒂 | Glisson蒂右前支 | Glisson蒂右后支 |
此项研究的目标是一肝三受, 要求将一个供肝分割成3个部分, 并且每个部分都能用作单独的器官, 同时满足3个受体的移植需要, 但如果这样生硬的建立动物模型, 由于器官保存时间受限, 在供体手术时就需要同时进行3台受体肝移植手术, 此外还需要一组人员修肝, 对实验条件和人员要求太高, 如此设计实验可行性较差. 本研究采用盲法设计, 实验前将供受体编号并随机配对, 所有实验人员都在对犬体质量全不知情的情况下开始实验, 而且手术时两组手术人员均对对方术中情况互不知情, 供体手术组取出供肝后转入修肝组, 将供肝完全分割成三区后分别称重, 此时再由协调员分别计算各区供肝的GRWR, 最接近1.5%的一区供肝入选作为移植物植入. 尽管这样的设计不完全是真正意义上的"一肝三用", 但是通过供受体体质量要求、供受体随机配对及盲法的实验设计, 实验结果是每个受体均能安全接受移植手术, 且每部分供肝植入后均有足够的代谢功能, 这样的实验设计和结果, 同样也能证明3部分供肝均有作为供肝的可行性.
众所周知, 供肝质量和受体体质量的匹配必须适当, 相对受体如果供肝过大则易产生"大肝综合征", 如果过小则相反易形成"小肝综合征", 多项研究总结适宜的GRWR应在1.0%-4.0%之间[22,23]. 尽管以往的经验显示在活体肝移植中0.8%的GRWR也是可行的[24], 但对于劈离式肝移植, 通常认为还是应当将1.0%的GRWR作为低限值[22,23], 再考虑到劈离供肝的冷、热缺血-再灌注损伤以及供体原先的疾病对肝脏的影响, 一般将GRWR定在一个1.5%的安全值[23], 这是此次试验中我们选择供肝最适合GRWR的依据. 实际上犬肝为左大右小的质量分布, 前期实验结果显示3个区域肝块各自的质量均存在显著性差异[2], 此次实验结果是三区供肝适合3组不同体质量的受体. 而人类肝脏则为左小右大的形状, 相应地分为左侧区(左外侧叶)、中央区(左内侧叶+右前叶)、右侧区(右后叶), 由于也是左右不对称形状, 如此劈离的3部分质量也应该存在较大差异, 这样不同分区的供肝就能满足不同体质量受体的需要.
实验中, 修肝时供肝的胆总管、肝固有动脉、门静脉主干成分全部被去除, 只保留三区供肝各自的一级分支, 受体肝切除时则尽量保留肝蒂结构的长度, 由于实验的供受体均选用健康犬, 所以植入后血管、胆管吻合均无需移植物间置, 而大供体和小受体的配对设计使得各出入肝的管道吻合时口径较匹配. 将来如果临床应用, 供肝的胆总管、肝固有动脉、门静脉主干则都必须保留. 这样就可根据供肝的解剖条件和各个受体门管三联的具体情况灵活处理, 而供肝劈离前的影像学检查与评估尤其重要, 如果遇到罕见的门静脉无分支的情况绝对是劈离的反指证[25]. 由于门管三联各自一级分支的肝外部分长度不同, 传统的供体肝劈离一般是将胆总管及门静脉主干保留于右侧供肝, 而肝固有动脉多留在左侧供肝[25]. 若将来"一肝三受"实际临床应用, 儿童受体大多数是胆道闭锁的患儿, 供肝植入后都要进行肝管空肠吻合, 而且为了保护新肝肝管血供, 肝管切断平面还要求靠近肝实质, 所以肝胆管分配应该比较容易. 即使碰到少见的右后支肝管汇入左肝管的情形(6%)[26], 只要断肝前准确判断出变异, 劈肝后右侧区供肝断面上仍可保留有肝管开口. 肝动脉的吻合方面, 目前已是常规应用显微血管吻合技术, 所以也无需一定要求腹腔干袖片的动脉重建. 儿童受体大多数是婴幼儿, 从供肝流出口到门静脉断端之间的距离往往大于受体这两者之间的距离, 故要特别注意吻合后的门静脉容易产生过长、扭曲的问题[27], 而不用担心两断端的长度不够. 因此, 总的说来临床"一肝三受"中肝蒂的分配可能冲突不大. 动物实验中, 由于肝动脉变异较多, 遇到左侧区或右侧区有两支动脉供应的情况, 在修肝台时就将肝固有动脉保留于此区, 保证各区供肝植入时始终只需对单一动脉进行吻合, 从而减少了操作和吻合后动脉血栓形成的几率.
另外一个值得关注的问题是肝后腔静脉的处理, 实验中采用的是背驮式肝移植方式, 在供体手术时即将供肝从腔静脉上完全游离, 提供的三区供肝中均不包含有腔静脉的成分, 这样做的目的是利用供体良好的凝血功能防止新肝植入后分离面麻烦的渗血. 实际上, 腔静脉随整肝同时取下将会大大减少供体的手术时间, 对于脑死亡供体体内其他脏器的获取也会更为有利. 将第三肝门解剖的时机放在第一、二肝门之后也是基于考虑: 如果脑死亡供体的循环状态突然发生变化, 则可将原位劈离迅速转换成快速多器官切取程序, 把供肝和腔静脉一起快速取出. 临床应用时, 肝后腔静脉的保留也会使供肝流出口的重建方式变得更加灵活[28], 尤其是右侧区供肝存在有粗大的右副肝静脉[29,30], 这种情况下腔静脉壁可制作成相应的袖片, 如此重建的流出道更有利于血液回流. 现在已知, 一个小体积的肝移植物很难承受相对高流量的入肝血流和低流量的离肝血流, 由此产生的流出道相对梗阻会导致移植肝功能不全[31,32], 因此临床中常常需要保留供肝上直径>5 mm的副肝静脉[33,34]. 为了避免供肝瘀血, 实验中对于含粗大副肝静脉的供肝(直径>4 mm), 采用单独重建的方式.
在前期实验成功制作中叶供肝肝移植动物模型的基础上[2], 此次实验我们更进一步对一个供肝分割成三份独立供肝的新劈离技术进行了尝试, 并对"一供三受"肝移植的全新模式也进行了一些初步的探索和经验积累. 经过体内原位劈离, 大供体的肝脏被分割成3个独立完好的小供肝, 但保持肝蒂结构相连. 未来实际应用时, 肝蒂的分割也应该在修肝时进行, 根据3个受体的不同情况做相应处理. 例如, 供肝修整后, 根据第一个受体的体质量先确定适合植入哪一区供肝, 然后再根据供肝肝蒂具体情况及受体门管三联的条件决定供肝肝蒂的第一次分配, 先分离出一区供肝后, 剩下的2个供肝肝块则再按照第二、三个受体的相应情况做适当的处理, 再次分配余下的门管三联结构, 事实上胆总管、肝固有动脉及门静脉主干可以保留于任意一区, 只需将其他区供肝一级结构切断后的开口缝闭即可. 由于犬肝分叶明显的解剖特点, 分区恒定, 容易分割, 而实际人肝一级肝蒂结构可能存在一些变异类型, 劈离前必须进行细致的影像学评价. 一个供肝三分之后能供给3个不同体质量的小受体, 若欲提供给较大受体则必须先克服小肝综合征带来的一系列问题, 作为辅助肝移植的供肝提供给成人受体的方案也是很有应用前景的. 设想若将来的器官保存研究取得重大突破, 受体手术突破器官保存时间的限制[35], 则一肝多受的肝移植模式将具有巨大的潜在优势.
此项动物实验的研究证明: 一个大受体的肝脏能劈离成3个部分, 且每一部分都能作为独立完整的供肝移植给不同体质量的小受体.
感谢中国人民解放军总医院实验动物中心提供的动物手术设施.
目前肝脏移植仍然是治疗终末期肝病最有效的手段, 但全球范围内供肝匮乏的现状严重地阻碍着肝脏移植的临床应用, 劈离式肝移植是增加供肝绝对数量的革命性方式. 此项研究尝试将一个肝脏劈离成3个供肝单位, 用犬制作动物模型来探索这一新技术的可行性.
徐泱, 副主任医师, 上海复旦大学附属中山医院
现阶段活体供肝在亚洲国家被广泛采用, 但由于伦理问题, 活体供肝肝移植注定也只能是一种临时性的、过渡性解决方案. 劈离式技术能增加供肝的绝对数量, 是现在西方国家移植中心常规采用的方法, 到目前已出现了沿着肝中静脉的劈离方式, 两半肝都可以提供给成人受体. 于是本课题组设想将一个供肝分割成3份, 以满足一个供肝3个小受体的移植需求.
劈离式肝移植在西方国家仍被广泛采用, 且还在改良发展, 现已出现了沿着肝中静脉的劈离方式, 两半肝都可以提供给成人受体. 甚至右后叶供肝也有早有在临床应用的报道, 经检索目前还没有一肝多受的临床报道.
此研究从新的思路探索如何拓展供肝来源, 不仅从技术的可行性方面进行了论证, 还初步摸索了一肝多受的全新模式并积累了经验. 实验设计上采用了随机配对、盲法设计和自身对照, 大大减少了动物的数量, 简化了实验步骤, 但结果同样能证明结论, 同时也更加符合动物实验的伦理学要求.
此研究中一个供肝3分之后能供给3个不同体质量的小受体, 若欲提供给较大受体则必须先克服小肝综合征带来的一系列问题, 作为辅助肝移植的供肝提供给成人受体的方案也是很有应用前景的. 如果将来的器官保存研究取得重大突破, 受体手术突破器官保存时间的限制, 则一肝多受的肝移植模式将具有巨大的潜在优势.
劈离式肝移植: 将一个肝脏分割成两个较小的肝组织块, 两部分均作为供肝用来移植的技术; Cantlie线: 1898年Cantlie发现人的肝左右叶是对等份, 由下腔静脉左侧壁至胆囊窝中份的平面分开, 相当于肝脏的正中裂, 所以后来称此线为Rex-Cantlie线.
供肝短缺是肝移植手术中面对的主要问题, 探索供体肝新的来源已成为目前肝移植领域的重要课题之一. 该文对拓展劈离式肝移植的应用范围在动物上进行了较为可贵的术前探索, 虽然与临床应用仍有一定的距离, 但仍然值得鼓励.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | 周 峻, 王 政, 李 龙, 侯 文英, 谢 华伟, 崔 龙, 王 文晓, 张 金山, 刘 树立, 李 胜利. 临时性门腔静脉架桥联合流出道改良重建方法在部分供肝肝移植中应用的实验研究. 临床小儿外科杂. 2011;10:180-184. |
| 2. | 周 峻, 王 政, 李 龙, 谢 华伟, 崔 龙, 侯 文英, 王 文晓, 张 金山, 李 胜利, 刘 树立. 中叶供肝肝移植可行性的动物实验研究. 中国普通外科杂志. 2012;21:23-29. |
| 5. | McDiarmid SV, Anand R, Martz K, Millis MJ, Mazariegos G. A multivariate analysis of pre-, peri-, and post-transplant factors affecting outcome after pediatric liver transplantation. Ann Surg. 2011;254:145-154. [PubMed] [DOI] |
| 6. | Karnsakul W, Intihar P, Konewko R, Roy A, Colombani PM, Lau H, Schwarz KB. Living donor liver transplantation in children: A single North American center experience over two decades. Pediatr Transplant. 2012;16:486-495. [PubMed] [DOI] |
| 7. | Emre S, Umman V, Cimsit B, Rosencrantz R. Current concepts in pediatric liver transplantation. Mt Sinai J Med. 2012;79:199-213. [PubMed] [DOI] |
| 8. | Mallik M, Callaghan CJ, Hope M, Gibbs P, Davies S, Gimson AE, Griffiths WJ, Pettigrew GJ. Comparison of liver transplantation outcomes from adult split liver and circulatory death donors. Br J Surg. 2012;99:839-847. [PubMed] [DOI] |
| 9. | Vagefi PA, Parekh J, Ascher NL, Roberts JP, Freise CE. Outcomes with split liver transplantation in 106 recipients: the University of California, San Francisco, experience from 1993 to 2010. Arch Surg. 2011;146:1052-1059. [PubMed] [DOI] |
| 10. | Lee WC, Lee CS, Soong RS, Lee CF, Wu TJ, Chou HS, Chan KM. Split liver transplantation in adults: preoperative estimation of the weight of right and left hemiliver grafts. Liver Transpl. 2011;17:93-94. [PubMed] [DOI] |
| 11. | Nesher E, Island E, Tryphonopoulos P, Moon J, Nishida S, Selvaggi G, Tekin A, Levi DM, Tzakis A. Split liver transplantation. Transplant Proc. 2011;43:1736-1741. [PubMed] [DOI] |
| 12. | Hong JC, Yersiz H, Busuttil RW. Where are we today in split liver transplantation? Curr Opin Organ Transplant. 2011;16:269-273. [PubMed] [DOI] |
| 13. | Cescon M, Grazi GL, Ravaioli M, Ercolani G, Del Gaudio M, Vivarelli M, Cucchetti A, Zanello M, Vetrone G, Lauro A. Conventional split liver transplantation for two adult recipients: a recent experience in a single European center. Transplantation. 2009;88:1117-1122. [PubMed] [DOI] |
| 14. | Quintini C, Aucejo F, Miller CM. Split liver transplantation: Will it ever yield grafts for two adults? Liver Transpl. 2008;14:919-922. [PubMed] [DOI] |
| 15. | Zambelli M, Andorno E, De Carlis L, Rossi G, Cillo U, De Feo T, Carobbio A, Giacomoni A, Bottino G, Colledan M. Full-Right-Full-Left Split Liver Transplantation: The Retrospective Analysis of an Early Multicenter Experience Including Graft Sharing. Am J Transplant. 2012; May 11. [Epub ahead of print]. [PubMed] [DOI] |
| 16. | Emre S, Umman V. Split liver transplantation: an overview. Transplant Proc. 2011;43:884-887. [PubMed] [DOI] |
| 17. | LH Blumgart, Historical Perspective. In Blumgart, Surgery of the Liver, Biliary Tract, and Pancreas, 4th ed, Philadelphia Saunders. 2006;72-82. |
| 19. | 杨 镇. 肝脏外科学图解. 上海: 上海科学技术出版. 2009;9-13. |
| 22. | Frühauf NR, Malagó M, Frilling A, Beckebaum S, Broelsch CE. Latest development in split liver transplantation. Surg Technol Int. 2004;13:183-189. [PubMed] |
| 23. | Heaton N. Small-for-size liver syndrome after auxiliary and split liver transplantation: donor selection. Liver Transpl. 2003;9:S26-S28. [PubMed] [DOI] |
| 24. | Selzner M, Kashfi A, Cattral MS, Selzner N, Greig PD, Lilly L, McGilvray ID, Therapondos G, Adcock LE, Ghanekar A. A graft to body weight ratio less than 0.8 does not exclude adult-to-adult right-lobe living donor liver transplantation. Liver Transpl. 2009;15:1776-1782. [PubMed] [DOI] |
| 26. | 黄 志强, 黄 晓强, 宋 青. 黄志强胆道外科手术学. 北京: 人民军医出版社 2010; 27-30. |
| 27. | Kasahara M, Kiuchi T, Haga H, Uemoto S, Uryuhara K, Fujimoto Y, Ogura Y, Oike F, Yokoi A, Kaihara S. Monosegmental living-donor liver transplantation for infantile hepatic hemangioendothelioma. J Pediatr Surg. 2003;38:1108-1111. [PubMed] [DOI] |
| 28. | Quintini C, Miller CM, Hashimoto K, Philip D, Uso TD, Aucejo F, Kelly D, Winans C, Eghtesad B, Vogt D. Side-to-side cavocavostomy with an endovascular stapler: Rescue technique for severe hepatic vein and/or inferior vena cava outflow obstruction after liver transplantation using the piggyback technique. Liver Transpl. 2009;15:49-53. [PubMed] [DOI] |
| 29. | Dulundu E, Sugawara Y, Kaneko J, Kishi Y, Akamatsu N, Matsui Y, Kokudo N, Makuuchi M. Short hepatic vein reconstruction in biliary atresia patients with absent inferior vena cava. Clin Transplant. 2007;21:13-17. [PubMed] [DOI] |
| 30. | Humar A, Khwaja K, Sielaff TD, Lake JR, Payne WD. Split-liver transplants for two adult recipients: technique of preservation of the vena cava with the right lobe graft. Liver Transpl. 2004;10:153-155. [PubMed] [DOI] |
| 31. | Goralczyk AD, Obed A, Beham A, Tsui TY, Lorf T. Posterior cavoplasty: a new approach to avoid venous outflow obstruction and symptoms for small-for-size syndrome in right lobe living donor liver transplantation. Langenbecks Arch Surg. 2011;396:389-395. [PubMed] [DOI] |
| 32. | Lei JY, Wang WT, Yan LN. Risk Factors of SFSS in Adult-to-Adult Living Donor Liver Transplantation Using the Right Liver: A Single-Center Analysis of 217 Cases. Hepatogastroenterology. 2012;59:1491-1497. [PubMed] |
| 33. | Kiuchi T, Tanaka K, Ito T, Oike F, Ogura Y, Fujimoto Y, Ogawa K. Small-for-size graft in living donor liver transplantation: how far should we go? Liver Transpl. 2003;9:S29-S35. [PubMed] [DOI] |
| 34. | Humar A, Khwaja K, Sielaff TD, Lake JR, Payne WD. Technique of split-liver transplant for two adult recipients. Liver Transpl. 2002;8:725-729. [PubMed] [DOI] |