修回日期: 2012-07-10
接受日期: 2012-08-07
在线出版日期: 2012-08-18
目的: 观察茵陈蒿汤及其变方对刀豆蛋白(concanavalin A, ConA)诱导小鼠慢性免疫性
肝损伤的保护作用.
方法: 选用Balb/c小鼠70只, 雌雄各半, 随机分为正常对照组、模型组、茵陈蒿汤组、茵陈蒿汤加丹参组、茵陈蒿汤加黄芪组、荣肝合剂组和荣肝小方组. 正常组小鼠尾静脉注射PBS溶液0.3 mL, 其他各组按ConA 6 μg/g体质量尾静脉注射造模, 1次/wk, 连续8 wk, 制备慢性肝损伤模型. 造模成功后, 模型组和正常组以等体积蒸馏水灌胃. 各治疗组灌胃给药, 每日1次, 连续4 wk, 末次给药后24 h, 检测血清中IP-10、CXCR-3和TNF-a活性; 肝组织光镜下观察其病理变化.
结果: 与模型组比较, 各用药组(茵陈蒿组、茵陈蒿汤加丹参组、茵陈蒿汤加黄芪组、荣肝合剂组和小方组)血清IP-10、CXCR-3、TNF-a的水平(ng/mL)均降低(IP-10: 44.56±0.30、42.18±0.54、32.18±0.37、36.46±0.47、35.98±0.65 vs 52.73±0.46; CXCR-3: 64.86±0.63、37.88±0.63、 40.18±0.57、38.58±0.62、36.94±0.26 vs 64.86±0.63; TNT-a: 43.45±0.65、32.78±0.27、42.18±0.37、28.69±0.85、24.46±0.57 vs 93.32±0.81, 均P<0.05), 各组间无统计学差异(P>0.05); 与模型组比较, 中药组肝细胞坏死减轻、变性减少、炎细胞浸润和肝纤维化减轻(均P<0.05); 茵陈蒿汤加丹参组、荣肝合剂组和小方组肝组织纤维增生程度较小(均P<0.05).
结论: 清利湿热, 健脾活血的荣肝合剂及荣肝小方组对ConA所致小鼠肝损伤具有较好的综合保护作用.
引文著录: 刘果, 王凤云, 唐旭东, 张引强, 杨俭勤, 卞立群, 赵迎盼, 张北华. 茵陈蒿汤及其变方对ConA诱导慢性免疫性肝损伤小鼠IP-10、CXCR3的影响. 世界华人消化杂志 2012; 20(23): 2131-2137
Revised: July 10, 2012
Accepted: August 7, 2012
Published online: August 18, 2012
AIM: To observe the effect of modified decoction of Yinchenhaotang on concanavalin A (ConA) induced chronic hepatic injury in mice.
METHODS: Seventy Balb/c mice were randomly divided into 7 groups: normal group, model group, Yinchenhaotang group, Yinchenhaotang plus salvia miltiorrhiza group, Ynchenhaotang plus milkvetch root group, Rongganheji group, and Rongganxiaofang group. Mice in the normal group were injected with 0.3 mL of PBS solution via the tail vein, while mice in other groups were injected with ConA at a dose of 6 μg/g of body weight once a week for 8 wk. Mice in each groups were administrated with each treatment reagent for 4 wk, and the same volume of normal saline was given to the normal and model groups. Twenty-four hours after the last administration, blood samples were taken to determine the levels of IP-10, CXCR3 and TNF-a. The degree of inflammation and fibrosis was observed under a light microscope.
RESULTS: Serum levels of IP-10, CXCR3 and TNF-α (ng/mL) were reduced in all the treatment groups (Yinchenhaotang group, Yinchenhaotang plus salvia miltiorrhiza group, Ynchenhaotang plus milkvetch root group, Rongganheji group, and Rongganxiaofang group) compared to the model group(IP-10: 44.56 ± 0.30, 42.18 ± 0.54, 32.18 ± 0.37, 36.46 ± 0.47, 35.98 ± 0.65 vs 52.73 ± 0.46; CXCR-3: 64.86 ± 0.63, 37.88 ± 0.63, 40.18 ± 0.57, 38.58 ± 0.62, 36.94 ± 0.26 vs 64.86 ± 0.63; TNT-a: 43.45 ± 0.65, 32.78 ± 0.27, 42.18 ± 0.37, 28.69 ± 0.85, 24.46 ± 0.57 vs 93.32 ± 0.81, all P<0.05). Compared to the model group, liver fibrosis and cell necrosis were significantly improved in Rongganheji and Yinchenhaotang groups (all P < 0.05).
CONCLUSION: Rongganheji has a good protective effect against concanavalin A-induced liver injury in mice.
- Citation: Liu G, Wang FY, Tang XD, Zhang YQ, Yang JQ, Bian LQ, Zhao YP, Zhang BH. Effect of modified decoction of Yinchenhaotang on IP-10 and CXCR3 expression in concanavalin A-induced liver injury in mice. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2131-2137
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2131.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2131
清利肝胆湿热的茵陈蒿汤抗肝损伤作用的研究已经得到了临床和实验研究的证实. 由于慢性肝损伤中医病机的复杂性, 在临床实践中单纯使用清热利湿法效果尚不能令人满意, 需辨证与其他治法合用. 王凤云等[1]报道荣肝合剂在临床调治慢性肝损伤取得了满意的疗效. 为了进一步探讨其作用和与茵陈蒿汤及其变方的效应机制差异, 我们采用刀豆蛋白A(con-canavalin A, ConA)诱导小鼠肝损伤的模型, 模拟慢性肝损伤状态, 观察模型小鼠血清学趋化因子和病理组织学及相关指标的变化, 探讨体现不同治法的中药复方防治慢性肝损伤的物质基础.
采用Balb/c小鼠, 由北京维通利华公司提供, 许可证编号SCAC(京)2006-0009, 共70只, ♂35只, ♀35只, 体质量18-20 g, 昼夜节律12:12, 即早6:00开灯, 晚6:00熄灯. 实验动物由中国中医科学院西苑医院实验动物中心饲养, SPF级, 22 ℃, 55%湿度. ConA规格为25 mg/支购自Sigma公司. 荣肝合剂(茵陈、黄芪和鸡骨草等)浓缩液含生药2.5 g/mL, 茵陈蒿汤(茵陈、栀子和大黄)浓缩液含生药2 g/mL, 荣肝小方(茵陈和鸡骨草等)浓缩液含生药1.81 g/mL, 茵陈蒿汤加丹参组(茵陈、栀子、大黄和丹参)含生药1.81 g/mL, 茵陈蒿汤加黄芪组(茵陈、栀子、大黄和黄芪)含生药1.81 g/mL, 均由中国中医科学院西苑医院制剂室制备.
1.2.1 分组及造模: 小鼠随机分为正常组、模型组、茵陈蒿组、茵陈蒿汤加丹参组、茵陈蒿汤加黄芪组、荣肝合剂组和小方组, 每组10只, 雌雄各半. 正常对照组小鼠尾静脉注射PBS溶液0.3 mL, 其他各组按ConA 6 μg/g以0.9%的生理盐水稀释, 浓度为1 mg/mL, 尾静脉注射造模, 1次/wk, 连续8 wk. 造模结束后, 从模型组和正常组各随机抽取1只处死观察, 以肝组织出现纤维条索病理改变和血清血清丙氨酸基转移酶(alamine aminotransferase, ALT)活性超过正常值上限2倍以上为造模成功. 造模成功后, 按体表面积折算法, 以荣肝小方组15.57 g/kg、荣肝合剂组30.56 g/kg, 茵陈蒿汤组10.38 g/kg、茵陈蒿汤加丹参组18.13 g/kg和茵陈蒿汤加黄芪组18.13 g/kg(相当于60 kg成人临床用量的10倍)灌胃给药; 正常组和模型组蒸馏水0.02 mL/g灌胃, 每天1次, 共4 wk, 给药时间为每天上午9:00-11:00.
1.2.2 检测指标: (1)形态观察: 实验期间每天观察记录各组小鼠一般状况(精神状态、活动情况、毛发光泽度、食欲和大小便情况等)和死亡情况; (2)病理标本的采集. 在每鼠肝脏同一部位取肝组织2 mm, 用体积分数为40 g/L甲醛固定, 常规石蜡包埋, 5 μm厚切片, 行HE染色及Masson三色染色, 光镜定位肝小叶及周边炎症浸润区和坏死区; (3)病理检测: 标本由中国中医科学院西苑医院病理室检测. 病理形态学观察和肝组织炎症活动度积分标准按王泰龄等[2]方案进行分析, 多样本比较用单因素方差分析和/或秩和检验, 计数资料用χ2检验; (4)血清检测: 小鼠摘眼球取血, 室温静置30 min, 3 000 r/min(离心半径
87 mm)离心15 min后, 分离血清, 置于-20 ℃冰箱待测. 采用双抗体夹心ABC-ELISA法. 试剂盒购自北京华肽先锋有限公司, 为进口试剂分装.
所用酶标仪为奥地利生产的SPECTRA酶标比色计. 检测程序按照试剂盒说明书进行, 具体如下: (1)建立标准曲线: 设标准孔8孔, 每孔中各加入样品稀释液100 µL, 第1孔加标准品100 µL,混匀后用加样器吸出100 µL, 移至第2孔. 如此反复操作对倍稀释至第7孔. 最后, 从第7孔中吸出100 µL弃去, 使每孔体积均为100 µL. 第8孔为空白对照; (2)加样: 待测品孔各加入待测样品100 µL; (3)将反应板置37 ℃, 120 min; (4)洗板: 用洗涤液将反应板充分洗涤4-6次, 向滤纸上印干; (5)每孔中加入第一抗体工作液50 µL; (6)将反应板充分混匀后置37 ℃, 60 min; (7)洗板: 同前; (8)每孔加酶标抗体工作液100 µL; (9)将反应置37 ℃, 30 min; (10)洗板: 同前; (11)每板加入底物工作液100 µL, 置37 ℃处暗处反应5-10 min; (12)每孔加入1滴终止液混匀; (13)在492 nm处测吸光(A)值.
结果计算与判断: (1)所有A值都应减去空白值后再进行计算; (2)以标准品1 000、500、250、125、62.5、32、16和0 ng/mL的A值用SPSS作散点图, 并求出直线回归方程. 根据样品A值, 用方程求出IP-10、CXCR3和TNF-α含量.
统计学处理 计量资料均进行正态性检验, 采用非参数检验的单样本K-S拟合优度检验(1-Sample K-S Test). 如符合或近似符合正态分布, 治疗前后比较采用配对t检验, 两样本均数比较采用两个独立样本的t检验; 多个样本均数比较用方差分析; 对不符合正态分布者, 采用非参数检验的秩和检验, 治疗前后采用两相关样本比较的Wilcoxon符号秩和检验, 两组比较采用两独立样本比较的Wilcoxon秩和检验. 等级资料采用秩和检验. 正态性检验、方差齐性检验及可比性检验显著性水平α = 0.10, 其他α = 0.05. 统计软件采用SPSS13.0 for Windows.
造模过程中, ConA造模组, 第2周、4周和8周各有1只♂小鼠死亡. 给药过程中, 模型组有3只小鼠死亡, 茵陈蒿汤组死亡1只, 其余各组均无小鼠死亡. 实验过程中, 未造模前各组动物形态及活动无明显差异. 造模后, 正常组小鼠运动活泼、快速有力、有精神、进食良好、毛浓密而有光泽, 并且腿部肌肉结实; 而模型组随实验的进行小鼠变得不喜欢活动、动作较为迟钝、常作萎靡状、弓背喜卧、体温下降、进食欠佳、毛稀疏而干并且粗乱蓬松. 各中药治疗组小鼠在活动和进食方面均较模型组好, 毛密而不蓬松,有光泽, 并且弓背喜卧者少.
正常对照组肝脏质地柔软、呈褐色、表面光滑, 并且无肿大; 模型组动物肝脏明显淤血肿大、呈暗红色, 并且可见点状或小片状出血. 各治疗组小鼠肝脏与对照组比较, 肝脏颜色深浅不一、体积大小不等, 并且表面较光滑无明显结节.
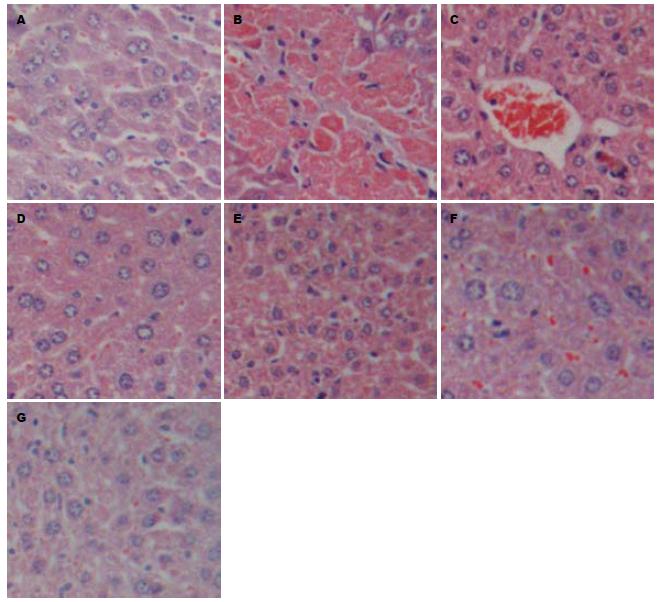
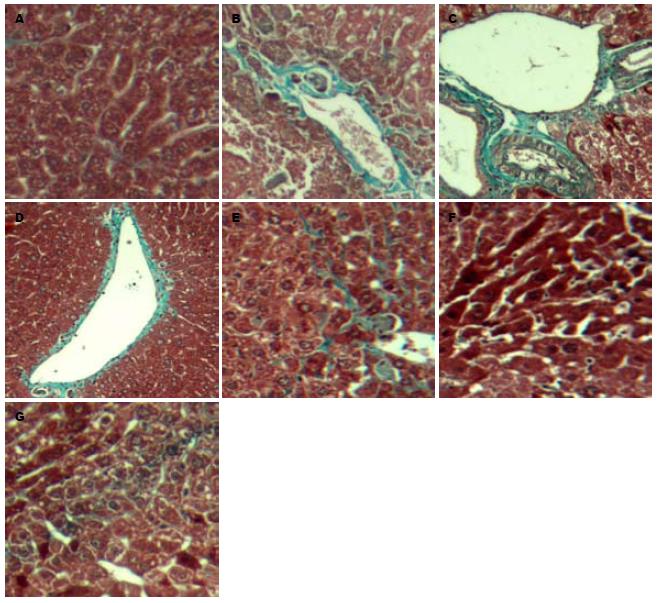
正常组肝小叶结构完整、肝索以中央静脉为中心呈放射状排列、肝细胞呈多面形、核大而圆、位于肝细胞中央、肝窦内及汇管区可见少量淋巴细胞浸润、未见纤维组织增生; 模型组肝小叶失去正常结构、肝索排列紊乱、肝细胞普遍变性、浑浊肿胀和胞浆疏松, 甚至呈气球样变; 肝血窦变狭窄, 可见广泛的脂肪变性并有散在的嗜酸性变、嗜酸性小体形成、灶性坏死甚至大片状坏死、坏死灶及汇管区淋巴细胞浸润; 肝细胞再生活跃、核大、深染, 有的可见双核, 偶见核分裂相、汇管区增宽、有大量的成纤维细胞和纤维细胞; 增生的胶原纤维自中央静脉及汇管区向周围延伸并包绕肝小叶, 并分割肝小叶而形成假小叶; 肝血窦周围可见纤维组织增生. 荣肝合剂组和小方组可见炎症轻微, 有肝细胞再生, 无纤维间隔形成, 茵陈组与茵陈蒿汤加黄芪组有纤维间隔形成, 甚至有假小叶的形成. 中药组与模型组比较, 在减轻肝细胞坏死、减少变性、减轻炎细胞浸润以及减轻肝纤维化方面有统计学差异(P<0.05, 表1, 图1, 2).
ConA是一种植物凝集素, 可诱导淋巴细胞巨噬细胞的细胞毒作用, 由于肝脏内含有大量的巨噬细胞, 当给动物静脉注射ConA后, 首先活化肝细胞中的T细胞, 对肝细胞造成损伤[1]. 课题组在前期研究中, 通过小剂量ConA刺激制作慢性肝损伤模型模拟HBV慢性感染状态取得了成功[3]. 本研究沿用了其造模方法, 以清热利湿的茵陈蒿汤、清热利湿健脾的茵陈蒿汤加黄芪方、清热利湿活血的茵陈蒿汤加丹参方、清热利湿健脾活血的荣肝合剂及其精简方加以干预, 研究表明, 荣肝合剂、荣肝小方、茵陈蒿汤及其变方均能对肝组织的慢性病理损伤有较好的改善作用, 其中以体现清利湿热、健脾益气、活血化瘀法的荣肝合剂和小方在减轻肝纤维化方面与茵陈蒿汤和茵陈蒿汤加黄芪组相比显示出一定的优势, 显示出较好的综合疗效.
趋化因子(chemokine)作为一种能引起炎性细胞聚集的重要的炎性细胞因子, 参与慢性肝病的免疫调节和免疫病理反应. 趋化因子的过度释放, 一方面介导炎性细胞向病灶部位聚集浸润, 加重局部炎症程度; 另一方面趋化因子/趋化因子受体促使白细胞、淋巴细胞释放各种降解酶和氧自由基等造成组织器官损伤, 引起炎性细胞在肝脏聚集, 导致宿主肝细胞损伤甚至重症肝炎中起着重要的作用[4]. 趋化因子能够趋化、激活中性粒细胞、单核细胞、NK细胞和淋巴细胞等在炎症部位聚集, 参与组织损伤和修复[5].
慢性乙型肝炎(chronic hepatitis B, CHB)以Thl细胞性炎症反应为主. Thl细胞表达CXCR3和CXCR5[6], 其中, CXC亚家族趋化因子如γ干扰素诱导蛋白10(interferon-gamma inducible protein-10, IP-10), 通过与其受体CXCR3作用趋化Thl细胞.
大量研究证实了IP-10在慢性肝损伤发挥着重要的机制. 王健等[7]对慢性丙型肝炎患者PBMC内IP-10 mRNA研究发现, 其水平与对照组相比, 差异具有显著性. 赵金红等[8]对乙型肝炎患者PBMC内IP-10 mRNA水平研究, 发现其表达水平也升高, 具有显著性差异. IP-10趋化非特异性单核细胞及其他炎性细胞浸润于肝脏, 造成肝组织免疫损伤. Mihm等[9]报道结果与之类似.
目前有关IP-10功能的研究主要在以下几个方面: IP-10趋化非特异性单核细胞及其他炎性细胞浸润于肝脏, 造成肝组织免疫损伤. Mihm等[9]通过RT-PCR技术发现慢性丙肝患者中IP-10 mRNA和血清中IP-10蛋白浓度表达均增高, 但CHB患者中虽表达增高, 但未达到显著性差异. 在上述研究中, 其发现CHB、慢性丙型肝炎患者肝脏炎症局部浸润细胞均主要为Th1和Th0, 无Th2细胞, 也有天然T细胞、NK细胞和单核/巨噬细胞浸润, 这与IP-10作用的靶细胞一致. 在自身免疫性肝病、慢性丙型肝炎和乙型肝炎病毒感染动物模型IP-10和CXCR3的分泌增加[10-12]; CHB患者血清IP-10水平升高, 肝组织表达IP-10及IP-10 mRNA, 肝组织中浸润的炎性细胞高表达CXCR3, 且与疾病进展密切相关[12]. 通过检测HBV患者外周血淋巴细胞表面CXCR3的表达发现: CXCR3阳性的淋巴细胞和单核细胞明显增多, 且以CXCR3 CD8+T细胞的增加更加明显, 且重型肝炎较轻中型增加更加显著[13]. 在丙型肝炎病毒(hepatitis c virus, HCV)患者肝脏内亦检测到CXCR3的高表达, 淋巴细胞浸润明显的肝组织表达强于其他组织. 大量的CXCR3+T细胞进入肝小叶, 这种正反馈机制是导致肝炎病毒的慢性损伤的关键机制[14]. Kakimi等[15]在HBV转基因小鼠模型中采用抗IP-10治疗炎症反应, 可明显减少CTL炎症浸润及病变程度, 从另一角度证实了此论点.
在慢性肝损伤的发生过程中, TNF-α也是造成肝炎肝细胞坏死的重要介质之一. TNF-α参与肝纤维化和肝硬化, 可能主要通过激活储脂细胞转化为肌纤维母细胞, 并刺激成纤维细胞增殖, 从而促进细胞外基质(extracellular matrix, ECM)的合成有关, 提示TNF-α在肝硬化发生发展中起重要作用. TNF-α可直接杀伤正常肝细胞, 并介导毛细管炎症, 引起肝细胞性黄疸, 促进黄疸加重. 细菌、病毒感染、免疫复合物和化学药物等因素可导致枯否细胞大量释放TNF-α参与肝损伤过程, 是介导肝损伤的主要终末介质[16], 有文献表明CHB患者血清TNF-α水平非常显著地高于正常对照组[17,18]. 有的研究证明血清TNF-α水平与肝细胞炎症和坏死程度密切相关.
中医认识到慢性肝病之所以反复发作个迁延难愈, 与其"湿、热、毒、瘀和虚"交杂的病理特点密切相关, 尤以湿热邪气为重. 因此, 清热利湿法当贯穿治疗的始终, 茵陈蒿汤是常用方剂之一. 现代研究证实: 本方具有促进胆红素代谢, 解除胆汁瘀积[19,20]、抗肝损伤[21,22]、抑制肝细胞凋亡[23]、抑制星状细胞活化及胶原合成等药理作用[24,25]. 同时能改善脂肪代谢[26], 广泛应用于多种肝病治疗领域.
然而慢性肝病中的湿热病邪多伴有脏腑内伤的基础, 故在临床治疗上要标本兼顾, 在清利湿热的同时, 不要忽视其与其他治法的合用. 现代研究证实, 慢性肝病的患者存在免疫功能的下降. 如谢学军[27]检测103例慢性肝炎中医辨证为肝郁脾虚和肝胆湿热患者外周血NK细胞活性, 并与30名健康人作对照, 发现上述两种中医证型的患者NK活性均降低, 而慢迁肝中肝胆湿热型NK活性更低, 说明慢肝本虚的部分实质, 强调治疗慢肝时扶正祛邪的重要性.
湿热之邪缠绵日久, 湿为阴邪, 其性粘腻, 易遏阳气, 致气滞血淤, 热为阳邪, 热壅气机, 阳气拂郁, 气郁血瘀, 实乃"湿可致瘀, 热可致瘀, 湿与热合, 更易致瘀"[28]. 病理情况下, 过食膏粱厚味, "浊气"有余, 化为湿热痰浊, 浸淫血脉, 遂成血中湿热证, 故湿热内伤, 日久多易深入血分. 王孟英言: "湿热熏蒸不已, 自气入营血矣"[29]较之气分湿热证更难治疗, 表现为病情深重, 湿热瘀血相互胶结, 日久难愈. 如华岫云在《临证指南医案》所言: "郁则气滞, 气滞则必化热, 热郁则津液耗而不流, 升降之机失度, 必伤气分, 久延血分, 延及郁劳沉苛"[30]. 湿热之邪易于致瘀. 认识这一病理特点, 我们在清热利湿的茵陈蒿汤基础上加入具有活血的丹参, 阻止肝纤维化的进展, 提高慢性肝病的疗效.
实验表明, 茵陈蒿汤及其变方能通过减低趋化因子IP-10及其受体CXCR3的异常表达, 减轻或消除慢性肝损伤的始动因素, 是防治慢性肝损伤重要的环节, 并且能够降低炎症因子TNF-α含量, 减小其对肝细胞的破坏作用. 在病理学改变方面, 荣肝合剂及其小方组既能保护肝细胞, 又可以减轻肝纤维化, 体现出一定的综合优势.
慢性肝病致病机制复杂, 清热利湿之法当贯穿始终, 必须综合与其他治法灵活合用. 本研究比较了清热利湿法、清利健脾法、清利活血法、清理健脾活血法的茵陈蒿汤及其变方对慢性免疫性肝损伤小鼠病理组织、趋化因子及其受体和炎症因子的效用差异.
许玲, 主任医师, 教授, 上海中医药大学附属龙华医院肿瘤科
本课题组在前期研究中, 通过小剂量刀豆蛋白(ConA)刺激制作慢性肝损伤模型模拟HBV慢性感染状态取得了
成功.
荣肝合剂、荣肝小方、茵陈蒿汤及其变方均能对肝组织的慢性病理损伤有较好的改善作用, 其中以体现清利湿热、健脾益气、活血化瘀法的荣肝合剂和小方在减轻肝纤维化方面与茵陈蒿汤和茵陈蒿汤加黄芪组相比显示出一定的优势, 显示出较好的综合疗效.
本文研究了茵陈蒿汤及其变方对趋化因子IP-10及其受体CXCR3表达的影响. 证明了茵陈蒿汤及其变方在保护肝细胞和减轻肝纤维化中的优势.
本研究对于经典复方作用机制的阐明有一定的意义.
编辑: 李军亮 电编:鲁亚静
| 1. | 王 凤云, 唐 旭东, 刘 燕玲, 金 龙, 葛 争艳, 卞 立群. 荣肝合剂对ConA诱导慢性免疫性肝损伤小鼠的影响. 胃肠病学与肝病学杂志. 2008;17:492-495. |
| 3. | Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A. J Clin Invest. 1992;90:196-203. [PubMed] [DOI] |
| 4. | Luster AD. Chemokines--chemotactic cytokines that mediate inflammation. N Engl J Med. 1998;338:436-445. [PubMed] [DOI] |
| 5. | Zeremski M, Petrovic LM, Talal AH. The role of chemokines as inflammatory mediators in chronic hepatitis C virus infection. J Viral Hepat. 2007;14:675-687. [PubMed] |
| 6. | Bonecchi R, Bianchi G, Bordignon PP, D'Ambrosio D, Lang R, Borsatti A, Sozzani S, Allavena P, Gray PA, Mantovani A. Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells (Th1s) and Th2s. J Exp Med. 1998;187:129-134. [PubMed] [DOI] |
| 9. | Mihm S, Schweyer S, Ramadori G. Expression of the chemokine IP-10 correlates with the accumulation of hepatic IFN-gamma and IL-18 mRNA in chronic hepatitis C but not in hepatitis B. J Med Virol. 2003;70:562-570. [PubMed] [DOI] |
| 10. | Zhai Y, Shen XD, Hancock WW, Gao F, Qiao B, Lassman C, Belperio JA, Strieter RM, Busuttil RW, Kupiec-Weglinski JW. CXCR3+CD4+ T cells mediate innate immune function in the pathophysiology of liver ischemia/reperfusion injury. J Immunol. 2006;176:6313-6322. [PubMed] |
| 11. | Wang J, Wang P P, Xiang G J. Relationship between the ex-pression of IP-10 and IP-10 mRNA in peripheral blood and HBV DNAlevel in patients with cirrhosis. Hepatobiliary Pancreat Dis Int. 2010;9:280-286. [PubMed] |
| 12. | Diago M, Castellano G, García-Samaniego J, Pérez C, Fernández I, Romero M, Iacono OL, García-Monzón C. Association of pretreatment serum interferon gamma inducible protein 10 levels with sustained virological response to peginterferon plus ribavirin therapy in genotype 1 infected patients with chronic hepatitis C. Gut. 2006;55:374-379. [PubMed] [DOI] |
| 13. | 史 丽云, 张 立煌, 李 明伟. 慢性乙型肝炎患者外周血淋巴细胞上CXCR3表达的初步观察. 细胞与分子免疫学杂志. 2003;19:380-382. |
| 14. | Zeremski M, Petrovic LM, Chiriboga L. Intrahepat ic levels of CX-CR 3 associat ed chemokines correlat e w it h liver inflammat ion and f ibro-sis in chronic hepat it is C. Hepatology. 2008;48:1440-1450. [PubMed] [DOI] |
| 15. | Kakimi K, Lane TE, Chisari FV, Guidotti LG. Cutting edge: Inhibition of hepatitis B virus replication by activated NK T cells does not require inflammatory cell recruitment to the liver. J Immunol. 2001;167:6701-6705. [PubMed] |
| 19. | Nomura M. 茵陈蒿汤和熊脱氧胆酸对异硫氢酸萘酯引起胆汁瘀积的协同作用. 国外医学中医中药分册. 1997;1:42. |
| 20. | Shoda J, Miura T, Utsunomiya H, Oda K, Yamamoto M, Kano M, Ikegami T, Tanaka N, Akita H, Ito K. Genipin enhances Mrp2 (Abcc2)-mediated bile formation and organic anion transport in rat liver. Hepatology. 2004;39:167-178. [PubMed] [DOI] |
| 22. | Yamashiki M, Mase A, Arai I, Huang XX, Nobori T, Nishimura A, Sakaguchi S, Inoue K. Effects of the Japanese herbal medicine 'Inchinko-to' (TJ-135) on concanavalin A-induced hepatitis in mice. Clin Sci (Lond). 2000;99:421-431. [PubMed] [DOI] |
| 23. | Yamamoto M, Ogawa K, Morita M, Fukuda K, Komatsu Y. The herbal medicine Inchin-ko-to inhibits liver cell apoptosis induced by transforming growth factor beta 1. Hepatology. 1996;23:552-559. [PubMed] |