修回日期: 2012-05-05
接受日期: 2012-06-02
在线出版日期: 2012-08-08
目的: 研究转化生长因子β1(transforming growth factor β1, TGF-β1)在腹膜转移癌与结核性腹膜炎的表达及意义.
方法: 使用免疫组织化学、Western blot方法, 从分子水平、蛋白水平检测并比较TGF-β1在20例腹膜转移癌组织及20例结核性腹膜炎组织中的表达, 比较腹膜转移癌与结核性腹膜炎表达的组间差异.
结果: 通过免疫组织化学及Western blot的实验表明, TGF-β1在腹膜转移癌与结核性腹膜炎中均有表达, 且在腹膜转移癌中的表达显著高于结核性腹膜炎(85% vs 20%; 88.01±14.41 vs 31.55±5.61; 均P<0.01).
结论: TGF-β1在腹膜病变的发生和发展过程中起到了重要的作用.
引文著录: 王四维, 王学梅, 张义侠, 陶春梅, 李银燕, 张震, 陈波. TGF-β1在腹膜转移癌与结核性腹膜炎的表达及意义. 世界华人消化杂志 2012; 20(22): 2111-2114
Revised: May 5, 2012
Accepted: June 2, 2012
Published online: August 8, 2012
AIM: To study the expression and significance of expression of transforming growth factor-β1 (TGF-β1) in tuberculous peritonitis and peritoneal carcinomatosis.
METHODS: Immunohistochemistry and Western blot were used to detect the expression of TGF-β1 in 20 cases of tuberculous peritonitis and 20 cases of peritoneal carcinomatosis. The difference in TGF-β1 expression between tuberculous peritonitis and peritoneal carcinomatosis was evaluated.
RESULTS: Immunohistochemistry and Western blot analyses showed that TGF-β1 was expressed in both tuberculous peritonitis and peritoneal carcinomatosis. The expression of TGF-β1 in peritoneal carcinomaotsis was significantly higher than that in tuberculous peritonitis (85% vs 20%; 88.01 ± 14.41 vs 31.55 ± 5.61; both P < 0.01).
CONCLUSION: TGF-β1 may play an important role in the occurrence and development of peritoneal lesions.
- Citation: Wang SW, Wang XM, Zhang YX, Tao CM, Li YY, Zhang Z, Chen B. Significance of expression of TGF-β1 in peritoneal carcinomatosis and tuberculous peritonitis. Shijie Huaren Xiaohua Zazhi 2012; 20(22): 2111-2114
- URL: https://www.wjgnet.com/1009-3079/full/v20/i22/2111.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i22.2111
腹膜是全身最大和配布最复杂、衬贴于腹、盆腔壁内面和腹、盆脏器表面的浆膜, 腹膜病变中以腹膜转移癌(peritoneal metastatic carcinoma, PMC)与结核性腹膜炎(tuberculous peritonitis, TP)最常见, 其中腹膜转移癌仍是目前造成腹腔恶性肿瘤治疗失败的主要原因[1], 此阶段患者病情发展快、预后差, 临床治疗难度大[2]. 所以明确恶性肿瘤腹膜转移的机制从而实现早期预防刻不容缓. 转化生长因子β1(transforming growth factor β1, TGF-β1)基因定位于染色体19ql3[3], 并广泛存在于正常组织细胞中, 在除成人肝细胞外的全身所有细胞和一些肿瘤细胞中表达, 参与许多生理和病理过程, 可以促进或抑制细胞增殖、调节各种组织分化和参与纤维化, 尤其是在肿瘤的发生、发展中的调节作用, 对肿瘤的研究具有极其深远的意义[4,5]. 本研究使用免疫组组织化学、Western blot免疫印迹方法, 分别从分子水平、蛋白水平检测并比较TGF-β1在40例腹膜活检组织中的表达, 探讨其表达水平与腹膜转移癌发生的相关性, 以期望揭示腹膜转移癌的发生机制, 为进一步临床预防恶性肿瘤的腹膜转移开拓新的途径.
2010-01/2010-09, 在中国医科大学附属第一医院以腹水待查入院并行腹膜穿刺活检的患者, 共40例. 病理诊断结核性腹膜炎20例, 其中男8例, 女12例, 年龄39.25岁±3.51岁; 腹膜转移癌20例, 其中男14例, 女6例, 年龄60.41岁±3.96岁. 临床症状主要为腹胀、腹痛、发热及消瘦等, 无明确心肝肾源性疾病. TGF-β1兔抗人多克隆抗体(Santa Cruz Biotechnology); 羊抗兔二抗、SP免疫组化试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司); 磷酸盐缓冲液, PBS(0.01 M, pH 7.2-7.4)(北京中杉金桥生物技术有限公司); 蛋白裂解液、蛋白酶抑制剂、上样缓冲液、BCA定量及ECL发光试剂盒(上海碧云天生物公司); β-actin(Sigma公司); 免疫印迹配胶、电泳、电转装置.
1.2.1 标本采集和处理: 穿刺前应常规检查患者的血压、心电图、凝血等指标结果, 并签署腹膜活检知情同意书. 一般选择贴近腹壁、厚度>1.5 cm的腹膜, 首先行二维扫查排除肠管等相似结构, 确定穿刺点. 所有操作均由同一名经验丰富的医师完成. 消毒穿刺点及周围皮肤, 并以1%-2%利多卡因皮下局部麻醉. 所有穿刺患者均在HITACHI HI-VISION 900型超声诊断仪的实时引导下由14G活检针配合活检枪完成, 以确保针道避开血管等结构. 每位患者取腹膜组织2-4条, 活检结束后, 随访观察患者有无术后并发症.
1.2.2 免疫组织化学染色: 免疫组织化学采用链霉素抗生物素蛋白-过氧化物酶(S-P)法, 按照试剂盒说明书进行操作: 石蜡切片脱蜡至水, 3%H2O2室温孵育, 以清除内源性过氧化物酶的活性, 抗原微波热修复, 5%-10%正常山羊血清封闭非特异性位点, 倾去血清, 滴加TGF-β1一抗工作液, 4 ℃孵育过夜, 滴加生物素标记的二抗工作液和辣根过氧化物酶标记的链酶卵白素工作液, DAB染色, 苏木素复染细胞核, 封片. 以PBS代替一抗作阴性对照.
1.2.3 Western blot免疫印迹: 将组织裂解于200 μL含有蛋白酶抑制剂(100 μg/mL PMSF, 2 μg/mL Aprotinin)的RIPA裂解液中[0.1%SDS, 1%脱氧胆酸钠, 1%Triton-100, 150 mmol/L NaCl, 1 mmol/L EDTA(pH 8.0), 10 mmol/L Tris-HCl(pH 7.5)], 4 ℃裂解1 h, 4 ℃ 15 000 r/min, 离心30 min, 取上清, 至新管. 采用brad-ford法进行蛋白定量, 按照每管50 μg/孔上样, 经SDS-PAGE凝胶进行电泳分离后, 转移至硝酸纤维素膜上, 在含50 g/L脱脂奶粉的PBS中封闭过夜. 倒掉封闭液, 用洗膜液(0.1%Tween20, 1×PBS)洗5 min. 加入用杂交液(1%BSA, 0.1%Tween20, 1×PBS)稀释的一抗分别为TGF-β1和actin, 摇床上室温杂交2 h, 用洗膜液洗3次, 每次10 min. 然后分别加入用杂交液稀释的二抗(1:5 000、1:8 000), 室温杂交1 h, 用洗膜液洗3次, 每次10 min. 吸去PVDF膜上的多余液体, 铺在LAS3000mine化学发光成像仪中, 加入等体积混合ECL试剂盒中的液体Detection reagent 1和Detection reagent 2显影, 采集图像.
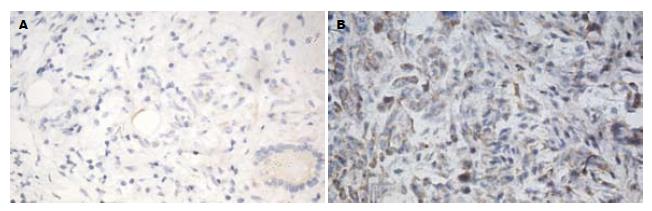
1.2.4 免疫组织化学评分标准: 每张切片400倍显微镜下随机选取5个视野. (1)阳性细胞数: 每个视野记数100个细胞, 计算5个视野的阳性细胞的平均百分数, 将平均百分数分为4分: 阳性细胞数1%-24%记为1分; 25%-49%记为2分; 50%-74%记为3分; >75%记为4分; (2)染色强度: 无着色0分; 浅黄色1分; 黄或深黄色2分; 褐或棕褐色3分, 上述两项相加为(0-7)分标准: ≥4分为高表达.
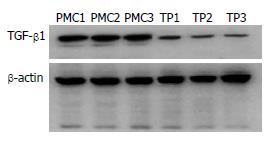
1.2.5 Western blot免疫印迹: 结果运用Quantity One软件, 根据ECL发光成像后条带和电泳条带的面积和密度计算每个条带的灰度值或吸光度.
统计学处理 采用SPSS19.0统计软件, 计量资料用mean±SD表示, 两样本均数比较采用t检验, 阳性率的比较采用χ2检验, 以P<0.01作为显著性检验水准.
TGF-β1蛋白以胞浆表达为主, 在腹膜转移癌及结核性腹膜炎的胞浆均有表达, TGF-β1在腹膜转移癌组织中高表达占85%(17/20); 在结核性腹膜炎中高表达仅占20%(4/20), 两者比较有显著统计学差异(χ2 = 16.942, P<0.01, 图1).
结核性腹膜炎组织内TGF-β1的蛋白定量为31.55±5.61(QL/pixel2), 腹膜转移癌组织内TGF-β1的蛋白定量为88.01±14.41(QL/pixel2). 腹膜转移癌组织内TGF-β1的表达显著高于结核性腹膜炎(P<0.01, 图2).
腹膜转移癌的发生多是癌细胞经血行或腹膜直接种植生长所致, 多继发于腹腔内肝、胃、结肠、胰腺和卵巢、子宫的癌肿和腹膜后的恶性肿瘤, 也可继发于肺、脑、骨骼、鼻咽部的肿瘤以及皮肤黑色素瘤等[6]. 目前国内外普遍认为肿瘤的侵袭与转移是肿瘤细胞与宿主细胞、细胞外基质之间一系列复杂的、多步骤、多因素相互作用的动态过程, 主要包括: (1)单个肿瘤细胞或细胞群必须要脱离始发的肿物进入腹腔; (2)肿瘤细胞将黏附到间皮; (3)肿瘤细胞穿透间皮单层细胞和基底膜, 进入间皮下结缔组织; (4)侵及下层的结缔组织为肿瘤增生提供支架; (5)诱导血管新生[7]. 各种分子(如黏附分子、蛋白水解酶及运动因子等)的相互作用实现了癌细胞的侵袭转移[8].
TGF-β1是一种具有多种功能的细胞因子, 可通过TGF-Smad或其他信号通路(如Ras/MEK/ERK和蛋白激酶C信号通路)参与许多生理和病理过程, 可以促进或抑制细胞增殖、调节各种组织分化和参与纤维化[9]. 在肿瘤转移过程中: 一方面腹膜间皮细胞将会纤维化, 从而为癌细胞的"登陆"腹膜创造有利条件. 2011年, Yashiro等[10]通过体外实验认为TGF-β1可能在这一过程中可以起到重要的作用; 另一方面, 在腹膜的深层包含着丰富的毛细血管网, 在生长因子的作用下还会产生新的血管, 在慢性炎症和恶性肿瘤存在的情况下, 相关血管生长因子水平的上调使新血管的生成与抑制失衡, 导致血管大量形成[11], TGF-β1和血管内皮生长因子的表达呈正相关, 表明TGF-β1刺激肿瘤血管生成的作用可通过旁分泌途径诱导血管内皮生长因子的表达, 间接地刺激肿瘤血管的生成, 同时血管内皮生长因子对TGF-β1也有类似作用, 二者共同促进血管的生成[12].
本研究对TGF-β1在腹膜转移癌及结核性腹膜炎组织中表达进行了研究, 通过免疫组化发现: TGF-β1在结核性腹膜炎组织中仅少量表达于结核结节周围; 而在腹膜转移癌组织中, 他则呈现明显的弥漫性的高表达. 同时应用Western blot的方法进一步从基因和蛋白的水平上发现了相同的趋势. 这一结果一方面证实了腹膜转移癌血管新生的程度要显著高于结核性腹膜炎, 另一方面也表明腹膜转移癌组织呈现弥漫的纤维化, 而结核性腹膜炎则仅在结核结节周围较明显, 这也与二者的病理基础相符: 结核性腹膜炎的病理基础为腹膜组织的肉芽组织形成与干酪样坏死; 腹膜转移癌则为肿瘤细胞弥漫种植于腹膜表面, 生长繁殖, 被腹膜的结缔组织所包绕形成大小不等的转移结节. 因此我们可以认为TGF-β1在恶性肿瘤腹膜转移时会对这一进程起到重要的促进作用.
TGF-β1可依赖多条信号通路发挥作用, 主要有Smads依赖和非Smads依赖性的信号通路[13], 有学者认为TGF-β1在腹膜转移癌中的作用主要是通过磷酸化Smad2, 3来实现的[14], 也有大量文献报道TGF-β1是通过非经典型信号通路诱导肿瘤转移和浸润[15]. 所以TGF-β1在恶性肿瘤细胞的腹膜转移过程中通过什么途径来起作用, 还需要人们进一步的研究和验证.
总之, 恶性肿瘤腹膜转移的发生发展过程, 包括腹膜纤维化及肿瘤血管生成等一系列改变, 其分子机制的改变是这诸多改变的基础, 而TGF-β1是这其中的重要调节因子, 为今后进一步完善恶性肿瘤腹膜转移的分子机制奠定了基础.
腹膜转移癌是目前造成腹腔恶性肿瘤治疗失败的主要原因, 此阶段的患者病情发展快、预后差, 临床治疗难度大, 所以明确恶性肿瘤腹膜转移的机制丛而实现早期预防刻不容缓.
毛高平, 教授, 中国人民解放军空军总医院
目前普遍认为肿瘤的侵袭与转移是肿瘤细胞与宿主细胞、细胞外基质之间一系列复杂的、多步骤、多因素相互作用的动态过程, 但各个步骤的具体影响因素还有待进一步研究.
Lv等通过体外实验认为TGF-β1可能在纤维化过程中可以起到重要的作用, 这一研究结果从很大程度上表明了TGF-β1为癌细胞的"登陆"腹膜创造极其有利的条件.
TGF-β1在腹膜组织中的高表达, 说明病变腹膜组织的纤维化及血管增生, 高度提示恶性转移可能.
TGF-β1在腹膜转移癌组织中的表达高于结核性腹膜炎组织, 提示TGF-β1表达在腹膜转移癌的发生发展中具有重要作用.
本文选题结合临床, 结果对临床理解腹膜转移癌的分子机制具有一定意义, 有一定的新颖性, 文章写作较流畅, 具有一定的临床参考意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Tamsma J. The pathogenesis of malignant ascites. Cancer Treat Res. 2007;134:109-118. [PubMed] |
| 2. | Yang XJ, Li Y, al-shammaa Hassan AH, Yang GL, Liu SY, Lu YL, Zhang JW, Yonemura Y. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival in selected patients with peritoneal carcinomatosis from abdominal and pelvic malignancies: results of 21 cases. Ann Surg Oncol. 2009;16:345-351. [PubMed] [DOI] |
| 3. | Massagué J. The transforming growth factor-beta family. Annu Rev Cell Biol. 1990;6:597-641. [PubMed] [DOI] |
| 4. | Margetts PJ, Kolb M, Galt T, Hoff CM, Shockley TR, Gauldie J. Gene transfer of transforming growth factor-beta1 to the rat peritoneum: effects on membrane function. J Am Soc Nephrol. 2001;12:2029-2039. [PubMed] |
| 5. | Itoh S, Itoh F. Implication of TGF-β as a survival factor during tumor development. J Biochem. 2012; May 2. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Shi M, Zhu J, Wang R, Chen X, Mi L, Walz T, Springer TA. Latent TGF-β structure and activation. Nature. 2011;474:343-349. [PubMed] [DOI] |
| 7. | Spalding DR, Williamson RC. Peritonitis. Br J Hosp Med (Lond). 2008;69:M12-M15. [PubMed] |
| 8. | Jayne D. Molecular biology of peritoneal carcinomatosis. Cancer Treat Res. 2007;134:21-33. [PubMed] |
| 9. | Shiozaki H, Doki Y, Tamura S, Monden M. [Molecular mechanism of carcinogenesis in gastric cancer: Intercellular molecule cadherin and catenin]. Nihon Rinsho. 2001;59 Suppl 4:88-93. [PubMed] |
| 10. | Yashiro M, Chung YS, Nishimura S, Inoue T, Sowa M. Fibrosis in the peritoneum induced by scirrhous gastric cancer cells may act as "soil" for peritoneal dissemination. Cancer. 1996;77:1668-1675. [PubMed] [DOI] |
| 11. | Lv ZD, Na D, Ma XY, Zhao C, Zhao WJ, Xu HM. Human peritoneal mesothelial cell transformation into myofibroblasts in response to TGF-ß1 in vitro. Int J Mol Med. 2011;27:187-193. [PubMed] |
| 12. | Thurston G, Kitajewski J. VEGF and Delta-Notch: interacting signalling pathways in tumour angiogenesis. Br J Cancer. 2008;99:1204-1209. [PubMed] [DOI] |
| 13. | Araújo FA, Rocha MA, Mendes JB, Andrade SP. Atorvastatin inhibits inflammatory angiogenesis in mice through down regulation of VEGF, TNF-alpha and TGF-beta1. Biomed Pharmacother. 2010;64:29-34. [PubMed] [DOI] |
| 14. | Yáñez-Mó M, Lara-Pezzi E, Selgas R, Ramírez-Huesca M, Domínguez-Jiménez C, Jiménez-Heffernan JA, Aguilera A, Sánchez-Tomero JA, Bajo MA, Alvarez V. Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells. N Engl J Med. 2003;348:403-413. [PubMed] [DOI] |
| 15. | Giehl K, Imamichi Y, Menke A. Smad4-independent TGF-beta signaling in tumor cell migration. Cells Tissues Organs. 2007;185:123-130. [PubMed] [DOI] |