修回日期: 2012-06-26
接受日期: 2012-07-20
在线出版日期: 2012-08-08
目的: 建立大鼠结肠上皮细胞的原代培养方法, 为结肠上皮形态及功能研究提供理想的细胞模型.
方法: 采用6-15日龄乳鼠, 取结肠剪碎、反复清洗后, 弃上清, 加10 mL、0.1%Ⅰ型胶原酶和透明质酸酶联合配制的消化液, 37 ℃消化25 min, 分离上皮细胞团; 吹打消化液, 取上清, 加入培养基重悬反复离心3次后, 细胞沉淀接种于含100 mL/L胎牛血清的完全培养基中, 37 ℃、50 mL/L CO2细胞培养箱中培养. 采用差速贴壁法及相差消化法去除成纤维细胞, 细胞贴壁长满瓶80%-90%后用2.5 g/L的胰酶消化液消化并传代.
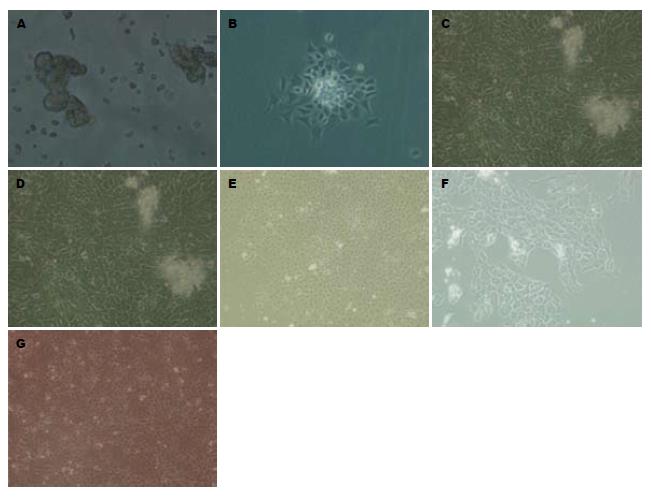
结果: 成功分离结肠上皮细胞团且活力较高. 24 h后可见部分细胞团贴壁, 贴壁细胞为多角形, 4-8 d逐渐融合成片, 呈现明显的"铺路石"样. 细胞经传代处理后成纤维细胞明显减少. 免疫荧光染色及透射电镜观察鉴定为上皮细胞. 冻存处理复苏后细胞状态较佳.
结论: 通过该法可建立较稳定的大鼠结肠上皮细胞原代培养体系, 为结肠上皮生理、病理及药物作用机制提供了体外研究平台.
引文著录: 祁燕, 李燕舞, 王汝俊, 唐立海, 米红. 大鼠结肠上皮细胞分离及培养方法的建立. 世界华人消化杂志 2012; 20(22): 2030-2035
Revised: June 26, 2012
Accepted: July 20, 2012
Published online: August 8, 2012
AIM: To establish a method for isolation and primary culture of rat colonic epithelial cells which can be used as an ideal cell model for the study of colonic epithelial morphology and function in vitro.
METHODS: Colons obtained from suckling rats (6-15 d) were cut into small pieces, washed, and digested with 0.1% collagenase I and hyaluronidase for 25 min at 37 ℃ to separate colonic epithelial cell clusters. After digestion, the supernatant was transferred into a new tube and DMEM medium was added. After centrifuging 3 times, cells were cultured in DMEM solution containing 100 mL/L fetal bovine serum in a CO2 incubator with a saturated humidity at 37 ℃. Fibroblasts were removed using phase difference digestion and adherence. When 80%-90% of the cells were adherent to culture plates, cells were passaged by trypsin digestion.
RESULTS: Colonic epithelial cell clusters were successfully obtained, which showed high viability and became adherent after 24 hours of culture. The cells were typically polygonal in shape and grew into pavestone-like monolayers gradually in 4-8 days, showing excellent proliferative ability. Fibroblasts were significantly decreased after several passages. The colonic epithelial cells were identified by the ways of immunofluorescence staining and TEM observation. The cells were in good condition after being frozen and thawed.
CONCLUSION: The above mentioned method allows establishing stable primary colonic epithelial cell lines, which could provide an in vitro platform for the study of colonic epithelial physiology and pathology.
- Citation: Qi Y, Li YW, Wang RJ, Tang LH, Mi H. Establishment of a method for isolation and primary culture of rat colonic epithelial cells. Shijie Huaren Xiaohua Zazhi 2012; 20(22): 2030-2035
- URL: https://www.wjgnet.com/1009-3079/full/v20/i22/2030.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i22.2030
结肠上皮细胞是结肠黏膜屏障的主要结构基础, 是内外信息传导的重要组成部分, 能分泌多种细胞因子, 促进结肠黏膜损伤后的修复及促进免疫耐受. 结肠上皮细胞受损及功能的缺失会导致多种疾病的产生. 目前, 对肠上皮细胞的离体实验研究多采用细胞株进行[1-5], 如: colorectal cancer cell line(Caco2)、human colon adenocarcinoma(HT-29)、intestinal epithelial cells(IEC-6)等, 这些细胞株或来源于肿瘤细胞, 或经过永生化处理, 在形态及功能方面和正常结肠上皮细胞存在差异, 不利于机体生理病理反应及药物作用的分析. 原代细胞具有直接来源于机体组织, 生物性状尚未发生变化的优势, 然而分离培养技术是一个难题, 限制了其应用. 因此, 建立可靠稳定的结肠上皮细胞原代培养方法, 在一定周期内使之成为研究结肠上皮生理和病理机制的实验平台, 对结肠疾病的病机及防治研究具有重要意义. 本实验室在参考国内外文献的基础上, 建立了较稳定的大鼠结肠上皮细胞原代培养方法.
出生6-15日龄SD大鼠, 购自广东省实验动物中心, 许可证号SCXK(粤)2008-0002, 每次培养取5只新生乳鼠, 雌雄均可. DMEM高糖培养基(Gibco), 重组人表皮生长因子(PeproTech), 肝素钠(Sigma), 胰岛素(Sigma), 牛垂体提取物(Gibco), 透明质酸酶(Sigma), Ⅰ型胶原酶(Gibco), 兔抗大鼠多克隆角蛋白CK-20抗体(Bioworld). 3110 Series Ⅱ二氧化碳培养箱(美国thermo公司), HITACHI H-600电子显微镜(日本日立)TH4-200型荧光倒置显微镜(日本OLYMPUS).
1.2.1 完全培养基配制[6,7]: DMEM高糖培养基添加100 mL/L胎牛血清, 10 μg/L重组人表皮生长因子, 100 mg/L肝素钠, 青、链霉素混合液, 200 U/L胰岛素, 5 mg/L牛垂体提取物, 混匀后4 ℃保存. 酶消化液: 透明质酸酶及Ⅰ型胶原酶混合配制, 终浓度为0.1%, 现用现配.
1.2.2 大鼠结肠上皮细胞分离、培养及传代: 参照翟荣林和叶章群等[8,9]的方法并加以改进. 取6-15日龄乳鼠5只, 脱颈椎处死, 无菌条件下取出结肠, 置于培养皿中去除肠系膜, 纵向剖开结肠去除肠内容物, 清洗液反复清洗结肠组织并剪碎成约1 mm3大小的组织块, 转移至50 mL离心管中, 反复吹打清洗至澄清, 吸弃上清, 再加入适量清洗液室温静置30 min; 弃上清, 加10 mL酶消化液, 37 ℃水浴震荡消化25 min; 消化完毕吸管反复吹打5 min, 见消化液变浑浊, 室温静置1 min; 取上清, 加等量培养基于上清中, 1 000 r/min离心5 min, 弃上清, 沉淀加10 mL培养基重悬后同速离心; 如此重复3次后, 沉淀加适量培养基重悬, 台盼蓝染色, 光镜下观察细胞活力并计数后, 适当浓度接种于25 cm2细胞培养瓶, 37 ℃、50 mL/L CO2培养箱中培养. 90 min后吸出未贴壁的细胞及培养基转移至另1培养瓶中, 于第1瓶培养瓶中添加培养基后, 2瓶均放回培养箱继续培养, 约第5-6天见大量细胞贴壁后更换培养液. 约10 d细胞贴壁长满瓶80%-90%. 传代时加入0.25%胰酶消化, 光镜下观察到成纤维细胞快速收缩变圆飘起时, 倒弃消化液, 并用PBS清洗培养瓶后, 加入0.25%胰酶再次消化后传代接种于新培养瓶. 此过程进一步去除成纤维细胞[10]. 光镜下观察细胞形态及生长状态.
1.2.3 大鼠结肠上皮细胞鉴定: (1)免疫荧光染色法鉴定[7,11,12]: CK-20是肠上皮细胞表面特异性标记物之一, 本实验采用免疫荧光化学法鉴定结肠上皮细胞. 将结肠上皮细胞接种在6孔板中培养爬片, 待玻片铺满细胞后取出, PBS洗细胞爬片3次, 中性甲醛固定30 min, 免疫组织化学笔画圈. PBS洗涤3次, 加入2 g/L Triton X-100作用15 min, 山羊血清封闭30 min, 滴加兔抗大鼠多克隆角蛋白CK20抗体(1:50)稀释, 4 ℃过夜. PBS洗涤3次, 加入二抗为生物素化羊抗兔IgG, 室温孵育2 h后, 加荧光标记SABC-Cy3室温避光孵育1 h, PBS洗涤3次, DAPI避光染色15 min, PBS洗涤3次, 缓冲甘油封片, 荧光显微镜观察; (2)透射电镜观察[13,14]: 常规消化收集细胞, 高速离心, 弃尽上清, 加入2.5%戊二醛, 固定管底细胞团块, 24 h后移入磷酸盐缓冲液(pH 7.2)中漂洗2次, 每次10 min, 再将标本置于1%锇酸溶液中后固定1-2 h, 以前法漂洗后, 乙醇、丙酮梯度脱水, 100%丙酮、环氧树脂Epon812包埋剂置换40 min, 包埋、超薄切片机切片、染色后透射电镜观察并拍照(×5 000).
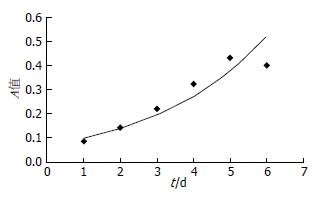
1.2.4 大鼠结肠上皮细胞生长曲线: 采用MTT法建立原代结肠上皮细胞生长曲线[15,16]. 取第2代原代培养的结肠上皮细胞, 以2×104/mL的密度接种于96孔板中, 每孔200 μL, 5个平行复孔. 同时设不含细胞的空白对照孔, 在37 ℃、50 mL/L CO2培养箱中分别培养24、48、72、96、120、144 h后, 弃原培养基, 更换不含血清培养基180 μL并每孔加入5 g/L MTT溶液20 μL, 37 ℃继续孵育4 h后, 小心吸弃孔内培养上清液, 每孔加入150 μL二甲基亚砜, 室温振荡10 min使结晶物充分溶解. 在570 nm波长, 酶联免疫检测仪上测定各孔吸光度(A)值, 记录结果. 以时间为横轴, 细胞孔测定A平均值减空白孔测定A平均值为纵轴绘制细胞生长曲线.
采用Ⅰ型胶原酶和透明质酸酶联合消化分离大鼠结肠上皮细胞, 光镜下观察可见分离的单个细胞及细胞团透亮, 细胞活力较高; 24 h后可见部分细胞团贴壁生长; 4-8 d形成小片状集落, 并逐渐融合成片, 细胞多呈明显的"铺路石"样, 也可见细胞多角形或短梭形, 细胞界限清晰, 胞浆丰富, 胞核较大, 核仁1-2个, 部分可见成纤维细胞和上皮细胞夹杂生长. 第1代细胞经传代纯化处理后上皮细胞纯度大为提高, 细胞以1:2传至第2代时仍然生长良好, 传代后的细胞贴壁生长较快, 第6天即可贴壁长满培养瓶80%-90%; 第2代细胞经冻存、复苏后, 细胞状态较佳, 形态规则, 次日细胞即大量贴壁生长(图1).
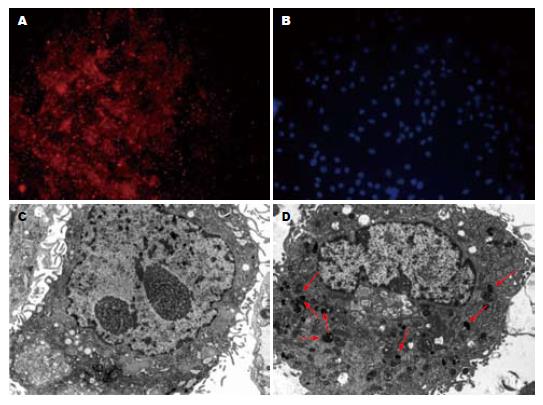
2.2.1 免疫荧光鉴定: 通过免疫荧光染色, 采用荧光显微镜观察, 绝大多数细胞胞浆呈现出亮红色荧光, 为细胞角蛋白表达阳性的上皮细胞, 胞核呈现蓝色荧光(图2).
2.2.2 电镜观察: 透射电镜下观察可见细胞表面有丰富细长微绒毛, 胞质丰富, 胞质内细胞器较丰富, 可见内质网、线粒体、核糖体, 并有高、中等电子密度分泌颗粒(图2).
2.2.3 结肠上皮细胞生长曲线: 细胞接种后2-5 d处于指数增生期, 第6天开始细胞增殖基本处于停滞状态. 提示细胞接种后2-5 d是一代细胞活性最好的阶段, 是进行各种实验的最佳时机(图3).
在对肠道上皮细胞的分离培养研究中, 目前多集中在小肠上皮细胞的培养方面[17-19], 结肠上皮细胞的分离培养报道相对较少[20,21]. 本实验室参考国内外文献, 建立了较为稳定的大鼠结肠上皮细胞原代培养体系. 有以下方面值得注意.
首先, 动物的选择. 采用出生6-15日龄乳鼠, 此时为肠上皮细胞发育早期, 上皮细胞主要为干细胞和短暂分裂细胞, 细胞较易贴壁、增殖生长[22]; 出生6 d的大鼠已形成钝绒毛, 隐窝尚未发育好, 在联合酶消化后再轻轻吹打, 即可释放大量的绒毛隐窝单位[23], 且由于肠腔内微生物相对较少, 可减少细胞消化分离过程中微生物的污染. 在本研究的前期试验中, 我们也采用了成年大鼠结肠进行分离培养, 但细胞贴壁较慢, 状态欠佳, 在培养过程中, 细胞逐渐崩解为碎片, 死亡.
第二, 消化酶的选择. 分离肠上皮细胞多选用的酶有嗜热菌蛋白酶、中性蛋白酶、胶原酶、透明质酸酶等. 不同酶单一或者联合运用, 经过不同的消化时间, 均能达到不同的分离效果. 此外, 也有报道用DTT及EDTA处理获取肠上皮细胞团[24]. 胶原酶作用温和, 且能抑制成纤维细胞的生长, 因此在肠上皮细胞的分离中常和不同的酶联合运用, 可分离获取较多肠上皮细胞团[25-27]. 本实验室采用Ⅰ型胶原酶和透明质酸酶联合37 ℃震荡消化25 min后, 通过反复吹打从而促进上皮细胞团从组织脱离; 同时利用重复静置沉降、离心等步骤, 有利于去除组织及细胞碎片获得大量活力较好的单个细胞或细胞团.
第三, 上皮细胞的生长. 肠腔对外开放且富含微生物, 细胞分离及培养过程中一定要避免污染. 取材时, 要用含双抗的清洗液反复冲洗结肠组织, 直至上清液澄清, 整个操作过程在超净台内进行. 上皮细胞贴壁生长对培养基底物要求甚高, 使用适当的细胞黏附基质是促进其体外增殖和保持分化特性的重要因素. 多聚赖氨酸、Ⅰ型鼠尾胶原常用来包被细胞培养瓶或皿以促进上皮细胞的贴壁生长. 在实验中, 我们采用了含200 mL/L血清的培养基留置培养瓶于培养箱中, 使用时倒弃培养基. 细胞接种后也可促进上皮细胞贴壁生长, 且操作相对其他包被方式简单. 培养基的质量及成分是促进上皮细胞生长的关键因素, 在含100 mL/L胎牛血清的基础培养基中添加表皮生长因子、胰岛素、牛垂体提取物, 可协同促进细胞有丝分裂从而促进上皮细胞的增殖, 添加肝素可抑制平滑肌样细胞的生长. 经过原代培养期、传代培养期的观察, 发现大鼠(乳鼠)结肠上皮细胞体外培养并传代, 这可能与培养基中添加了各种有利于促进上皮细胞生长增殖的营养物质有关. 同时在细胞培养传代操作中动作轻缓, 尽量减少吹打或其他操作对细胞的损伤. 对细胞的原代培养至第1次传代前可持续2 wk. 培养细胞的一代生存期为6 d左右, 其中2-5 d为细胞指数增殖期, 是进行各种实验的最佳时期.
第四, 上皮细胞的纯化. 在上皮细胞的培养中常存在成纤维细胞的混杂, 因此纯化过程是上皮细胞培养中的关键环节. 首先, 我们在接种细胞90 min后, 将原瓶培养基及未贴壁细胞转移至另1培养瓶; 成纤维细胞和上皮细胞对酶的耐受性有差异, 在细胞传代时, 采用胰酶消化, 镜下见细胞收缩后, 立即终止消化, PBS清洗培养瓶后, 加入胰酶再次消化后传代接种于新培养瓶. 经上述步骤处理后, 可显著减少成纤维细胞, 上皮细胞出现铺路石样生长. 实验中我们发现, 当第1代细胞培养瓶中存在适量成纤维细胞时, 上皮细胞的贴壁生长相对较快, 且上皮细胞多在成纤维细胞周围贴壁生长, 可见成纤维细胞的存在可促进上皮细胞的增殖生长. 这和肠细胞培养的相关报道一致[28]. 其原因在于基质中的成纤维细胞能分泌一种基质成纤维细胞因子, 他能特异性促进角膜上皮细胞DNA的起始合成和细胞增生, 并提供上皮基底细胞贴附和分化的物理底物如胶原和纤黏素等[29]. 同时我们对90 min后转瓶的细胞和不转瓶的细胞进行比较, 发现转瓶后成纤维细胞量明显较少, 原瓶中也见上皮细胞贴壁生长. 传代后的细胞在生长过程, 形态不一, 或大或小、或呈多角形、或呈短梭形, 提示上皮隐窝干细胞可分化为不同的结肠上皮, 更有利于反应机体的生理性状.
第五, 上皮细胞的冻存、复苏. 在培养过程中细胞传至第2代时对细胞进行冻存处理, 以观察细胞复苏后细胞生长状态及活力. 复苏后第2天即可看到细胞贴壁生长, 且状态较佳. 在整个细胞培养过程中细胞生长周期已超过1 mo. 这可能与乳鼠细胞增殖分化能力强, 且培养基中含有能促进及维持上皮细胞生长的多种生长因子相关. 原代结肠上皮细胞冻存、复苏的成功为后续的相关实验研究提供较好的基础.
总之, 大鼠结肠上皮细胞原代培养方法的建立及其传代培养为结肠上皮屏障功能及药物作用机制的研究提供了较好的平台. 原代结肠上皮细胞来源于体内组织, 更能真实反应机体生理和病理变化, 对结肠疾病的病机及防治研究具有重要意义. 该培养方法仍需不断完善和优化, 为后续开展是否能继续传代及其活力和功能研究, 以及多细胞共培养及结肠上皮形态、功能研究提供基础.
细胞模型是研究结肠黏膜生理及病理的重要手段, 目前研究采用的细胞株在形态及功能方面和正常结肠上皮细胞存在差异, 不利于机体生理病理反应及药物作用的分析.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
原代结肠上皮细胞培养体系的建立是结肠黏膜相关研究的基础, 也是一个难题. 建立可靠稳定的结肠上皮细胞原代培养方法, 在一定周期内使之成为研究结肠上皮生理和病理机制的实验平台, 对结肠疾病的病机及防治研究具有重要意义.
在对肠道上皮细胞的分离培养研究中, 目前多集中在小肠上皮细胞的培养方面, 结肠上皮细胞的分离培养报道相对较少. 翟荣林等采用嗜热菌蛋白酶法分离大鼠结肠上皮细胞并培养, 但未见细胞传代及后续报道.
本实验室建立了较稳定的大鼠结肠上皮细胞培养方法, 并从动物、消化酶的选择,细胞纯化、鉴定、生长及传代, 细胞冻存及复苏等多个方面进行了探讨, 结果可靠.
大鼠结肠上皮细胞原代培养方法的建立及其传代培养为结肠上皮屏障功能及药物作用机制的研究提供了较好的平台. 原代结肠上皮细胞来源于体内组织, 更能真实反应机体生理和病理变化, 对结肠疾病的病机及防治研究具有重要意义.
本研究设计严谨合理, 科学性强, 结果可靠, 结论恰当, 讨论内容丰富, 条理清晰, 对研究工作有较好的参考价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Degagné E, Grbic DM, Dupuis AA, Lavoie EG, Langlois C, Jain N, Weisman GA, Sévigny J, Gendron FP. P2Y2 receptor transcription is increased by NF-kappa B and stimulates cyclooxygenase-2 expression and PGE2 released by intestinal epithelial cells. J Immunol. 2009;183:4521-4529. [PubMed] [DOI] |
| 2. | Duary RK, Rajput YS, Batish VK, Grover S. Assessing the adhesion of putative indigenous probiotic lactobacilli to human colonic epithelial cells. Indian J Med Res. 2011;134:664-671. [PubMed] [DOI] |
| 3. | Gao Q, Qi L, Wu T, Wang J. An important role of interleukin-10 in counteracting excessive immune response in HT-29 cells exposed to Clostridium butyricum. BMC Microbiol. 2012;12:100. [PubMed] [DOI] |
| 4. | Iizuka M, Sasaki K, Hirai Y, Shindo K, Konno S, Itou H, Ohshima S, Horie Y, Watanabe S. Morphogenic protein epimorphin protects intestinal epithelial cells from oxidative stress by the activation of EGF receptor and MEK/ERK, PI3 kinase/Akt signals. Am J Physiol Gastrointest Liver Physiol. 2007;292:G39-G52. [PubMed] [DOI] |
| 5. | Vermeulen MA, de Jong J, Vaessen MJ, van Leeuwen PA, Houdijk AP. Glutamate reduces experimental intestinal hyperpermeability and facilitates glutamine support of gut integrity. World J Gastroenterol. 2011;17:1569-1573. [PubMed] [DOI] |
| 7. | 郝 维平, 姚 友生, 王 家伟, 邓 毕华, 吕 夷松. 人类膀胱移行上皮细胞的体外培养与鉴定. 中国组织工程研究与临床康复. 2011;15:9348-9352. |
| 9. | 叶 章群, 刘 冠琳, 陈 志强, 孔 德波, 姚 林方, 余 虓, 郭 辉. 小鼠肠干细胞群的构建. 华中科技大学学报(医学版). 2006;35:828-830. |
| 12. | Ren HJ, Cui J, Wang ZQ, Liu RD. Normal mouse intestinal epithelial cells as a model for the in vitro invasion of Trichinella spiralis infective larvae. PLoS One. 2011;6:e27010. [PubMed] [DOI] |
| 14. | Birkner S, Weber S, Dohle A, Schmahl G, Föllmann W. Growth and characterisation of primary bovine colon epithelial cells in vitro. Altern Lab Anim. 2004;32:555-571. [PubMed] |
| 18. | Aldhous MC, Shmakov AN, Bode J, Ghosh S. Characterization of conditions for the primary culture of human small intestinal epithelial cells. Clin Exp Immunol. 2001;125:32-40. [PubMed] [DOI] |
| 20. | Hofmann C, Lippert E, Falk W, Schölmerich J, Rogler G, Obermeier F. Primary human colonic epithelial cells are transiently protected from anoikis by a Src-dependent mechanism. Biochem Biophys Res Commun. 2009;390:908-914. [PubMed] [DOI] |
| 21. | Pedersen G, Saermark T, Giese B, Hansen A, Drag B, Brynskov J. A simple method to establish short-term cultures of normal human colonic epithelial cells from endoscopic biopsy specimens. Comparison of isolation methods, assessment of viability and metabolic activity. Scand J Gastroenterol. 2000;35:772-780. [PubMed] [DOI] |
| 22. | Slorach EM, Campbell FC, Dorin JR. A mouse model of intestinal stem cell function and regeneration. J Cell Sci. 1999;112:3029-3038. [PubMed] |
| 24. | Grossmann J, Walther K, Artinger M, Kiessling S, Steinkamp M, Schmautz WK, Stadler F, Bataille F, Schultz M, Schölmerich J. Progress on isolation and short-term ex-vivo culture of highly purified non-apoptotic human intestinal epithelial cells (IEC). Eur J Cell Biol. 2003;82:262-270. [PubMed] [DOI] |
| 26. | Evans GS, Flint N, Somers AS, Eyden B, Potten CS. The development of a method for the preparation of rat intestinal epithelial cell primary cultures. J Cell Sci. 1992;101:219-231. [PubMed] |
| 27. | Föllmann W, Weber S, Birkner S. Primary cell cultures of bovine colon epithelium: isolation and cell culture of colonocytes. Toxicol In Vitro. 2000;14:435-445. [PubMed] [DOI] |
| 28. | Furuya K, Sokabe M, Furuya S. Characteristics of subepithelial fibroblasts as a mechano-sensor in the intestine: cell-shape-dependent ATP release and P2Y1 signaling. J Cell Sci. 2005;118:3289-3304. [PubMed] [DOI] |