修回日期: 2012-06-30
接受日期: 2012-07-20
在线出版日期: 2012-07-28
目的: 探讨外周静脉血中CK20 mRNA表达及其与结直肠癌临床病理及预后的关系.
方法: 选取结直肠癌术前患者61例、健康志愿者20例和结直肠息肉患者10例, 采用RT-PCR法检测其外周静脉血中CK20 mRNA的表达, 并结合其临床病理特点和随访资料进行综合分析.
结果: 61例结直肠癌患者术前外周血CK20 mRNA阳性率为41.0%(25/61); 其表达与肿瘤TNM分期、浸润深度、远处转移和区域淋巴结转移有关(P<0.05). 20例健康志愿者和10例结直肠息肉患者外周血均无CK20 mRNA表达. 在61例结直肠癌患者中, 术后46 mo完整随访的有37例, 其中有17例死亡, 有10例外周血CK20 mRNA表达阳性.
结论: 外周静脉血中CK20 mRNA的表达与结直肠癌患者的肿瘤分期和浸润转移有关. 血液中CK20是反映结直肠癌患者发生肿瘤微转移较为特异的肿瘤标志物, 外周血液中CK20 mRNA的表达可作为评估患者预后的指标.
引文著录: 李国胜, 颜登国, 张汝一, 甄运寰, 姬清华, 程海玉. 外周血CK20 mRNA表达与结直肠癌临床病理和预后的关系. 世界华人消化杂志 2012; 20(21): 1993-1997
Revised: June 30, 2012
Accepted: July 20, 2012
Published online: July 28, 2012
AIM: To investigate the clinical significance of cytokeratin 20 (CK20) mRNA expression in peripheral venous blood of patients with colorectal carcinoma.
METHODS: The expression of CK20 mRNA was detected by RT-PCR in peripheral venous blood samples from 20 healthy volunteers, 10 patients with colorectal polyps, and 61 patients with colorectal cancer.
RESULTS: The positive rate of CK20 mRNA in peripheral venous blood of patients with colorectal cancer was 41.0% (25/61). CK20 mRNA expression in peripheral venous blood was associated with TNM stage, local lymph node metastasis, distant metastasis, and depth of invasion (all P < 0.05). The expression of CK20 mRNA was not detected in peripheral venous blood of healthy volunteers and patients with colorectal polyps. Seventeen cases died during the follow-up period, of whom 10 had positive expression of CK20 in peripheral blood.
CONCLUSION: CK20 is a specific marker for blood micrometastasis of colorectal cancer. The expression of CK20 mRNA in the blood of patients with colorectal cancer is related with the invasion and metastasis of colorectal cancer. Detection of CK20 mRNA in peripheral blood seems to be of relevance for prognosis in colorectal cancer.
- Citation: Li GS, Yan DG, Zhang RY, Zhen YH, Ji QH, Cheng HY. Correlation between expression of CK20 mRNA in peripheral blood and clinicopathological features and prognosis in patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1993-1997
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1993.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1993
结直肠癌是最常见的消化系恶性肿瘤之一, 且发病率呈逐年上升的趋势[1]. 虽然目前临床上对结直肠癌采取了规范的综合性治疗措施, 但其死亡率仍居恶性肿瘤的前列. 部分结直肠癌患者预后不佳的一个重要原因是: 患者在获得诊断、接受综合性治疗之前, 肿瘤经血行途径已发生了广泛的微转移[2]. 目前临床上尚缺乏一种能够在疾病早期即可有效判定结直肠癌微转移, 进而预测结直肠癌患者预后的外周血检测指标. 研究发现[3-6]: 细胞角蛋白20(cytokeratin 20, CK20)具有严格的上皮组织特异性, 其在癌变的上皮组织以及转移灶中均有表达, 而在正常血液、淋巴结及骨髓中均为阴性. 因此, 外周血中CK20 mRNA的表达状况可能成为一个预示结直肠癌发生血行微转移和预后不良的重要指标. 本研究采用RT-PCR技术检测结直肠癌患者外周静脉血中CK20 mRNA的表达, 旨在探讨外周血中CK20 mRNA表达与结直肠癌临床病理特征和预后的关系, 这有助于为结直肠癌的预后判断提供客观的参考指标.
随机选取2006-08/2007-01贵阳医学院附属医院肛肠外科收治的结直肠癌患者61例组成实验组, 所有病例均经组织学确诊, 且未接受放化疗治疗. 选取同期在门诊体检的20例健康志愿者组成阴性对照组, 选取在门诊行结肠镜检查并且组织学证实为腺瘤性息肉的10例结直肠息肉患者组成阳性对照组. 41例直肠癌患者分别行Dixon术27例、Miles术8例、Dixon术+肝转移灶切除1例、肿瘤姑息性切除术1例和单纯乙状结肠造口4例. 20例结肠癌患者分别行乙状结肠癌根治术8例、根治性右半结肠切除术8例和癌灶姑息性切除术4例.
1.2.1 标本采集和制备: 分别采取结直肠癌术前患者61例、结直肠息肉患者10例和健康志愿者20例的肘前静脉血 5 mL采用红细胞溶解法分离有核细胞[6], 将标本在室温下7 000 g离心5 min, 弃上清液. 加入5倍体积的生理盐水混匀; 室温下7 000 g离心5 min, 弃上清液. 加入5倍体积的双蒸水混匀, 静置5 min, 室温下10 000 g离心10 min. 弃去上层溶解的红细胞, 保留下层2 mL液体. 加入5倍体积的双蒸水混匀, 室温下10 000 g离心10 min, 去上清液. 采用异硫氰酸胍法提取RNA. 紫外分光光度计测定总RNA浓度, A260/A280比值在1.7-2.0之间, 用1.5%琼脂糖凝胶电泳检测总RNA质量. 总RNA于-80 ℃保存备用.
1.2.2 RT-PCR检测CK20 mRNA的表达: 总RNA在20 μL反应体系中逆转录成cDNA. 反应体系组成如下: dNTPs 2 μL, 5×RNA PCR缓冲剂4 μL, RNA酶抑制剂1 μL, AMV逆转录酶XL 1 μL, Oligo d(T)-Adaptor引物1 μL(2.5 pmol/μL), 总RNA 5 μL, RNase Free H2O 6 μL.
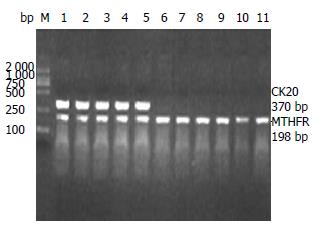
逆转录反应条件: 70 ℃反应5 min, 4 ℃反应5 min. 取出加入M-MuLV RT 1 μL, 42 ℃孵育60 min, 70 ℃加热10 min灭活逆转录酶, 4 ℃结束反应. 取上述逆转录反应产物于25 L反应体系中进行PCR反应. 反应体系如下: 5×PCR缓冲剂5 μL, RT反应液5 μL, dNTP 2.0 μL, Taq DNA多聚酶0.2 μL, 上下游引物各1 μL, ddH2O 10.8 μL. CK20引物序列[6]: 上游引物5'-CAGACACACGGTGAACTATGG-3', 下游引物5'-GATCAGCTTCCACTGTTAGACG-3', 扩增片段长度为370 bp. 内参照MTHFR引物序列[6]: 上游引物5'-TGAAGGAGAAGGTGTCTGCGGGA-3', 下游引物: 5'-AGGACGGTGCGGTGAGAGTG-3', 扩增片段长度为198 bp. PCR扩增条件: 94 ℃变性1 min, 57 ℃退火1 min, 72 ℃延伸1 min, 共35个循环. 最后72 ℃延伸7 min结束反应. 本实验设阴性对照, 每个标本在不加逆转录酶时进行RT-PCR, 以确定扩增产物来自cDNA模板而非基因组DNA. 同一标本至少进行2次RT-PCR反应, 所得PCR反应产物经1.5%琼脂糖凝胶电泳, 紫外灯下观察有无预期的扩增产物.
统计学处理 应用SPSS15.0统计软件包进行统计分析. 计数资料采用两个(或多个)样本率比较的χ2检验, 正态分布、方差齐的计量资料采用随机设计的两总体均数的t检验, 年龄资料采用单因素多个样本均数比较的q检验. 生存率曲线采用寿命表法. P<0.05为差异有统计学意义.
入组病例的临床资料见表1. 3组病例在年龄、性别方面无统计学差异(P>0.05), 结直肠癌组和结直肠息肉组在肿瘤分布方面无统计学差异(P>0.05). CK20 mRNA在3组中表达差异显著(χ2 = 16.95, P<0.01, 图1).
| 分组 | n | 年龄(mean, 岁) | 性别 | 肿瘤部位 | TNM分期 | 分化类型(腺癌) | CK20 mRNA表达 | |||||||||
| 男 | 女 | 结肠 | 直肠 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | 高 | 中 | 低 | 黏液 | 阳性 | 阴性 | |||
| 试验组 | 61 | 31-79(61.1) | 39 | 21 | 41 | 20 | 10 | 18 | 23 | 10 | 8 | 39 | 9 | 5 | 25 | 36 |
| 阳性对照组 | 10 | 38-78(60.5) | 7 | 3 | 8 | 2 | 0 | 10 | ||||||||
| 阴性对照组 | 20 | 30-74(60.3) | 14 | 6 | 0 | 20 | ||||||||||
CK20 mRNA在61例结直肠癌患者外周血中表达阳性率与肿瘤TNM分期、浸润深度、远处转移和区域淋巴结转移有关(P<0.05); 而与肿瘤大小和分化程度无关(P>0.05, 表2).
| 项目 | n | CK20 mRNA阳性表达 | χ2值 | P值 |
| TNM分期 | 12.01 | <0.01 | ||
| Ⅰ | 10 | 1 | ||
| Ⅱ | 18 | 5 | ||
| Ⅲ | 23 | 11 | ||
| Ⅳ | 10 | 8 | ||
| 侵袭深度 | 8.48 | <0.05 | ||
| 肌层 | 13 | 2 | ||
| 浆膜内 | 25 | 9 | ||
| 浆膜外 | 23 | 14 | ||
| 远处转移 | 5.91 | <0.05 | ||
| 无 | 52 | 18 | ||
| 有 | 9 | 7 | ||
| 淋巴结转移 | 6.49 | <0.05 | ||
| 无 | 29 | 7 | ||
| 有 | 32 | 18 | ||
| 分化类型 | 1.96 | >0.05 | ||
| 好 | 47 | 17 | ||
| 差 | 14 | 8 | ||
| 肿瘤大小 | 0.08 | >0.05 | ||
| ≤5 cm | 28 | 12 | ||
| >5 cm | 33 | 13 |
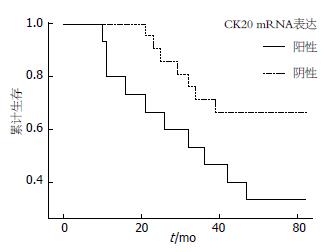
全部结直肠癌病例采用电话、信访或门诊检查的方式进行随访, 无失访病例. 随访时间: 6-62 mo(平均47.2 mo), 随访期内死亡27例, 死亡原因: 肝转移、腹腔转移和肺转移. 外周血中CK20 mRNA表达与死亡病例及其生存期的关系见表3和图2.
| CK20 mRNA表达 | n | 死亡(n) | 生存率 | χ2值 | P值 | 生存期(mo) | t值 | P值 |
| 阳性 | 15 | 10 | 33.33% | 4.36 | <0.05 | 35.80±5.12 | 10.25 | <0.01 |
| 阴性 | 22 | 7 | 68.18% | 50.43±3.58 |
临床上常用CK20与CK7联合检测以鉴别恶性肿瘤的组织来源. 因为CK20主要位于胃肠道的正常黏膜上皮细胞和陷窝细胞, 具有严格的上皮组织特异性. 研究显示[3-7]: 包括转移瘤在内的所有结直肠癌组织均表达CK20, 而在正常血液、淋巴结、骨髓中则为阴性. 因此, 从理论上讲, 通过检测血液或区域淋巴结中CK20 mRNA的表达, 就能够反应结直肠癌患者血液或区域淋巴结微转移情况[8-11], 这有助于为患者选择合适的治疗方式和预后评估提供帮助. 本研究发现: 结直肠癌患者外周静脉血CK20 mRNA表达阳性率为41.0%, 与报道[6-10]一致. 而其在健康人和结直肠息肉患者的外周血中无表达. 这说明通过RT-PCR法检测外周血中CK20 mRNA的表达对判定血行微转移具有较高的特异性和灵敏度, 具有一定的临床实用价值.
本研究发现: 结直肠癌患者外周血中CK20 mRNA的表达与肿瘤分期和浸润转移密切相关. 这说明随着结直肠癌细胞侵袭肠壁深度的加深, 肿瘤细胞发生血行微转移的比例也在明显增加. 肿瘤细胞进入外周血的途径可以是直接侵入脉管系统而直接入血, 也可以通过腹腔播散后经腹膜吸收入血[12-14]. 而肿瘤细胞到达肝脏后容易被肝脏Kupffer细胞所吞噬[15,16]. 因此, 外周血中CK20 mRNA的阳性检出率还取决于肝脏免疫系统的功能.
临床上约有30%-50%的结直肠癌患者在根治术后会出现局部复发和远处转移, 甚至那些肿瘤尚局限在肠壁且没有淋巴结转移的TNM分期Ⅰ、Ⅱ期患者, 仍有约30%患者在5年内死于局部复发和远处转移[17-23], 这说明这些患者体内存在常规方法不能发现的癌细胞. 本研究发现: TNM分期为Ⅰ、Ⅱ期的结直肠癌患者外周血中CK20 mRNA阳性表达率分别为10.0%和27.8%. 这说明结直肠癌在早期就已可发生血液微转移的现象, 而这些患者通常是不进行化疗治疗的. 因此, 外周血中CK20 mRNA的表达应作为一个复发转移的高危因素予以重视.
结直肠癌是最常见的消化系恶性肿瘤之一, 且发病率呈逐年上升的趋势. 虽然目前临床上对结直肠癌采取了规范的综合性治疗措施, 但其死亡率仍居恶性肿瘤的前列.
顾国利, 副主任医师, 中国人民解放军空军总医院普通外科
本研究采取外周静脉血检测CK20 mRNA的表达, 并进行了长期的随访. 进一步证明了外周血中CK20 mRNA的表达可以作为结直肠癌侵袭转移和预后判定的指标. 具有一定的创新性和实用价值.
外周血中CK20 mRNA的表达可以作为判断结直肠癌侵袭能力及预后的一个指标. 本研究为临床判定结直肠癌预后和指导化疗提供了一些有益的参考指标.
本文发现CK20 mRNA在外周血中的表达对于预测结直肠癌的预后及血液中微转移具有标志物作用, 具有一定临床实用价值.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | El-Tawil AM. Colorectal cancer and pollution. World J Gastroenterol. 2010;16:3475-3477. [PubMed] [DOI] |
| 2. | Wang YD, Wu P, Mao JD, Huang H, Zhang F. Relationship between vascular invasion and microvessel density and micrometastasis. World J Gastroenterol. 2007;13:6269-6273. [PubMed] [DOI] |
| 4. | Tsouma A, Aggeli C, Lembessis P, Zografos GN, Korkolis DP, Pectasides D, Skondra M, Pissimissis N, Tzonou A, Koutsilieris M. Multiplex RT-PCR-based detections of CEA, CK20 and EGFR in colorectal cancer patients. World J Gastroenterol. 2010;16:5965-5974. [PubMed] |
| 6. | 颜 登国, 张 汝一, 甄 运寰, 李 国胜, 姬 清华. 结直肠癌患者血液中CK20 mRNA的表达. 中国普外基础与临床杂志. 2011;18:164-167. |
| 7. | Wentz SC, Vnencak-Jones C, Chopp WV. Neuroendocrine and squamous colonic composite carcinoma: case report with molecular analysis. World J Gastroenterol. 2011;17:4729-4733. [PubMed] [DOI] |
| 8. | Satoh Y, Mori K, Kitano K, Kitayama J, Yokota H, Sasaki H, Uozaki H, Fukayama M, Seto Y, Nagawa H. Analysis for the combination expression of CK20, FABP1 and MUC2 is sensitive for the prediction of peritoneal recurrence in gastric cancer. Jpn J Clin Oncol. 2012;42:148-152. [PubMed] [DOI] |
| 9. | Auf FA, El-Eibdy GK, Mosaad YM, El-Ghannam DM, El-Masry EE. Cytokeratin 20 and vascular endothelial growth factor as molecular markers in Egyptian patients with colorectal cancer. J Oncol Pharm Pract. 2011;17:160-167. [PubMed] [DOI] |
| 10. | Lagoudianakis EE, Kataki A, Manouras A, Memos N, Papadima A, Derventzi A, Zografos G, Papadopoulos S, Katergiannakis V, Konstadoulakis MM. Detection of epithelial cells by RT-PCR targeting CEA, CK20, and TEM-8 in colorectal carcinoma patients using OncoQuick density gradient centrifugation system. J Surg Res. 2009;155:183-190. [PubMed] [DOI] |
| 11. | Shen C, Hu L, Xia L, Li Y. Quantitative real-time RT-PCR detection for survivin, CK20 and CEA in peripheral blood of colorectal cancer patients. Jpn J Clin Oncol. 2008;38:770-776. [PubMed] [DOI] |
| 13. | Lim SW, Huh JW, Kim YJ, Kim HR. Laparoscopic low anterior resection for hematogenous rectal metastasis from gastric adenocarcinoma: a case report. World J Surg Oncol. 2011;9:148. [PubMed] [DOI] |
| 14. | Huh JW, Kim YJ, Kim HR. Complete peritonectomy and intraperitoneal chemotherapy for recurrent rectal cancer with peritoneal metastasis. World J Gastroenterol. 2009;15:756-757. [PubMed] [DOI] |
| 15. | Georges R, Bergmann F, Hamdi H, Zepp M, Eyol E, Hielscher T, Berger MR, Adwan H. Sequential biphasic changes in claudin1 and claudin4 expression are correlated to colorectal cancer progression and liver metastasis. J Cell Mol Med. 2012;16:260-272. [PubMed] [DOI] |
| 16. | Paschos KA, Majeed AW, Bird NC. Role of Kupffer cells in the outgrowth of colorectal cancer liver metastases. Hepatol Res. 2010;40:83-94. [PubMed] [DOI] |
| 18. | Su BB, Shi H, Wan J. Role of serum carcinoembryonic antigen in the detection of colorectal cancer before and after surgical resection. World J Gastroenterol. 2012;18:2121-2126. [PubMed] [DOI] |
| 19. | Mescoli C, Albertoni L, Pucciarelli S, Giacomelli L, Russo VM, Fassan M, Nitti D, Rugge M. Isolated tumor cells in regional lymph nodes as relapse predictors in stage I and II colorectal cancer. J Clin Oncol. 2012;30:965-971. [PubMed] [DOI] |
| 20. | Zeestraten EC, Maak M, Shibayama M, Schuster T, Nitsche U, Matsushima T, Nakayama S, Gohda K, Friess H, van de Velde CJ. Specific activity of cyclin-dependent kinase I is a new potential predictor of tumour recurrence in stage II colon cancer. Br J Cancer. 2012;106:133-140. [PubMed] [DOI] |
| 21. | Shanmugam C, Hines RB, Jhala NC, Katkoori VR, Zhang B, Posey JA, Bumpers HL, Grizzle WE, Eltoum IE, Siegal GP. Evaluation of lymph node numbers for adequate staging of Stage II and III colon cancer. J Hematol Oncol. 2011;4:25. [PubMed] [DOI] |
| 22. | Lips DJ, Koebrugge B, Liefers GJ, van de Linden JC, Smit VT, Pruijt HF, Putter H, van de Velde CJ, Bosscha K. The influence of micrometastases on prognosis and survival in stage I-II colon cancer patients: the Enroute⊕ Study. BMC Surg. 2011;11:11. [PubMed] [DOI] |
| 23. | Grothey A. Does stage II colorectal cancer need to be redefined? Clin Cancer Res. 2011;17:3053-3055. [PubMed] [DOI] |