修回日期: 2012-01-06
接受日期: 2012-06-30
在线出版日期: 2012-07-28
目的: 探讨水通道蛋白3(aquaporin 3, AQP3)对肠黏膜上皮细胞间紧密连接(tight junction, TJ)的影响, 并探讨其可能的作用机制.
方法: 应用Caco-2细胞系在体外构建肠黏膜上皮屏障, 构建沉默AQP3的shRNA慢病毒载体, 建立稳定转染细胞系. 实验分为3组: 空白对照组(BLANK)、阴性对照组(NC)、AQP3干扰组(AQP3 shRNA). Western blot验证TJ相关蛋白Occludin以及Claudin-1的表达情况; 并且采用免疫细胞化学法观察TJ相关蛋白的分布和结构变化.
结果: RT-PCR及Western blot结果显示在Caco-2细胞系中成功沉默AQP3的表达. 干扰组与对照组相比下降约75%. Western blot结果显示AQP3干扰组TJ相关蛋白Occludin以及Claudin-1的表达明显降低. 免疫细胞化学结果显示Caco-2细胞间Occludin以及Claudin-1主要表达在细胞膜和/或胞浆中, Occludin和Claudin-1细胞间棕褐色颗粒减少, 结构变模糊. 相邻Caco-2细胞间TJ结构遭到破坏.
结论: 靶向AQP3的shRNA技术可以引起TJ的结构变化和相关蛋白的表达分布的异常.
引文著录: 张文杰, 徐勇, 王斌, 徐皓. 水通道蛋白3与紧密连接的相关性. 世界华人消化杂志 2012; 20(21): 1973-1977
Revised: January 6, 2012
Accepted: June 30, 2012
Published online: July 28, 2012
AIM: To investigate the effect of lentiviral-mediated delivery of short hairpin RNA (shRNA) targeting aquaporin 3 (AQP3) on the barrier function of intestinal tight junctions and to explore the possible mechanisms involved.
METHODS: A lentiviral vector expressing shRNA targeting AQP3 was constructed and transfected into Caco-2 cells. The cells were divided into three groups: blank group, negative control group, and AQP3 shRNA group. Western blot and immunocytochemistry were used to detect the expression of occludin and claudin-1 proteins in transfected cells.
RESULTS: RT-PCR and Western blot results showed that AQP3 expression was down-regulated in Caco-2 cells transfected with the lentiviral vector expressing shRNA targeting AQP3. Western blot analysis revealed that the expression levels of occludin and claudin-1 proteins were significantly decreased in Caco-2 cells transfected with the lentiviral vector expressing shRNA targeting AQP3. Immunocytochemistry showed that occludin and claudin-1 were mainly distributed in the cytoplasm and membrane. The structure of tight junctions was destroyed in cells transfected with the lentiviral vector expressing shRNA targeting AQP3.
CONCLUSION: Lentiviral-mediated delivery of shRNA targeting AQP3 causes abnormal distribution of tight junction proteins and destruction of tight junctions in Caco-2 cells.
- Citation: Zhang WJ, Xu Y, Wang B, Xu H. Lentiviral-mediated delivery of shRNA targeting aquaporin 3 alters tight junction protein expression and distribution in Caco-2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1973-1977
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1973.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1973
近年来, 随着研究的深入和细胞分子生物学技术的发展和应用, 肠道在烧伤、严重感染、休克等应激状态下的重要作用越来越受到重视. 肠黏膜屏障的具体机制非常复杂, 至今尚不十分清楚, 可能与肠黏膜机械屏障、局部生物学因素、化学因素及免疫功能有关[1]. 缺氧、炎症、外伤等损伤均可导致肠黏膜屏障功能障碍. 紧密连接(tight junction, TJ)通常位于上皮顶端两相邻细胞间, 在TJ处的细胞质膜几乎融合并紧紧结合在一起. 他们形成连续纤维将相邻细胞间连接起来并封闭了细胞间空隙, 控制着离子及小分子可溶性物质通过, 在毒性分子和微生物的侵入过程中起着重要的防御作用[2-4]. 水通道蛋白(aquaporins, AQPs)是一组分子量约30 kDa(单体)疏水性膜转运蛋白家族, AQP3在消化系中主要参与水及甘油的运输[5]. 然而, AQPs与TJ的关系及可能的分子机制仍不十分清楚. 为深入研究这一问题, 为此我们设计了本实验, 体外构建肠上皮屏障, 观察干扰AQP3的表达后其对TJ主要构成蛋白Occludin和Claudin-1的影响并探讨其可能机制.
人结肠癌细胞系Caco-2(上海细胞生物研究所); 体式显微镜(Nikon公司); DMEM细胞培养液(美国GIBCO公司); 胎牛血清(GIBCO公司); 非必需氨基酸(GIBCO); 胰蛋白酶(Invitrogen公司); 嘌呤霉素(Sigma-Aldrich); AMV反转录试剂盒(Promega); Transwell小室(Corning公司); TRIzol(美国invitrogen公司); 兔抗人AQP3、Occludin多克隆抗体, 鼠抗人Claudin-1、GAPDH单克隆抗体及酶标抗鼠、抗兔IgG(辣根过氧化物酶标记的抗小鼠、抗兔IgG抗体)均为美国Santa Cruz公司产品. 慢病毒干扰载体由上海生博公司设计构建合成.
1.2.1 细胞培养: Caco-2细胞维持于含100 mL/L胎牛血清、50 mg/L青霉素和100 mg/L链霉素的DMEM全培养液中, 于37 ℃、50 mL/L CO2培养箱中培养.
1.2.2 稳定转染: 分别用干扰AQP3表达的慢病毒和对照病毒以感染复数(multiplicity of infection, MOI) = 50感染Caco-2结肠腺癌细胞, 37 ℃孵育24 h后更换完全培养基, 继续培养3-5 d后病毒基因可整合到宿主细胞基因组, 倒置显微镜下观察可见细胞出现绿色荧光, 证明感染成功. 嘌呤霉素5 mg/L筛选1 wk得到稳定干扰AQP3表达的Caco-2细胞系.
1.2.3 RT-PCR检测AQP3 mRNA的表达: TRIzol法提取细胞总RNA, 用AMV(Promega)反转录试剂盒进行cDNA合成和PCR扩增. 检测AQP3的上游引物序列为5'-CACAGCCGGCATCTTTGCTA-3', 下游引物序列为5'-TGGCCAGCACACACACGATA-3', 扩增片段长度为107 bp; 内参β-actin基因的上游引物序列为5'-TCACCCACACTGTGCCCATCTACGA-3', 下游引物序列 5'-CAGCGGAACCGCTCATTGCCAATGG-3', 扩增片段长度为295 bp. 退火温度均为60.0 ℃. 扩增得到的产物经1%的琼脂糖凝胶电泳.
1.2.4 Western blot检测: 用预冷的RIPA裂解缓冲液裂解细胞, 用细胞刮匙(scraper)将细胞从培养皿或培养板中刮落, 收集于Eppendorf管中, 13 000 r/min 4 ℃离心15 min, 收集上清液用于Western blot实验. 加入上样缓冲液, 100 ℃处理 5 min; BCA法测定蛋白浓度. 取20 μg蛋白上样进行聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳2-2.5 h; 电泳完毕后用湿转法将分离的蛋白条带转移到PVDF膜(Millipore); 含5%脱脂奶粉的TBS封闭1 h, 加入含有anti-AQP3(1:1 000)、anti-Occludin(1:1 000)、anti-Claudin-1(1:1 000)的一抗液中室温摇动1-2 h; TBST(0.05% Tween-20)洗3次, 用含IgG-HRP(1:5 000)的封闭液摇动1 h, TBST洗3次, 将膜晾干, 加显色液于膜上, 用封口膜将膜包住放入暗盒内, 加入X光胶片, 进行曝光、显影和定影. 用Bio-Rad公司的Quantity One软件对结果进行灰度分析.
1.2.5 免疫细胞化学染色: 将细胞以一定数量接种于内含灭菌盖玻片的6孔培养板内, 待细胞长至单层后取出盖玻片, 丙酮室温下固定10 min, PBS漂洗3次. 采用两步法免疫组织化学染色, 单抗1:100-400稀释, 4 ℃过夜; 二抗1:200, 37 ℃孵育1 h, PBS漂洗, DAB染色后苏木精复染.
统计学处理 用SPSS10.0统计学软件进行统计学分析. 结果以mean±SD表示, 采用单因素方差分析(ANOVA)比较不同处理组之间的差异. P<0.05为差异有统计学意义.
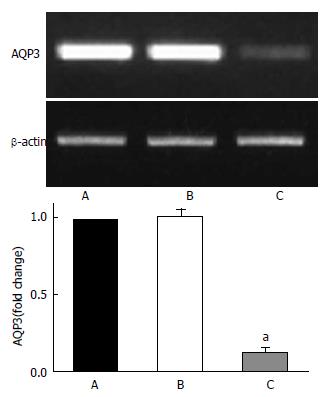
半定量RT-PCR结果经过灰度分析后显示, 干扰组AQP3 mRNA的表达与对照组相比下降约85%左右, 结果有统计学意义(P<0.05), 而空白对照组与阴性对照组间差异无统计学意义(P>0.05). 提示此干扰序列能够成功沉默AQP3 mRNA的表达(图1).
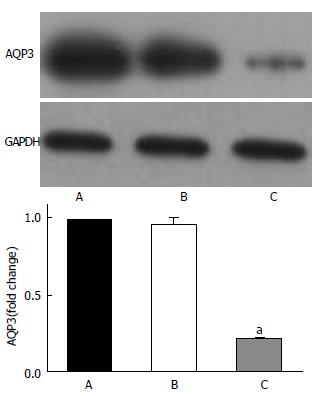
稳定转染细胞系建立后行Western blot检测, 灰度值分析结果与RT-PCR结果一致, 干扰组AQP3蛋白的表达与对照组相比, 下降约75%左右(P<0.05), 有统计学意义(图2).
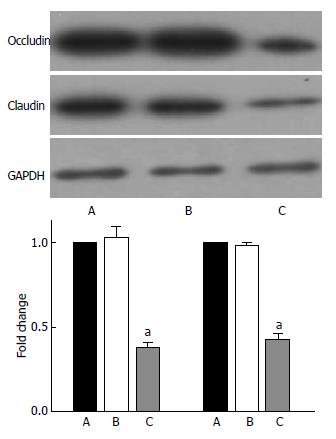
Western blot分析显示, RNA干扰组中TJ相关蛋白Occludin和Claudin-1的表达水平降低,下降约60%左右, 说明干扰AQP3的表达能够下调Occludin和Claudin-1的表达(图3).
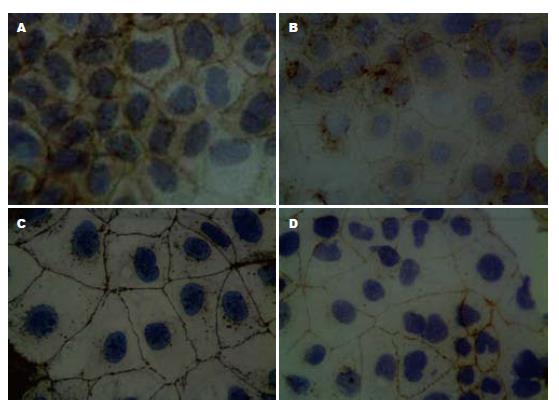
Caco-2细胞在AQP3干扰后, Occludin和Claudin-1细胞间棕褐色颗粒减少, 结构变模糊, 表明相应蛋白表达减少(图4).
AQPs广泛分布于动物与植物界, 自上个世纪80年代末Agre[6]在人红细胞克隆第1种水通道蛋白(AQP1), 迄今已在哺乳动物中发现13种AQPs, AQP0-AQP12. 由于在细胞膜水通道领域的杰出贡献, Agre获得2003年度诺贝尔化学奖. 在AQPs中AQP3、AQP7、AQP9、AQP10与AQP12组成1个亚族, 他们不仅能转运水, 亦能转运甘油、尿素等小分子物质, 故又称水甘油通道蛋白(aquaglyceroporin)[7]. 研究显示AQPs在尿液浓缩、腺体分泌、脂肪代谢、神经信号传导、皮肤保湿等生理功能中发挥重要作用[8,9].
TJ和肠上皮细胞共同构成肠道的选择性屏障, 是肠道机械屏障的重要组成部分. TJ至少由3类跨膜蛋白组成: Occludin、Claudin家族与连接粘附分子. 这些分子均参与调节TJ的功能[10]. Kawedia等[11]用Hg2+阻断AQPs后发现, TJ相关蛋白occludin表达水平下降50%, 其具体机制可能是通过磷酸激酶途径调控TJ相关蛋白的表达. Sidhaye等[12]发现AQP5调控气管上皮细胞间的通透性, 直接影响气管上皮的屏障功能. Kawedia等[13]又在AQP5-/-小鼠模型上发现, 唾液腺TJ相关蛋白Claudin-7、Claudin-3和Occludin表达均降低, 黏膜对FITC标记的葡聚糖通透性明显升高. AQP4基因敲除的小鼠大脑血管的显微结构、TJ和血管周围星型细胞突触明显改变[14].
Caco-2细胞来源于人结肠癌细胞, 与人小肠上皮细胞有相同的细胞极性和TJ, 是国际上公认的研究TJ和药物小肠吸收的体外模型[15]. 为了研究AQPs在肠道中与TJ的关系, 我们通过Western blot法检测Occludin以及Claudin-1的蛋白表达水平. 发现靶向干扰AQP3的表达后, Occludin和Claudin-1的表达水平与对照组相比明显降低, 免疫组织化学同样证实了我们的结果, 说明跨细胞途径(AQPs)和旁细胞途径(TJ)在Caco-2细胞中是紧密联系在一起的.
研究显示蛋白激酶C(protein kinase C, PKC)通路在TJ中发挥着重要的作用, Suzuki等[16]发现PKC可使occludin中C端结构域苏氨酸磷酸化, 调节TJ功能; 还有研究发现PKC可磷酸化人claudin-4的第194个丝氨酸, 进而影响TJ功能[17]. 因此AQPs也可能是通过PKC通路影响TJ功能, 但其具体机制仍需进一步研究.
总之, 降低AQP3的表达能引起TJ结构蛋白occludin, claudin-1表达的减弱, 从而引起肠黏膜通透性升高, 肠黏膜屏障功能的损害.
肠道作为应激反应的中心器官之一, 在创伤、手术、严重感染等应激状态时, 也起着重要作用. 当机体应激反应过度或失调时, 肠黏膜功能将受到损害, 原先寄生于肠道内的微生物及其毒素越过受损的肠黏膜屏障, 导致肠道细菌及其毒素移位.
唐世刚, 教授, 湖南省人民医院
肠黏膜屏障的具体机制非常复杂, 至今尚不十分清楚, 可能与肠黏膜机械屏障、局部生物学因素、化学因素及免疫功能有关. 缺氧、炎症、外伤等损伤均可导致肠黏膜屏障功能障碍.
Kawedia等用Hg2+阻断水通道蛋白(AQPs)后发现, 紧密连接(TJ)相关蛋白Occludin表达水平下降50%, 其具体机制可能是通过磷酸激酶途径调控TJ相关蛋白的表达, 初步阐明了AQPs可能调控TJ相关蛋白的表达.
本研究首次阐述AQPs与小肠黏膜屏障的关系, 为严重疾病状态下肠黏膜屏障功能异常的机制研究提供了有意义的实验依据.
水通道蛋白(AQP):一组分子量约30 kDa(单体)的疏水性膜转运蛋白家族, 属于主要固有蛋白(MIP)家族. AQPs在细胞膜上以四聚体形式构成选择性水通道, 介导水渗透压依赖性跨生物膜转运.
本研究设计合理, 方法可靠, 实验结果可信, 且文笔流畅, 内容翔实, 有一定的创新和很好的实用价值.
编辑: 张姗姗 电编:鲁亚静
| 2. | Shin K, Fogg VC, Margolis B. Tight junctions and cell polarity. Annu Rev Cell Dev Biol. 2006;22:207-235. [PubMed] [DOI] |
| 3. | González-Mariscal L, Betanzos A, Nava P, Jaramillo BE. Tight junction proteins. Prog Biophys Mol Biol. 2003;81:1-44. [PubMed] [DOI] |
| 6. | Agre P. The aquaporin water channels. Proc Am Thorac Soc. 2006;3:5-13. [PubMed] [DOI] |
| 7. | Virreira M, Perret J, Delporte C. Pancreatic beta-cells: Role of glycerol and aquaglyceroporin 7. Int J Biochem Cell Biol. 2011;43:10-13. [PubMed] [DOI] |
| 8. | Larsen HS, Aure MH, Peters SB, Larsen M, Messelt EB, Kanli Galtung H. Localization of AQP5 during development of the mouse submandibular salivary gland. J Mol Histol. 2011;42:71-81. [PubMed] [DOI] |
| 9. | Rao KV, Jayakumar AR, Reddy PV, Tong X, Curtis KM, Norenberg MD. Aquaporin-4 in manganese-treated cultured astrocytes. Glia. 2010;58:1490-1499. [PubMed] [DOI] |
| 10. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-1909. [PubMed] [DOI] |
| 11. | Kawedia JD, Jiang M, Kulkarni A, Waechter HE, Matlin KS, Pauletti GM, Menon AG. The protein kinase A pathway contributes to Hg2+-induced alterations in phosphorylation and subcellular distribution of occludin associated with increased tight junction permeability of salivary epithelial cell monolayers. J Pharmacol Exp Ther. 2008;326:829-837. [PubMed] [DOI] |
| 12. | Sidhaye VK, Schweitzer KS, Caterina MJ, Shimoda L, King LS. Shear stress regulates aquaporin-5 and airway epithelial barrier function. Proc Natl Acad Sci U S A. 2008;105:3345-3350. [PubMed] [DOI] |
| 13. | Kawedia JD, Nieman ML, Boivin GP, Melvin JE, Kikuchi K, Hand AR, Lorenz JN, Menon AG. Interaction between transcellular and paracellular water transport pathways through Aquaporin 5 and the tight junction complex. Proc Natl Acad Sci U S A. 2007;104:3621-3626. [PubMed] [DOI] |
| 14. | Zhou J, Kong H, Hua X, Xiao M, Ding J, Hu G. Altered blood-brain barrier integrity in adult aquaporin-4 knockout mice. Neuroreport. 2008;19:1-5. [PubMed] [DOI] |
| 15. | Artursson P, Palm K, Luthman K. Caco-2 monolayers in experimental and theoretical predictions of drug transport. Adv Drug Deliv Rev. 2001;46:27-43. [PubMed] [DOI] |
| 16. | Suzuki T, Elias BC, Seth A, Shen L, Turner JR, Giorgianni F, Desiderio D, Guntaka R, Rao R. PKC eta regulates occludin phosphorylation and epithelial tight junction integrity. Proc Natl Acad Sci U S A. 2009;106:61-66. [PubMed] [DOI] |
| 17. | Aono S, Hirai Y. Phosphorylation of claudin-4 is required for tight junction formation in a human keratinocyte cell line. Exp Cell Res. 2008;314:3326-3339. [PubMed] [DOI] |