修回日期: 2012-03-20
接受日期: 2012-04-19
在线出版日期: 2012-07-18
目的: 探讨小型猪胰岛治疗糖尿病大鼠的作用和功效.
方法: 成年健康♂五指山小型猪和普通家猪作为胰岛供体. 胰腺获取后经胶原酶消化后进行胰岛提取纯化, 纯化后的胰岛通过门静脉移植到糖尿病SPF大鼠的肝内, 术后每天肌注环孢菌素(20 mg/kg)作为免疫抑制剂, 并通过检测糖尿病大鼠的血糖变化和肝脏组织学检查来判定胰岛移植后的存活情况和纠正胰岛移植的效果.
结果: 五指山小型猪胰腺消化后胰岛产量为4 608 IEQ/g±593 IEQ/g, 纯化后为3 820 IEQ/g±718 IEQ/g, 纯度为85%, 取自屠宰场猪胰岛产量为纯化前为3 500 IEQ/g±625 IEQ/g, 纯化后为2 720 IEQ/g±435 IEQ/g, 纯度为80%. 两组84.6%糖尿病大鼠在移植术后第1天, 血糖降至正常. 维持时间: 小型猪胰岛术后存活时间为3-5 d(中位存活时间: 4.5 d), 普通家猪胰岛存活时间为2-4 d(中位存活时间: 3.7 d). 经Kaplan-Meier分析, 两组胰岛存活时间无差别.
结论: 封闭群五指山小型猪分离纯化后的胰岛产量高, 功能良好, 可以纠正糖尿病大鼠的高血糖, 适合作为异种胰岛移植的理想供体.
引文著录: 蒋小峰, ThomasLinn, 向广阳, 王业增, 钱滔来, 曹良启, 杨学伟, 章乐虹, 陈德. 五指山小型猪胰岛对糖尿病大鼠的治疗作用. 世界华人消化杂志 2012; 20(20): 1863-1867
Revised: March 20, 2012
Accepted: April 19, 2012
Published online: July 18, 2012
AIM: To assess the efficacy of Wuzhishan miniature pig islets in the treatment of diabetic rats.
METHODS: Adult male miniatures pigs and market pigs were used as donors. After collagenase digestion, the islets were purified and intraportally transplanted into diabetic SPF rats, with cyclosporine (20 mg/kg) intramuscularly injected as an immunosuppressive agent. Islet graft survival was monitored by the detection of changes in blood sugar and liver histology in diabetic rats.
RESULTS: Islet yield was 4 608 IEQ/g ± 593 IEQ/g in the miniature pig group and 3 820 IEQ/g ± 718 IEQ/g in the market pig group. On day 1 after transplantation, the blood glucose decreased to normal in 84.6% of diabetic rats in both groups. Islet survival time was 3-5 d (median: 4.5 d) in the miniature pig group and 2-4 d (median: 3.7 d) in the market pig group. Kaplan-Meier analysis showed no significant difference between the two groups.
CONCLUSION: The Wuzhishan miniature pigs are an ideal donor species for islet xenotransplantation due to high islet yield and good islet function.
- Citation: Jiang XF, Linn T, Xiang GY, Wang YZ, Qian TL, Cao LQ, Yang XW, Zhang LH, Chen D. Treatment of diabetic rats using islets from a herd of outbred Wuzhishan miniature pigs. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1863-1867
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1863.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1863
糖尿病目前成为世界高发性疾病, 我国是世界糖尿病第一大国, 有9 200万患者和1.4亿糖尿病前期患者[1]. 虽然胰岛素替代治疗可以很好地控制糖尿病患者的血糖, 但仍有一部分患者的血糖不易被胰岛素控制, 波动幅度大, 导致低血糖昏迷或其他相关并发症[2], 而且有部分患者长期胰岛素注射后会引起皮下结节, 导致注射困难. 胰岛移植从2000年开始进入临床试验并取得了良好的治疗效果, 被认为是胰岛素替代的有效方法[3], 不但可以有效调节血糖, 而且可以有效防止糖尿病引起的血管病变, 明显降低糖尿病、肾病、眼病和高血压等症状. 但是在我国, 由于供体来源困难, 胰岛分离技术还不完善, 使得临床人胰岛移植技术在我国还不能顺利开展. 而猪胰岛素和人胰岛素在结构上相差一个氨基酸序列, 因此可以在人体发挥正常功能而调节血糖, 且随着基因工程技术的发展, 临床前研究证实了猪胰岛可以长期有效地纠正糖尿病灵长类动物的血糖, 使科研工作者看见了临床猪胰岛移植的前景[4,5], 国际相关机构为此制订了一些政策和指南来引导合适的临床研究[6]. 我们曾对我国特有的五指山小型猪进行了胰岛分离纯化的研究, 而且目前国际上的研究证实小型猪在异种胰岛移植中的优势[7], 因此在本研究中将对五指山小型猪胰岛治疗糖尿病的功效进行研究.
5只♂成年五指山小型猪, 体质量25-30 kg, 购自广东省实验动物监测所; 健康♂30只SPF大鼠, 体质量250-280 g, 购自广东省医学实验动物中心; 所有动物实验都得到广州医学院动物实验伦理委员会的审核和批准. 6只普通家猪胰腺取自嘉禾望岗屠宰场; HBSS购自Sigma公司; 淋巴细胞分离液(Amersham Bioscience); 胎牛血清(华美生物工程公司); 胶原酶V、链脲佐菌素(STZ)、双硫宗(DTZ)均购自Sigma公司; 胰岛素ELISA试剂盒购自Linco, USA; 羊抗胰岛素抗体购自Zymed, South SanFrancisco, CA, USA.
1.2.1 糖尿病大鼠模型制作: 用柠檬酸液体配制STZ, 浓度为1%, pH值控制在7.35-7.45. 大鼠称重后, 腹腔内注射STZ, 剂量为60 mg/kg. STZ注射后, 尾静脉抽血检测血糖, 当连续2 d血糖高于22 mmol/L时则认为模型成功. 模型建立成功后5-7 d进行胰岛移植.
1.2.2 胰岛消化分离: 胰腺获取修整干净后, 用含胶原酶V(浓度2 g/L)HBSS溶液通过胰管灌注胰腺, 胰腺充分膨胀后切成4-6块, 放入消化罐内用蠕动泵进行机械消化, 温度控制在37.8 ℃-38.2 ℃. 待胰腺充分消化后用冷HBSS液体中止, 消化液用500目的滤网过滤后1 000 r/min离心5 min弃去上清液, 收集沉淀的细胞用淋巴分离液进行梯度离心分离胰岛, 离心密度为1.10、1.08、1.06、1.04 g/L. 离心纯化后, 收集纯化的胰岛, 用双硫宗(DTZ)染色确认, 在镜下根据胰岛直径的大小(150 μm)计算胰岛IEQ, 胰岛分离纯化后不经培养直接用于移植.
1.2.3 胰岛移植: SPF糖尿病大鼠腹腔注射10%的水合氯醛(350 mg/kg), 取正中切口切开腹部, 将肠管拖出腹腔后用湿纱布妥善保护后, 大鼠腰部垫高利于暴露肝门部门静脉. 简单分离门静脉主干后, 用血管夹夹门静脉主干远端, 用22G套管针穿刺门静脉, 穿刺后通过留置的套管注射纯化的不同猪胰岛, 剂量为4 000-5 000 IEQ/大鼠, 门静脉穿刺处用8-0的Prolene线缝合1-2针. 移除血管夹, 开放门静脉, 回纳肠管后关腹.
1.2.4 移植术后监测: 术后通过尾静脉取血每天检测糖尿病大鼠血糖变化, 每组术后第1天各取3只大鼠处死后取出肝脏, 用10%的甲醛固定后石蜡包埋切片, 切片和蜡块送德国吉森大学进行移植肝的病理学检查, 用荧光异硫氰酸耦合的胰岛素抗体检测移植肝内胰岛细胞, 并用荧光显微镜(Leica DFC420C CCD)观察和处理图像.
1.2.5 术后胰岛存活情况判定: 术后血糖<11.6 mmol/L时, 认为胰岛发挥功能, 并存活良好, 当连续2 d血糖>11.6 mmol/L时则认为胰岛丧失功能.
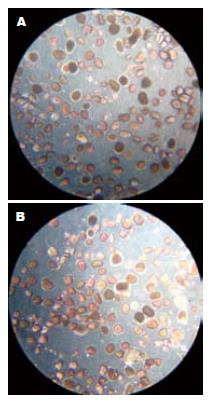
小型猪胰腺消化后胰岛产量纯化前为4 608 IEQ/g±593 IEQ/g, 纯化后为3 820 IEQ/g±7 18 IEQ/g, 纯度为85%; 取自屠宰场猪胰岛产量为纯化前为3 500 IEQ/g±625 IEQ/g, 纯化后为2 720 IEQ/g±4 35IEQ/g, 80%. 镜下观察, 小型猪胰岛大小一致, 形态完整, 活力正常(图1). 体外培养小型猪胰岛在低糖刺激下释放胰岛素为在低糖和高糖刺激下胰岛素释放分别为2.18 μU/islet±0.21 μU/islet和4.211 μU/islet±0.73 μU/islet, 差异有显著性意义(P<0.01), 而取自屠宰场猪胰岛素释放分别为1.83 μU/islet±0.36 μU/islet和3.61 μU/islet±0.72 μU/islet, 差异有显著性, 小型猪胰岛在低糖和高糖刺激后释放的胰岛素都高于普通家猪(表1).
| n | 低糖2.8 mmol/L(µU/islet) | 高糖16.8 mmol/L(µU/islet) | P值 | |
| 五指山小型猪 | 5 | 2.18±0.21 | 4.211±0.73 | <0.01 |
| 普通家猪 | 6 | 1.83±0.36 | 3.61±0.72 | <0.01 |
| P值 | <0.01 | <0.01 |
SPF大鼠腹腔内注射STZ后每天通过尾静脉取血检监测血糖, 当连续两次血糖≥16.7 mmol/L, 并伴有体质量下降, 多尿等症状时, 则认为造模成功. 30只大鼠造模成功为26只, 成功率为86.7%. 造模成功后5-7 d随机分成2组进行胰岛移植实验: 小型猪胰岛移植组和普通家猪胰岛移植组, 每组13只.
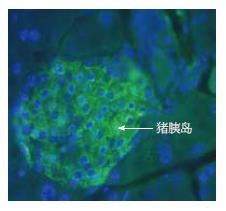
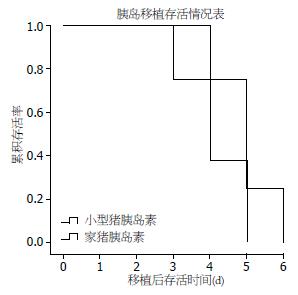
糖尿病大鼠胰岛移植后, 小型猪胰岛和普通猪胰岛移植后可以在术后第1天纠正糖尿病大鼠的高血糖, 其中在两组的糖尿病大鼠中, 每组84.6%糖尿病大鼠(11只/13只)的血糖恢复正常, 术后第1天每组各取3只进行肝脏病理学检测, 经胰岛素抗体染色及荧光镜下观察到胰岛在肝脏内能正常存活并发挥功能(图2, 绿色为分泌胰岛素的胰岛细胞). 小型猪胰岛术后存活时间为3-5 d(中位存活时间: 4.5 d), 普通家猪胰岛存活时间为2-4 d(中位存活时间: 3.7 d). 经Kaplan-Meier分析, 两组胰岛存活时间无差别(图3).
近年来由于人体器官匮乏及基因工程技术的发展, 使得猪胰岛治疗1型糖尿病的前景越来越可能[8,9]. 大量的临床前研究证实了猪胰岛在糖尿病灵长类动物纠正血糖的能力, 但是由于目前尚缺乏一种能提供稳定胰岛来源的猪种使得异种胰岛移植目前仍然不能被广泛应用于临床. 近期的研究认为小型猪可能是比较理想的猪种来源. 并进行了大量的研究证实了小型猪的优势[7,10]. 我国是目前世界上拥有最丰富小型猪资源的国家, 我国小型猪种类繁多, 品种优良, 因此在我国对小型猪胰岛的开发与研究更有意义[11].
五指山小型猪是生长在我国海南岛少数民族地区的一种优良地方猪种, 长期进行封闭饲养, 受外界干扰少, 品种较纯. 封闭群的五指山小型猪个体差异小, 在我们之前的研究中发现该品系的胰腺和普通家猪相比无论是解剖形态还是功能上都有优势, 这就为胰岛分离纯化提供了一个稳定的平台, 因此我们选择该品系作为异种胰岛移植的研究.
本研究中五指山小型猪和普通家猪相比不仅胰岛产量有了明显地提高, 而且胰岛的功能也非常良好. 在体外实验中, 小型猪胰岛对糖刺激的反应优于普通家猪, 反应了小型猪胰岛在经历机械分离和纯化过程损伤后, 仍然能保持良好的活力, 证实了小型猪胰岛更能耐受缺氧和损伤. 在体内实验中, 两组术后的肝脏病理切片检查中发现了存活的胰岛, 并保持了良好的分泌功能, 证明了猪胰岛移植治疗糖尿病的可行性和有效性. 胰岛在移植后数小时发挥作用, 第1天糖尿病大鼠的血糖就能降到正常, 84.6%糖尿病大鼠(11只/13只)的血糖恢复正常. 小型猪胰岛存活时间为3-5 d (中位存活时间: 4.5 d), 普通家猪胰岛存活时间为2-4 d(中位存活时间: 3.7 d), 两组胰岛存活时间无差别. 这主要由于免疫排斥和凝血反应的发生, 小型猪胰岛并不能长期维持功能, 因此如果要长期发挥功能的话, 还需要对供体进行基因修饰, 如转入人的补体抑制基因[12], 可以延长胰岛的存活时间.
总之, 在本研究证实了五指山小型猪在胰岛的产量优势, 这和Kimm等研究一致. 而且在体实验证明了其良好的功能. 今后异种胰岛移植可能成为治疗胰岛素依赖性糖尿病, 特别是脆性糖尿病的一个有效替代方法[13,14]. 因此五指山小型猪作为异种胰岛移植供体来源的非常可靠, 他们不仅饲养容易, 繁殖迅速, 而且可以在一定程度进行近交繁殖, 保证基因纯度, 使得个体差异较小, 为我国在利用猪胰岛治疗糖尿病上提供了一个良好的应用平台.
胰岛移植是治疗糖尿病的有效替代方法之一, 但目前人胰岛移植存在来源困难, 技术要求高, 费用昂贵, 因此不适合我国国情. 而利用猪胰岛代替人胰岛来治疗糖尿病却有着广阔的开发前景.
洪天配, 教授, 北京大学第三医院内分泌科
由于猪胰岛移植到人体后, 会发生凝血和排斥反应, 导致猪胰岛移植治疗糖尿病研究停滞不进, 但近年来随着基因工程技术的发展, 通过对供体猪进行基因改造, 已经使得猪胰岛移植的临床前景更更加广阔.
2006年, Nature Medicine发表了2篇有关猪胰岛治疗糖尿病的研究, 取得了良好的效果; 2009年, Cooper应用转人CD46基因的猪胰岛进行了治疗糖尿病猴的研究, 取得了最佳的治疗效果.
目前国内应用猪胰岛移植研究所用的猪种多为杂交大白猪, 而本研究所采用的为封闭群小型猪, 该猪种遗传背景清楚, 基因纯合度高. 因此在供体来源上保证了个体差异小, 减少了实验偏差. 保证了课题的科学性和有效性, 也为今后临床研究提供了有效的材料来源.
IEQ: islet equivalent quantity的简写, 是根据胰岛直径的大小来计算胰岛的当量(以150 µm为基准), 是重要的胰岛计量单位.
本研究为我国在异种胰岛治疗领域提供了一个新的替代方法, 有着较高的学术价值和临床意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Yang ZJ, Liu J, Ge JP, Chen L, Zhao ZG, Yang WY. Prevalence of cardiovascular disease risk factor in the Chinese population: the 2007-2008 China National Diabetes and Metabolic Disorders Study. Eur Heart J. 2012;33:213-220. [PubMed] [DOI] |
| 2. | Bonifacio E, Ziegler AG. Advances in the prediction and natural history of type 1 diabetes. Endocrinol Metab Clin North Am. 2010;39:513-525. [PubMed] [DOI] |
| 3. | Shapiro AM, Ricordi C, Hering BJ, Auchincloss H, Lindblad R, Robertson RP, Secchi A, Brendel MD, Berney T, Brennan DC. International trial of the Edmonton protocol for islet transplantation. N Engl J Med. 2006;355:1318-1330. [PubMed] [DOI] |
| 4. | Hering BJ, Wijkstrom M, Graham ML, Hårdstedt M, Aasheim TC, Jie T, Ansite JD, Nakano M, Cheng J, Li W. Prolonged diabetes reversal after intraportal xenotransplantation of wild-type porcine islets in immunosuppressed nonhuman primates. Nat Med. 2006;12:301-303. [PubMed] [DOI] |
| 5. | Cardona K, Korbutt GS, Milas Z, Lyon J, Cano J, Jiang W, Bello-Laborn H, Hacquoil B, Strobert E, Gangappa S. Long-term survival of neonatal porcine islets in nonhuman primates by targeting costimulation pathways. Nat Med. 2006;12:304-306. [PubMed] [DOI] |
| 6. | Korbutt GS. The International Xenotransplantation Association consensus statement on conditions for undertaking clinical trials of porcine islet products in type 1 diabetes--chapter 3: Pig islet product manufacturing and release testing. Xenotransplantation. 2009;16:223-228. [PubMed] [DOI] |
| 7. | Kim JH, Kim HI, Lee KW, Yu JE, Kim SH, Park HS, Park CG, Ihm SH, Ha J, Kim SJ. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 2007;14:60-66. [PubMed] [DOI] |
| 8. | Elliott RB. Towards xenotransplantation of pig islets in the clinic. Curr Opin Organ Transplant. 2011;16:195-200. [PubMed] [DOI] |
| 9. | Dufrane D, Gianello P. Pig islets for clinical islet xenotransplantation. Curr Opin Nephrol Hypertens. 2009;18:495-500. [PubMed] [DOI] |
| 10. | Jin SM, Shin JS, Kim KS, Gong CH, Park SK, Kim JS, Yeom SC, Hwang ES, Lee CT, Kim SJ. Islet isolation from adult designated pathogen-free pigs: use of the newer bovine nervous tissue-free enzymes and a revised donor selection strategy would improve the islet graft function. Xenotransplantation. 2011;18:369-379. [PubMed] [DOI] |
| 12. | van der Windt DJ, Bottino R, Casu A, Campanile N, Smetanka C, He J, Murase N, Hara H, Ball S, Loveland BE. Long-term controlled normoglycemia in diabetic non-human primates after transplantation with hCD46 transgenic porcine islets. Am J Transplant. 2009;9:2716-2726. [PubMed] [DOI] |
| 14. | Sumi S. Regenerative medicine for insulin deficiency: creation of pancreatic islets and bioartificial pancreas. J Hepatobiliary Pancreat Sci. 2011;18:6-12. [PubMed] [DOI] |