修回日期: 2012-03-30
接受日期: 2012-07-03
在线出版日期: 2012-07-18
目的: 探讨钙调蛋白(CaM)基因在胃癌组织中的表达及其启动子区甲基化水平与幽门螺杆菌(Helicobacter pylori, H. pylori)感染的关系.
方法: 用实时荧光定量PCR法分别检测30例胃癌组织、癌周组织及转移淋巴结组织中CaM基因的表达量, 并分析其表达量与H. pylori感染的关系. 体外建立H. pylori感染胃癌细胞的实验模型和H. pylori细胞毒素相关蛋白A(cagA)基因稳定转染胃癌细胞的实验模型, 以未处理的胃癌细胞为对照, 用亚硫酸氢盐修饰后测序法检测实验模型细胞中CaM基因启动子区甲基化水平.
结果: 胃癌组织中CaM基因的表达量是癌周组织的2.08倍(P<0.05); H. pylori感染组中CaM基因的表达量是无H. pylori感染组的6.11倍(P<0.01), H. pylori及其毒素蛋白CagA可引起CaM基因启动子区-276位点发生去甲基化修饰.
结论: H. pylori感染通过所分泌的毒力因子CagA诱导胃癌细胞中CaM基因启动子区去甲基化修饰, 从而上调胃癌组织中CaM基因的表达.
引文著录: 周建奖, 王妍, 谢渊, 赵艳, 谷颖. 幽门螺杆菌对胃癌细胞中钙调蛋白基因启动子区去甲基化的诱导作用. 世界华人消化杂志 2012; 20(20): 1838-1842
Revised: March 30, 2012
Accepted: July 3, 2012
Published online: July 18, 2012
AIM: To explore the expression of Calmodulin (CaM) gene in gastric cancer tissue and the relationship between the methylation level of the CaM gene promoter and Helicobacter pylori (H. pylori) infection.
METHODS: The expression of the CaM gene in 30 cases of gastric cancer and matched tumor-adjacent gastric tissue and metastatic lymph nodes was assessed by real-time fluorescence quantitative PCR. The relationship between CaM gene expression and H. pylori infection was analyzed. Methylation of CpG islands in the CaM gene promoter was measured by bisulfite modified sequencing method in gastric cancer cells infected with H. pylori and stably transfected with the H. pylori cytotoxin-associated protein A (cagA) gene.
RESULTS: The relative expression level of the CaM gene in cancer tissue was 2.08 times higher than that in tumor-adjacent gastric tissue (P < 0.05). The relative expression level of the CaM gene in H. pylori-positive gastric cancer was 6.11 times higher than that in the H. pylori-negative group (P < 0.05). The demethylation at -276 bp in the CaM gene promoter was detected in H. pylori-infected and cagA-overexpressed gastric cancer cells.
CONCLUSION: H. pylori, though secreting the virulence factor CagA, up-regulates the expression of the CaM gene in gastric cancer possibly by inducing the demethylation of the CaM promoter.
- Citation: Zhou JJ, Wang Y, Xie Y, Zhao Y, Gu Y. Helicobacter pylori induces demethylation of the Calmodulin gene promoter in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1838-1842
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1838
胃癌是严重危害人类健康的恶性肿瘤之一, 其死亡率居全球肿瘤相关死亡的第2位[1]. 2006年的调查显示, 我国胃癌死亡率分别居男性和女性恶性肿瘤死因的第3位和第2位[2]. 虽然胃癌的发病机制目前尚不清楚, 但大量的研究证明幽门螺杆菌(Helicobacter pylori, H. pylori)感染与胃癌的发生发展密切相关, 是引起胃癌的重要因素[3-5]. H. pylori于1994年被世界卫生组织列为胃癌的第1致癌原, 细胞毒素相关蛋白A(cytotoxin-associated protein A, CagA)是H. pylori分泌的一种重要毒力因子, 并发现cagA阳性菌株比cagA阴性菌株有更大的毒性[6-10]. 本室运用蛋白质组学的方法在H. pylori感染和高表达cagA的胃癌细胞中发现钙调蛋白(Calmodulin, CaM)表达上调[11], 推测其可能参与H. pylori感染致胃癌的发病机制. 因此, 本研究定量检测了CaM基因在人胃癌组织中的表达及其与H. pylori感染的关系, 并探讨H. pylori感染与CaM基因启动子区CpG岛甲基化修饰的关系, 为胃癌的发病机制提供一定线索.
2005-01/2009-12贵阳医学院附属医院胃癌根治术后经病理检查确诊的胃癌标本30例, 男23例, 女7例, 年龄38-77岁. 分别取术后胃癌组织、癌周切缘组织(距肿瘤边缘>3 cm)及胃周淋巴结, 20-30 min内液氮快速冷冻. 癌周切缘组织经术后病理检查未见肿瘤细胞, 淋巴结组织为术中清扫的胃周淋巴结, 经病理检查确诊有转移. 本研究得到了患者的知情同意及医院伦理委员会批准.
1.2.1 CaM基因的定量检测: TRIzol(Invitrogen公司)一步法分别提取癌周组织、胃癌组织及淋巴结组织的总RNA, 反转录成cDNA. 以各组织cDNA为模板, 在Step-one plus型实时荧光定量PCR仪(ABI公司)检测CaM基因的表达, 用次黄嘌呤鸟嘌呤磷酸核糖基转移酶1(hypoxanthine-guanine phosphoribosyl-transferas1, HPRT1)作为内参基因, 引物序列见表1. 反应条件如下: 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 共40个循环. 收集CaM基因的荧光信号, 以HPRT1为内参基因、癌周组织为对照组计算基因相对表达量2-△△Ct, △△Ct = 处理组(CtCaM-CtHPRT1)-对照组(CtCaM-CtHPRT1). 用融解曲线监测各样本PCR反应的特异性, 相对标准曲线计算PCR反应的扩增效率.
| 基因 | 引物序列(5'-3') | 产物(bp) |
| CaM | 上游: TGGAGACGGACAAGTCAACTAT | |
| 下游: GACAGGACCACCAACCAATAC | 245 | |
| HPRT1 | 上游: TGAGGATTTGGAAAGGGTGT | |
| 下游: GAGCACACAGAGGGCTACAA | 118 | |
| 16S rRNA | 上游: GCTAAGAGAT CAGCCTATGTC | |
| 下游: CCGTGTCTCA GTTCCAGTGT | 118 | |
| 甲基化CaM1 | 上游: AAGAGGATTAATTTTTTTTAGGAGG | |
| 下游: CAACCTCACCCCACCTAAATA | 250 | |
| 甲基化CaM2 | 上游: GTTGAGGTGGGAGGGTTATTTA | |
| 下游: TCCCAACACCACTACCGAA | 392 | |
| 甲基化CaM3 | 上游: TTTTGGTAGTGGTGTTGGGA | |
| 下游: AACAAACAAAACAACTAAAAATCTAAA | 285 |
1.2.2 胃组织中H. pylori感染的检测及分组: 酚-氯仿法提取癌周组织和胃癌组织的DNA, PCR法扩增H. pylori的16S rRNA基因, 2.0%琼脂糖凝胶电泳检测. 根据胃组织中H. pylori的感染状态分为4组, 癌周组织H. pylori感染组和未感染组及胃癌组织H. pylori感染组和未感染组, 以癌周组织H. pylori未感染组为对照组, 计算各组中CaM基因的相对表达量.
1.2.3 CaM基因启动子区甲基化水平的检测: 人胃癌细胞SGC-7901(中科院上海细胞库)用含100 mL/L胎牛血清和双抗(青霉素100 U/mL, 链霉素100 U/mL)的RPMI 1640培养基(HyClone公司)于50 mL/L CO2、37 ℃恒温培养. 冻存的H. pylori标准菌株NCTC11637(cagA阳性, 中国幽门螺杆菌菌株管理与保藏中心馈赠)复苏后接种于哥伦比亚血琼脂板(Oxoid公司), 微需氧环境(50 mL/L O2、100 mL/L CO2、850 mL/L N2、37 ℃)培养3 d收菌备用.
将H. pylori悬于PBS, 用麦氏比浊法调细菌浓度达15×108个/mL, 按照细菌与细胞比例1 000:1感染胃癌细胞株SGC-7901, 6 h后收集细胞备用. 稳定表达cagA的SGC-7901胃癌细胞株由课题组保存, 用Zeocin 100 mg/L(Invitrogen公司)维持培养, 收集生长状态良好的细胞备用. 以未处理SGC-7901细胞作为对照. 提取上述3种细胞的DNA, 用EZDNA甲基化试剂盒(亚硫酸氢盐修饰后测序法, BSP, 美国)对其进行处理, 按说明书操作. 将修饰后的DNA作为模板扩增CaM基因的启动子区CpG岛, 分为CaM1、CaM2和CaM3三个片段扩增, 引物序列见表1. PCR反应条件如下: 96 ℃ 10 min; 94 ℃ 40 s, 60 ℃ 40 s, 72 ℃ 40 s, 共40个循环; 72 ℃ 10 min. 将CaM1、CaM2、CaM3基因片段分别与pMD®20-T载体(宝生物公司)连接, 转化大肠杆菌DH5α, 提取阳性克隆中质粒DNA, 双酶切鉴定后测序, 比对3组细胞中CaM1、CaM2、CaM3基因片段序列, 寻找甲基化修饰位点.
统计学处理 多样本比较采用SPSS13.0软件的单因素方差分析, 两样本比较用独立t检验, P<0.05为差异有显著性.
每例标本CaM和HPRT1基因的熔解曲线均为单峰, 定量PCR反应的特异性较高. CaM和HPRT1基因的扩增效率在90%-109%之间, 满足2-△△Ct计算基因表达量的条件. 结果显示胃癌组织中CaM基因的表达量是癌周组织的2.08倍(表2).
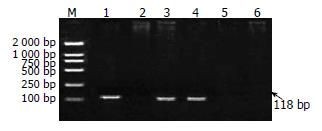
用PCR法扩增每例胃癌组织中H. pylori 16S rRNA, 发现30例标本中有20例H. pylori 16S rRNA基因阳性(图1), H. pylori感染的阳性率为67%.
根据胃组织中H. pylori的感染状态分为4组. 结果发现仅有胃癌组织H. pylori感染组中CaM基因的表达量被上调6.11倍, 表明H. pylori感染能上调胃癌组织中钙调蛋白基因的表达(表2).
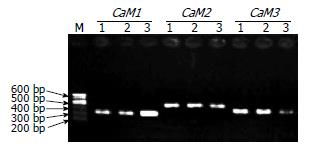
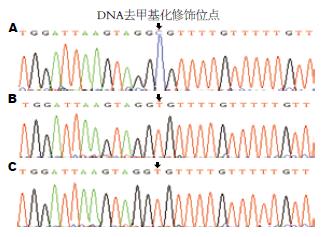
用H. pylori感染胃癌细胞株SGC-7901, 同时选取稳定高表达cagA的SGC-7901, 以未处理的SGC-7901作对照, 用亚硫酸氢盐处理3组细胞的DNA, 扩增CaM基因启动子区CpG岛, 成功获得CaM1、CaM2及CaM3三段PCR产物(图2). 测序鉴定后序列比对发现H. pylori感染及cagA基因稳定转染的细胞中CaM基因启动子区-276位点的碱基从胞嘧啶(C)变成了胸腺嘧啶(T), 发生了去甲基化修饰(图3).
长期的研究证明, H. pylori的感染是胃相关疾病的重要因素, 其分泌的毒力因子CagA蛋白是导致胃癌的主要原因之一[12-14]. 研究发现当H. pylori感染胃上皮细胞后, 分泌毒力因子CagA并将其注入细胞, 调控细胞生长和分化相关的信号通路, 促进慢性胃炎的转化而致癌变[15,16]. CaM是一种重要的钙结合蛋白, 与Ca2+结合后被激活, 而活化的CaM激活其下游的多个信号通路参与细胞增生、有丝分裂、神经传导及基因转录等, CaM还在细胞核内参与前mRNA的剪切和调控核糖体聚合等功能, 是引起细胞癌变的重要分子之一[17]. Choi和Tomás等[18,19]的研究发现CaM与细胞周期调节蛋白E相互作用, 参与调节细胞从G1到S期的进程, 而使用其抑制剂抑制细胞分裂, 使细胞停滞在G1期. Zhao等[20]的研究也发现在肝细胞癌中CaM与PI3K结合, 促进细胞增殖. 本研究也发现人胃癌组织中CaM基因的表达量显著高于癌周组织(P<0.05), 且CaM基因的高表达与H. pylori感染相关, H. pylori感染可以上调胃癌组织中CaM基因的表达(P<0.01). 本研究中虽然CaM基因在转移淋巴结中的表达量高于癌周组织, 但没有统计学意义.
为了探讨H. pylori感染上调CaM基因表达的机制, 本研究在体外构建了2个实验模型: H. pylori感染胃癌细胞的实验模型和cagA基因稳定转染胃癌细胞的实验模型, 以未处理的胃癌细胞为对照, 研究H. pylori感染对CaM基因启动子区CpG岛甲基化修饰的影响.
DNA甲基化修饰作为一种重要的表观遗传学机制, 可引起调控细胞增殖和分化相关基因的表达异常而导致细胞癌变[21]. 有文献报道, DNA甲基化修饰是胃癌的一个促发因素, 被证实与胃癌的发生发展密切相关[22-25]. 2010年, Shin和Alves等[26,27]检测临床胃癌组织中相关基因的甲基化水平, 发现H. pylori的感染引起上皮钙粘连素、周期蛋白依赖性激酶抑制因子2A(CDKN2A)等多个基因甲基化水平增加, 且CDKN2A基因启动子区甲基化水平的改变依赖不同的H. pylori表型. H. pylori感染引起的炎性反应也是促进DNA甲基化水平变化的原因之一. Niwa等[28]发现H. pylori的感染引起胃组织中基因高甲基化的同时伴随炎症相关基因如白介素1β、一氧化氮合酶2和肿瘤坏死因子等基因发生甲基化水平改变, 而抑制炎性反应会抑制这些基因的甲基化水平. 此外, H. pylori感染的胃组织中其他基因的甲基化水平也有改变[29,30]. 但尚未发现H. pylori感染与CaM基因的相关报道.
DNA的甲基化通常发生在启动子区的CpG岛, 本研究针对CaM基因启动子区CpG岛设计3对引物, 用亚硫酸氢盐修饰后测序法(BSP)检测其甲基化水平. 原理是通过亚硫酸盐处理, 使DNA中未发生甲基化的胞嘧啶(C)脱氨基转变成尿嘧啶(U), 而甲基化的胞嘧啶保持不变, 经PCR扩增后尿嘧啶全部转为胸腺嘧啶(T), 将PCR产物与T载体连接后测序, 通过与对照细胞的基因序列比对, 判断是否发生甲基化水平的改变. 本研究成功获得了模型细胞中CaM基因启动子区CpG岛的3段PCR产物, 经测序比对后不仅发现在H. pylori感染的胃癌细胞中CaM基因启动子区-276位点发生去甲基化改变, 而且在cagA基因稳定转染的胃癌细胞中CaM基因启动子区同样的位点也发生了去甲基化改变. 表明H. pylori感染通过所分泌的毒力因子CagA引起了CaM基因启动子区去甲基化, 可能与H. pylori感染上调人胃癌组织中CaM基因的表达有关, 该结果为揭示H. pylori感染与胃癌的发生、发展提供新的线索.
大量的研究证明幽门螺杆菌(H. pylori)感染与胃癌的发生发展密切相关, 是引起胃癌的重要因素, 但其机制并不清楚.
李瑜元, 教授, 广州市第一人民医院内科
H. pylori是胃癌的"Ⅰ类致癌原", 细胞毒素相关蛋白A(CagA)是H. pylori分泌并注入胃上皮细胞的重要毒力因子, 其引起胃癌的分子机制是目前研究热点.
目前认为DNA甲基化修饰是肿瘤的促发因素. 而钙调蛋白又是引起细胞癌变的重要分子, 已被证明与胃癌的发生发展密切相关, 但H. pylori与钙调蛋白基因的表达尚未见报道.
本研究首次发现H. pylori通过分泌的毒力因子CagA诱导钙调蛋白基因启动子区去甲基化, 上调人胃癌组织中钙调蛋白基因的表达, 参与胃癌的发生发展.
本研究初步探讨了H. pylori与钙调蛋白二者间的关系, 研究有一定科学性和创新性, 具有一定的借鉴意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | 赵 平, 孔 灵芝. 中国肿瘤死亡报告. 北京: 人民卫生出版社 2010; 52-62. |
| 3. | Costamagna G, Cesaro P. Early gastric cancer: detection and endoscopic treatment. Ann Ital Chir. 2012;83:183-191. [PubMed] |
| 4. | Ruggiero P. Helicobacter pylori infection: what's new. Curr Opin Infect Dis. 2012;25:337-344. [PubMed] |
| 6. | Machado AM, Figueiredo C, Seruca R, Rasmussen LJ. Helicobacter pylori infection generates genetic instability in gastric cells. Biochim Biophys Acta. 2010;1806:58-65. [PubMed] |
| 8. | Bronte-Tinkew DM, Terebiznik M, Franco A, Ang M, Ahn D, Mimuro H, Sasakawa C, Ropeleski MJ, Peek RM, Jones NL. Helicobacter pylori cytotoxin-associated gene A activates the signal transducer and activator of transcription 3 pathway in vitro and in vivo. Cancer Res. 2009;69:632-639. [PubMed] [DOI] |
| 11. | 陈 娴, 周 建奖, 谢 渊, 赵 艳, 徐 文杰, 王 妍. 幽门螺杆菌毒素蛋白CagA诱导的蛋白的差异分析及其基因在胃癌组织中的表达. 中国生物化学与分子生物学报. 2011;27:55-62. |
| 12. | Helicobacter pylori promotes apoptosis, activates cyclooxygenase (COX)-2 and inhibits heat shock protein HSP70 in gastric cancer epithelial cells. Inflamm Res. 2012; May 19. [Epub ahead of print]. [PubMed] |
| 14. | 吴 莺, 李 翔, 周 红, 范 钰, 张 尤历, 沈 琰, 何 亚龙. 幽门螺杆菌对胃癌细胞BGC-823形态及凋亡相关基因表达的影响. 世界华人消化杂志. 2011;19:1767-1772. [DOI] |
| 15. | 谢 渊, 周 建奖, 赵 艳, 汪 苏, 陈 娴. JAK2、ERK1干扰对幽门螺杆菌毒素相关蛋白CagA调控胃泌素基因表达的影响. 世界华人消化杂志. 2010;18:2317-2321. [DOI] |
| 17. | Coticchia CM, Revankar CM, Deb TB, Dickson RB, Johnson MD. Calmodulin modulates Akt activity in human breast cancer cell lines. Breast Cancer Res Treat. 2009;115:545-560. [PubMed] [DOI] |
| 18. | Choi J, Chiang A, Taulier N, Gros R, Pirani A, Husain M. A calmodulin-binding site on cyclin E mediates Ca2+-sensitive G1/s transitions in vascular smooth muscle cells. Circ Res. 2006;98:1273-1281. [PubMed] [DOI] |
| 19. | Tomás M, Marín MP, Portolés M, Megías L, Gómez-Lechón MJ, Renau-Piqueras J. Ethanol affects calmodulin and the calmodulin-binding proteins neuronal nitric oxide synthase and alphaII-spectrin (alpha-fodrin) in the nucleus of growing and differentiated rat astrocytes in primary culture. Toxicol In Vitro. 2007;21:1039-1049. [PubMed] [DOI] |
| 20. | Zhao L, Zhao Q, Lu R, Fu Z, Zhu Z, Jia J, Wang S, Shi L, Jian X, Yao Z. Effects of tyroserleutide on gene expression of calmodulin and PI3K in hepatocellular carcinoma. J Cell Biochem. 2008;103:471-478. [PubMed] [DOI] |
| 21. | Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ. Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions. Hum Pathol. 2009;40:1534-1542. [PubMed] [DOI] |
| 23. | Hong SJ, Oh JH, Jeon EJ, Min KO, Kang MI, Choi SW, Rhyu MG. The overmethylated genes in Helicobacter pylori-infected gastric mucosa are demethylated in gastric cancers. BMC Gastroenterol. 2010;10:137. [PubMed] [DOI] |
| 24. | Tahara T, Shibata T, Nakamura M, Yamashita H, Yoshioka D, Okubo M, Yonemura J, Maeda Y, Maruyama N, Kamano T. Increased number of CpG island hypermethylation in tumor suppressor genes of non-neoplastic gastric mucosa correlates with higher risk of gastric cancer. Digestion. 2010;82:27-36. [PubMed] [DOI] |
| 25. | Ferrasi AC, Pinheiro NA, Rabenhorst SH, Caballero OL, Rodrigues MA, de Carvalho F, Leite CV, Ferreira MV, Barros MA, Pardini MI. Helicobacter pylori and EBV in gastric carcinomas: methylation status and microsatellite instability. World J Gastroenterol. 2010;16:312-319. [PubMed] [DOI] |
| 26. | Shin CM, Kim N, Jung Y, Park JH, Kang GH, Kim JS, Jung HC, Song IS. Role of Helicobacter pylori infection in aberrant DNA methylation along multistep gastric carcinogenesis. Cancer Sci. 2010;101:1337-1346. [PubMed] [DOI] |
| 27. | Alves MK, Lima VP, Ferrasi AC, Rodrigues MA, De Moura Campos Pardini MI, Rabenhorst SH. CDKN2A promoter methylation is related to the tumor location and histological subtype and associated with Helicobacter pylori flaA(+) strains in gastric adenocarcinomas. APMIS. 2010;118:297-307. [PubMed] [DOI] |
| 28. | Niwa T, Tsukamoto T, Toyoda T, Mori A, Tanaka H, Maekita T, Ichinose M, Tatematsu M, Ushijima T. Inflammatory processes triggered by Helicobacter pylori infection cause aberrant DNA methylation in gastric epithelial cells. Cancer Res. 2010;70:1430-1440. [PubMed] [DOI] |
| 29. | Kitajima Y, Ohtaka K, Mitsuno M, Tanaka M, Sato S, Nakafusa Y, Miyazaki K. Helicobacter pylori infection is an independent risk factor for Runx3 methylation in gastric cancer. Oncol Rep. 2008;19:197-202. [PubMed] |
| 30. | Qian X, Huang C, Cho CH, Hui WM, Rashid A, Chan AO. E-cadherin promoter hypermethylation induced by interleukin-1beta treatment or H. pylori infection in human gastric cancer cell lines. Cancer Lett. 2008;263:107-113. [PubMed] [DOI] |