修回日期: 2012-05-22
接受日期: 2012-06-19
在线出版日期: 2012-07-18
目的: 探讨18α甘草酸(18α glycyrrhizin, 18α-GL)对四氯化碳(carbon tetrachloride, CCl4)诱导的大鼠肝纤维化的作用.
方法: 建立动物模型: 采用40% CCl4皮下注射方法建立肝纤维化模型. 动物分为对照组、肝纤维化模型组和18α-GL干预组(高、中、低剂量). 8 wk后, 做HE和Masson染色观察病理情况, 并检测肝脏组织丙二醛(malondialdehyde, MDA)、4-羟基壬烯酸(hydroxynonnenal, HNE)含量及超氧化物酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)活力.
结果: 18α-GL能够显著改善纤维化大鼠肝脏组织病理学变化, 发现在模型组中MDA和HNE含量显著升高(均P<0.05), 而18α-GL能够提高肝脏组织中SOD和GSH-PX活力(均P<0.05), 抑制脂质过氧化物MDA和HNE表达.
结论: 18α-GL能够改善肝纤维化大鼠病理, 具有抗氧化和抗纤维化作用.
引文著录: 丁天鹏, 曲颖, 陆伦根, 施根林, 王若飞. 18α甘草酸对CCl4诱导的肝纤维化大鼠氧化应激的影响. 世界华人消化杂志 2012; 20(20): 1819-1823
Revised: May 22, 2012
Accepted: June 19, 2012
Published online: July 18, 2012
AIM: To investigate the effect of 18α-glycyrrhizin (18α-GL) on oxidative stress in rats with experimental liver fibrosis.
METHODS: Male SD rats were randomly divided into five groups: control group, fibrosis group, low-, medium-, and high-dose GL groups. Except the control group, liver fibrosis was induced by subcutaneous injection of 40% CCl4 for 8 weeks in rats of the other groups. The three GL groups were treated with different doses of GL (6.25, 12.5, 25 mg/kg, respectively). All the rats were sacrificed at the end of the 8th week. Histopathological changes in the liver tissue were evaluated by HE staining and Masson collagen staining. The contents of MDA and HNE and the activity of SOD and GSH-PX in liver tissue homogenate were determined.
RESULTS: 18α-GL could inhibit CCl4-induced liver fibrosis. The contents of MDA and HNE were elevated in the liver fibrosis group (both P < 0.05), but 18α-GL could markedly increase SOD and GSH-PX activity (both P < 0.05) and reduce the levels of MDA and HNE to protect the liver from damage.
CONCLUSION: 18α-GL can ameliorate hepatic histopathological changes and reduce hepatic lipid peroxidation, thus exerting antioxidant and antifibrotic effects in rats with experimental liver fibrosis.
- Citation: Ding TP, Qu Y, Lu LG, Shi GL, Wang RF. 18α-glycyrrhizin ameliorates oxidative stress in rats with CCl4-induced liver fibrosis. Shijie Huaren Xiaohua Zazhi 2012; 20(20): 1819-1823
- URL: https://www.wjgnet.com/1009-3079/full/v20/i20/1819.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i20.1819
肝纤维化是各种原因如病毒、酒精、代谢性疾病、胆汁淤积、毒物、自身免疫性疾病等所导致的肝脏损伤后修复的一种病理状态[1-3]. 肝纤维化发生发展的细胞及其分子机制的研究, 为这一疾病的预防提供了依据. 许多临床和动物实验均提示了肝纤维化的发生发展与氧化应激、氧自由基损伤和脂质过氧化等有关[4-6]. 临床上甘草制剂广泛应用于肝病治疗, 对于慢性病毒性肝炎患者, 该类药物均有很好地改善临床症状和降低血清转氨酶的效果, 是一种肝细胞保护剂, 具有抗炎、保护肝细胞膜及改善肝功能的作用[7-9]. 本实验拟从氧化应激方面探讨18α甘草酸(18α glycyrrhizin, 18α-GL)对CCl4诱导的大鼠肝纤维化的作用机制.
健康♂Sprague-Dawley(SD)大鼠, SPF级, 体质量180-220 g, 由中科院上海实验动物中心提供, 饲养于上海交通大学医学院实验动物饲养中心, 制备CCl4肝损伤纤维化模型. 所有动物自由进食、饮水, 温度、湿度符合标准, 明暗12 h/12 h循环. 18α甘草酸(江苏正大天晴药业股份有限公司提供), 制成浓度分别为2.5、1.25和0.6 g/L的溶液; 考马斯亮兰蛋白测定试剂盒、MDA、SOD和GSH-PX检测试剂盒购自南京建成生物工程研究所; 蛋白酶抑制剂(No. P8340)购自Sigma公司; OxiSelectTM HNE-His Adduct ELISA Kit购自Cell Biolabs公司; 紫外/可见分光光度计(Ultraspec2000型)购自Pharmacia Biotech公司; 酶标分析仪(Microplate Reader, Model 550)购自美国Bio-Rad公司.
1.2.1 分组及造模: 所有大鼠适应性喂养1 wk, 随机分为5组, 分别为正常对照组(control group)、肝纤维化造模组(fibrosis group)、低剂量GL治疗组(6.25 mg/kg, low dose GL group)、中剂量GL治疗组(12.5 mg/kg, intermediate dose GL group)和高剂量GL治疗组(25 mg/kg, high dose GL group). 后4组大鼠给予皮下注射40%CCl4溶液(纯橄榄油配制)0.5 mL/100 g, 随后给予0.2 mL/100 g, 2次/wk(共8 wk), 建立大鼠肝纤维化模型. 正常对照组相同剂量橄榄油皮下注射. GL干预组建模同时给予相应剂量的GL溶液腹腔注射, 1次/d(共8 wk). 第8周末, 动物麻醉后, 取肝右叶2小块肝组织于冰生理盐水快速冲洗后放10%中性甲醛溶液内固定, 其余放液氮贮存.
1.2.2 肝组织MDA、SOD、GSH-PX和HNE的含量检测: 肝组织组织丙二醛(malondialdehyde, MDA)、超氧化物酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)和4-羟基壬烯酸(hydroxynonnenal, HNE)检测按试剂盒推荐的方法进行.
1.2.3 借助HE和Masson染色观察肝组织纤维化程度: 取大鼠组织, 4%甲醛溶液固定, 石蜡包埋, 切片, 常规HE和Masson染色, 光学显微镜下观察肝组织纤维化程度[10]. S0: 无纤维化; S1: 有些汇管区纤维化±短纤维隔; S2: 汇管区纤维化, 纤维隔形成; S3: 多数汇管区纤维化, 偶有P-P汇管桥接纤维化; S4: 汇管区纤维化伴明显的P-P汇管桥接纤维化和P-C汇管-中央桥接纤维化; S5: 明显P-P汇管桥接纤维化/P-C汇管-中央桥接纤维化, 偶有结节; S6: 肝硬化.
统计学处理 用SPSS11.0统计软件, 数据以mean±SD表示, 进行方差分析. 多组间采用One-Way ANOVA分析, 病理学半定量资料用Kruskal-Wallis检验. P<0.05为具有显著性差异.
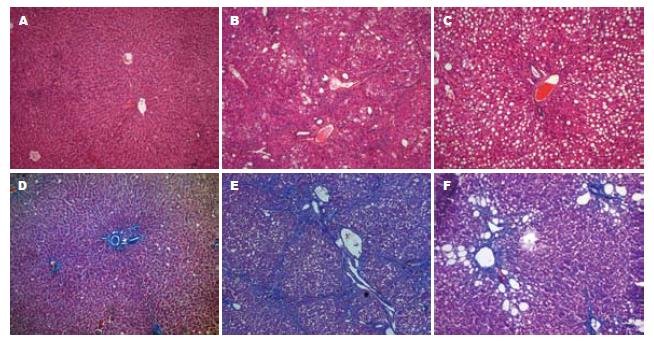
正常对照组大鼠生长情况良好, 肝纤维化模型组大鼠一般情况差, 精神萎靡, 皮毛光泽度欠佳, 体质量增长缓慢. 采用HE染色及Masson胶原纤维染色后, 显微镜下观察可见, 正常组肝组织小叶结构完整, 无肝细胞脂肪变或坏死、无炎性细胞浸润及纤维组织增生; 模型组肝组织病理损害严重, 肝细胞明显肿胀变性, 尤以脂肪变性为甚, 部分出现气球样变性, 肝小叶结构被破坏, 肝小叶周围明显坏死, 纤维组织增生并形成假小叶(图1). 18α-GL干预组肝组织未形成明显的假小叶, 只有少量纤维组织增生, 多仅局限于汇管区, 而肝细胞脂肪变性为主. 各组纤维化分期见表1.
| 病理学分期 | P值 | |
| 对照组 | 0 | 0.000 |
| 肝纤维化组 | 5.17±0.83 | |
| 低剂量GL组 | 4.20±1.03 | 0.034 |
| 中剂量GL组 | 3.83±1.11 | 0.006 |
| 高剂量GL组 | 3.58±1.31 | 0.005 |
作为脂质过氧化指标, 模型组大鼠肝脏组织中检测出的MDA和HNE含量较正常组有显著升高(P<0.05), 而各剂量用药组的大鼠肝组织中, MDA和HNE的含量都较模型组有下降, 尤其是中高剂量更有显著性差异(P<0.05). SOD和GSH-PX能清除自由基, 保护细胞免受损伤, 反映了机体的抗氧化能力. 模型组中其含量较对照组显著下降, 反映了CCl4可诱导产生自由基, 消耗机体内的抗氧化酶; 而各个用药组大鼠肝脏组织中SOD和GSH-PX的活力都保持在较高的水平(表2), 说明18α-GL能够提高大鼠肝脏组织中SOD和GSH-PX的活力.
| HNE(mg/L) | MDA(nmol/mg Prot) | SOD(U/mg Prot) | GSH-PX(U/mg Prot) | |
| 对照组 | 1.47±0.23c | 1.35±0.31c | 121.18±15.66c | 70.14±7.05ce |
| 肝纤维化组 | 3.16±0.69ae | 3.12±0.76ae | 90.12±20.98ae | 50.13±5.50ae |
| 低剂量GL组 | 3.05±0.70ae | 2.77±0.71ae | 98.36±13.92ae | 56.50±6.86a |
| 中剂量GL组 | 2.40±0.57ac | 1.88±0.48c | 117.52±14.72c | 58.15±6.36ac |
| 高剂量GL组 | 2.00±0.56c | 1.36±0.42c | 122.82±25.54c | 62.33±5.78ac |
肝纤维化是许多肝脏疾病的一个中间发展环节, 肝脏纤维化改变后若得不到有效治疗, 最终会发展为肝硬化、甚至肝癌和肝衰竭, 而目前认为纤维化病理过程可逆, 因而治疗肝纤维化也成为肝病治疗的一个重要环节[11,12]. 随着对肝纤维化形成机制的深入认识, 纤维化检测手段的不断改善, 对于治疗肝纤维化药物的研究和开发取得了一定进展, 这些药物通过不同的环节和作用机制对肝脏纤维化进行干预, 并且保护了肝脏的功能. 由于植物药来源于自然, 具有作用温和、毒性低等特点, 目前已经有多种植物药在体外细胞实验、体内动物实验甚至临床实验中表现出良好的应用前景[13-15]. 我国具有悠久的中医中药研究应用历史, 又具有丰富的药用植物资源, 深入研究和开发植物来源药物用于肝纤维化的治疗显示了其广阔的应用前景. 甘草为多年生草本植物甘草的根及根茎, 为临床上最为常用的中草药之一[16,17]. 我们实验采用18α-GL来研究其在CCl4大鼠肝纤维化中的作用和机制.
CCl4为一种选择性肝毒性药物, 其作用机制为进入肝脏后引起肝小叶内中央肝静脉周围细胞坏死, 导致纤维增生, 该模型适合于肝纤维化发生、发展过程的动态观察和研究, 是目前国内外常采用的动物模型[18-20]. 我们发现CCl4皮下注射8 wk后, 肝组织病理学检查可见肝组织内厚薄不一的纤维间隔包绕肝小叶, 形成假小叶, 具有肝纤维化的特征, 表明造模成功. 而且病理组织学观察及分期发现18α-GL能改善CCl4大鼠肝纤维程度, 尤其是高剂量组改善最明显, 说明18α-GL能够预防实验性大鼠肝纤维化的进展.
我们实验中还发现模型组大鼠肝脏组织匀浆中脂质过氧化产物MDA和HNE的含量明显升高, 抗氧化酶SOD和GSH-PX活力明显降低, 提示氧化应激在肝纤维化的发生发展中起到了重要作用. Wang等[21]发现CCl4诱导肝纤维化模型中MDA以及促炎症因子的显著性升高, 而GSH-PX和SOD显著降低. Tipoe等[5]也在肝纤维化小鼠模型中发现了氧化应激状态, 并认为抗氧化剂通过减轻氧化应激而保护肝损伤和改善纤维化. Ferré等[22]在肝硬化患者中发现在调节OS和脂类代谢中具有重要抗氧化活性的对氧磷酶-1(paraoxonase-1, PON-1)在血清和肝脏中显著增加, 但活性显著降低, 可能是PON-1在水解脂质过氧化后活性降低或者高密度脂蛋白的结构发生变化导致PON-1活性下降. 另外有报道ROS能促进HSC通过上调核转录因子KLF6(Kruppel-like factor 6)分泌TGF-β1[23], 并激活HSC转化为肌成纤维细胞[24]. 体外研究还发现CCl4单独作用培养的HSC并不引起其活化, 而将CCl4处理过的肝细胞条件培养液作用HSC, 可引起HSC活化[25], 同样经氧化应激处理过的肝细胞条件培养液也能引起HSC活化[26], 表明CCl4引起的肝纤维化中, 氧化应激主要通过诱导肝细胞损伤旁分泌刺激HSC活化.
正常状态下机体产生少量的ROS参与代谢, 在病理条件下, ROS产生过多或抗氧化系统活性下降, 可引发脂质过氧化反应损伤细胞膜使细胞受损[27]. ROS与生物膜的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质起脂质过氧化反应形成脂质过氧化产物(LPO)如MDA和HNE, 导致细胞膜、线粒体膜等生物膜结构的异常及功能障碍[28,29], 从而最终导致细胞结构和功能的改变, MDA和HNE含量间接反映了组织过氧化的损伤程度. 机体为了防御新陈代谢及其他生命活动中氧自由基的损伤和破坏, 在组织和细胞中建立和形成一套完善的抗氧化防御体系, 而SOD是这个体系中的一种重要金属酶. 检测SOD含量的变化可作为衡量肝损伤程度的指标. GSH-PX是机体内广泛存在的一种重要的催化H2O2分解的酶, 他特异性催化GSH与H2O2的反应, 进而清除有害的氧化代谢产物, 阻断脂质过氧化连锁反应, 从而保护细胞免收氧化应激损伤. GL的抗氧化作用也有报道, GL对硫唑嘌呤诱导的人肝细胞内GSH的减少也显示出有效的保护作用, 这种现象可能与甘草的某些成分能抑制自由基生成相关的酶和保护线粒体膜通透性, 进而减少反应性氧自由基积聚有关[30]. Tripathi等[31]研究丁基过氧化氢可使肝细胞内GSH下降、ROS升高、脂质过氧化、细胞内抗氧化防御功能受损、线粒体膜去极化、DNA破碎、染色体固缩、细胞色素C释放和半胱天冬酶激活. GL预处理后可减少丁基过氧化氢诱导的反应性氧自由基的生成, 使得GSH下降不明显. 我们实验中发现18α-GL干预组能够有效的提高SOD和GSH-PX酶的活力, 而显著降低MDA和HNE含量, 认为可以改善组织内氧化应激状态. 而对血清转氨酶的改善作用认为是通过药物的抗自由基损伤作用, 从而减少了自由基对肝细胞的破坏, 保护了肝细胞.
总之, 氧化应激是CCl4诱导大鼠肝纤维化的重要机制, 18α-GL能够明显改善纤维化大鼠组织病理学变化, 抑制CCl4诱导的肝纤维化进程, 可能机制通过诱导肝组织内SOD和GSH-PX酶的活力, 增强细胞的抗氧化能力, 阻断氧化应激过程, 降低脂质过氧化产物MDA和HNE产量, 而减少了对肝脏细胞长期攻击, 减轻肝损伤, 抑制纤维化进程.
肝纤维化是各种慢性肝病的共同病理基础, 国内外学者对中草药抗纤维化的作用机制进行了广泛研究.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
甘草酸(GL)是中药甘草的主要活性成分, 有广泛的药理功能, 可保护肝细胞.
肝纤维化的发生发展与氧化应激、氧自由基损伤和脂质过氧化等有关. GL通过抗炎、抗脂质过氧化、调节免疫和稳定溶酶体等作用, 可有效地防治实验性和临床各种肝损害, 为抗肝纤维化新途径提供了理论依据.
本研究采用CCl4诱导大鼠肝纤维化模型, 从氧化应激角度探讨18α甘草酸(18α-GL)对大鼠肝纤维化的作用, 表明18α-GL能够改善肝纤维化大鼠病理, 具有抗氧化和抗纤维化作用.
通过建立肝纤维化模型, 观察18α-GL对CCl4肝纤维化大鼠氧化应激的影响, 该研究是预防和治疗肝纤维化的重要课题, 相关内容有重要的参考价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25:195-206. [PubMed] [DOI] |
| 2. | Friedman SL. Liver fibrosis -- from bench to bedside. J Hepatol. 2003;38 Suppl 1:S38-S53. [PubMed] [DOI] |
| 3. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 4. | Simula MP, De Re V. Hepatitis C virus-induced oxidative stress and mitochondrial dysfunction: a focus on recent advances in proteomics. Proteomics Clin Appl. 2010;4:782-793. [PubMed] [DOI] |
| 5. | Tipoe GL, Leung TM, Liong EC, Lau TY, Fung ML, Nanji AA. Epigallocatechin-3-gallate (EGCG) reduces liver inflammation, oxidative stress and fibrosis in carbon tetrachloride (CCl4)-induced liver injury in mice. Toxicology. 2010;273:45-52. [PubMed] [DOI] |
| 6. | Clichici S, Catoi C, Mocan T, Filip A, Login C, Nagy A, Daicoviciu D, Decea N, Gherman C, Moldovan R. Non-invasive oxidative stress markers for liver fibrosis development in the evolution of toxic hepatitis. Acta Physiol Hung. 2011;98:195-204. [PubMed] [DOI] |
| 7. | Kumada H. Long-term treatment of chronic hepatitis C with glycyrrhizin [stronger neo-minophagen C (SNMC)] for preventing liver cirrhosis and hepatocellular carcinoma. Oncology. 2002;62 Suppl 1:94-100. [PubMed] [DOI] |
| 8. | Iino S, Tango T, Matsushima T, Toda G, Miyake K, Hino K, Kumada H, Yasuda K, Kuroki T, Hirayama C. Therapeutic effects of stronger neo-minophagen C at different doses on chronic hepatitis and liver cirrhosis. Hepatol Res. 2001;19:31-40. [PubMed] [DOI] |
| 9. | Veldt BJ, Hansen BE, Ikeda K, Verhey E, Suzuki H, Schalm SW. Long-term clinical outcome and effect of glycyrrhizin in 1093 chronic hepatitis C patients with non-response or relapse to interferon. Scand J Gastroenterol. 2006;41:1087-1094. [PubMed] [DOI] |
| 10. | Ishak K, Baptista A, Bianchi L, Callea F, De Groote J, Gudat F, Denk H, Desmet V, Korb G, MacSween RN. Histological grading and staging of chronic hepatitis. J Hepatol. 1995;22:696-699. [PubMed] [DOI] |
| 11. | Povero D, Busletta C, Novo E, di Bonzo LV, Cannito S, Paternostro C, Parola M. Liver fibrosis: a dynamic and potentially reversible process. Histol Histopathol. 2010;25:1075-1091. [PubMed] |
| 12. | Pinzani M, Rombouts K. Liver fibrosis: from the bench to clinical targets. Dig Liver Dis. 2004;36:231-242. [PubMed] [DOI] |
| 13. | Seeff LB, Curto TM, Szabo G, Everson GT, Bonkovsky HL, Dienstag JL, Shiffman ML, Lindsay KL, Lok AS, Di Bisceglie AM. Herbal product use by persons enrolled in the hepatitis C Antiviral Long-Term Treatment Against Cirrhosis (HALT-C) Trial. Hepatology. 2008;47:605-612. [PubMed] [DOI] |
| 14. | Wang R, Kong J, Wang D, Lien LL, Lien EJ. A survey of Chinese herbal ingredients with liver protection activities. Chin Med. 2007;2:5. [PubMed] [DOI] |
| 15. | Luk JM, Wang X, Liu P, Wong KF, Chan KL, Tong Y, Hui CK, Lau GK, Fan ST. Traditional Chinese herbal medicines for treatment of liver fibrosis and cancer: from laboratory discovery to clinical evaluation. Liver Int. 2007;27:879-890. [PubMed] [DOI] |
| 16. | Sato H, Goto W, Yamamura J, Kurokawa M, Kageyama S, Takahara T, Watanabe A, Shiraki K. Therapeutic basis of glycyrrhizin on chronic hepatitis B. Antiviral Res. 1996;30:171-177. [PubMed] [DOI] |
| 17. | Ashfaq UA, Masoud MS, Nawaz Z, Riazuddin S. Glycyrrhizin as antiviral agent against Hepatitis C Virus. J Transl Med. 2011;9:112. [PubMed] [DOI] |
| 18. | Desmyter L, Fan YD, Praet M, Jaworski T, Vervecken W, De Hemptinne B, Contreras R, Chen C. Rating of CCl(4)-induced rat liver fibrosis by blood serum glycomics. J Gastroenterol Hepatol. 2007;22:1148-1154. [PubMed] [DOI] |
| 19. | Huang Q, Xie Q, Shi CC, Xiang XG, Lin LY, Gong BD, Zhao GD, Wang H, Jia NN. Expression of angiotensin-converting enzyme 2 in CCL4-induced rat liver fibrosis. Int J Mol Med. 2009;23:717-723. [PubMed] |
| 20. | Muriel P, Moreno MG, Hernández Mdel C, Chávez E, Alcantar LK. Resolution of liver fibrosis in chronic CCl4 administration in the rat after discontinuation of treatment: effect of silymarin, silibinin, colchicine and trimethylcolchicinic acid. Basic Clin Pharmacol Toxicol. 2005;96:375-380. [PubMed] [DOI] |
| 21. | Wang H, Wei W, Wang NP, Gui SY, Wu L, Sun WY, Xu SY. Melatonin ameliorates carbon tetrachloride-induced hepatic fibrogenesis in rats via inhibition of oxidative stress. Life Sci. 2005;77:1902-1915. [PubMed] [DOI] |
| 22. | Ferré N, Marsillach J, Camps J, Mackness B, Mackness M, Riu F, Coll B, Tous M, Joven J. Paraoxonase-1 is associated with oxidative stress, fibrosis and FAS expression in chronic liver diseases. J Hepatol. 2006;45:51-59. [PubMed] [DOI] |
| 23. | Stärkel P, Sempoux C, Leclercq I, Herin M, Deby C, Desager JP, Horsmans Y. Oxidative stress, KLF6 and transforming growth factor-beta up-regulation differentiate non-alcoholic steatohepatitis progressing to fibrosis from uncomplicated steatosis in rats. J Hepatol. 2003;39:538-546. [PubMed] [DOI] |
| 24. | Isono M, Soda M, Inoue A, Akiyoshi H, Sato K. Reverse transformation of hepatic myofibroblast-like cells by TGFbeta1/LAP. Biochem Biophys Res Commun. 2003;311:959-965. [PubMed] [DOI] |
| 25. | Bedossa P, Houglum K, Trautwein C, Holstege A, Chojkier M. Stimulation of collagen alpha 1(I) gene expression is associated with lipid peroxidation in hepatocellular injury: a link to tissue fibrosis? Hepatology. 1994;19:1262-1271. [PubMed] |
| 26. | Svegliati Baroni G, D'Ambrosio L, Ferretti G, Casini A, Di Sario A, Salzano R, Ridolfi F, Saccomanno S, Jezequel AM, Benedetti A. Fibrogenic effect of oxidative stress on rat hepatic stellate cells. Hepatology. 1998;27:720-726. [PubMed] [DOI] |
| 28. | Magder S. Reactive oxygen species: toxic molecules or spark of life? Crit Care. 2006;10:208. [PubMed] [DOI] |
| 29. | Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing. Nature. 2000;408:239-247. [PubMed] [DOI] |
| 30. | Wu YT, Shen C, Yin J, Yu JP, Meng Q. Azathioprine hepatotoxicity and the protective effect of liquorice and glycyrrhizic acid. Phytother Res. 2006;20:640-645. [PubMed] [DOI] |
| 31. | Tripathi M, Singh BK, Kakkar P. Glycyrrhizic acid modulates t-BHP induced apoptosis in primary rat hepatocytes. Food Chem Toxicol. 2009;47:339-347. [PubMed] [DOI] |