修回日期: 2011-11-26
接受日期: 2011-12-23
在线出版日期: 2012-01-18
目的: 观察健脾疏肝方对非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的疗效以及对NASH大鼠肝脂代谢分子网络的影响.
方法: 将40只♂SD大鼠随机分成空白组、模型组、健脾疏肝方组、易善复组4组, 采用高脂饲料造模连续8 wk. 模型成立后, 改用普通饲料饲喂, 同时健脾疏肝方组及易善复组分别予健脾疏肝方浸膏和易善复混悬液灌胃, 模型组和空白组予去离子水灌胃, 连续4 wk; 实验结束后处死全部大鼠, 观察大鼠肝组织病理改变, 测定大鼠肝功、血脂、肝脂以及抗氧化指标水平, 观察大鼠肝组织SREBP-1c、SCAP、PPARa、PGC-1a、LXR mRNA表达.
结果: 健脾疏肝方可有效改善大鼠肝组织脂肪变性及炎症损伤, 降低肝功、血脂、肝脂水平, 提高抗氧化物质, 并可同时上调PPARa及PGC-1a, 下调SREBP-1c及SCAP mRNA表达(P<0.05, P<0.01), 且在改善大鼠肝指数、体质量, 降低谷丙转氨酶(ALT)水平、肝甘油三酯(TG)、MDA含量, 提高GSH-PX含量, 上调PPARa、PGC-1a mRNA表达等方面优于易善复(P<0.05, P<0.01).
结论: 健脾疏肝方可通过网络调控NASH肝脂代谢而防治NASH, 在今后研究中, 可将健脾疏肝方作为基础, 结合其他治法, 辨证施治.
引文著录: 苏冬梅, 诸葛丽, 李健, 李军祥. 健脾疏肝方对非酒精性脂肪性肝炎大鼠肝脂代谢分子网络的影响. 世界华人消化杂志 2012; 20(2): 91-99
Revised: November 26, 2011
Accepted: December 23, 2011
Published online: January 18, 2012
AIM: To evaluate the efficacy of Jianpishugan Decoction in the treatment of non-alcoholic steatohepatitis (NASH) and the effect of such treatment on hepatic lipid metabolism in rats with NASH.
METHODS: Forty male rats were randomly divided into four groups: blank control group, model group, Jianpishugan Decoction group, and Essentiale treatment group. Rats of all groups except the blank control group were fed a high-fat diet for eight weeks to induce NASH. The Jianpishugan Decoction and Essentiale treatment groups were treated with Jianpishugan Decoction and Essentiale for four weeks, respectively. Hepatic histopathological changes, serum transaminase, serum lipid, liver fat, SOD, MDA, GSH-PX and the mRNA expression of SREBP-1c, SCAP, PPARa, PGC-1a and LXR in the liver were examined.
RESULTS: Compared to the model and Essentiale treatment groups, serum ALT, AST, lipids, hepatic TG, and the severity of hepatic steatosis and inflammation obviously decreased, and hepatic antioxidant levels significantly increased in the Jianpishugan group (all P < 0.05 or 0.01). Compared to the model group, the level of SREBP-1c mRNA significantly decreased and that of PPARa mRNA significantly increased in the Jianpishugan Decoction and essentiale treatment groups (all P < 0.05 or 0.01).
CONCLUSION: Jianpishugan Decoction can regulate hepatic lipid metabolism, inhibit the expression of SREBP-1c and SCAP, and up-regulate the expression of PPARa and PGC-1a in rats with NASH.
- Citation: Su DM, Zhuge L, Li J, Li JX. Effect of Jianpishugan Decoction on hepatic lipid metabolism in rats with non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 91-99
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/91.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.91
非酒精性脂肪性肝病(non alcoholic fatty liver disease, NAFLD)是一类肝脏组织学改变与酒精性肝病相似, 但无过量饮酒史的临床病理综合征, 已成为临床常见的肝脏疾病之一. 从NAFLD到非酒精性脂肪性肝硬化的转化过程中, 非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是一个非常重要的中间环节, 是隐源性肝硬化的重要原因之一, 预后不佳, 约50%患者随访6年后可进展成肝纤维化, 10%-15%在10-20年内可进展成肝硬化, 而9%-26%在随访的4-10年内可因终末期肝病死亡[1-6]. 因此, 针对NASH防治的研究对降低肝硬化发生率具有重要的意义, 也是NAFLD防治研究中的关键问题. 目前现代医学尚无治疗NASH的特效药物, 而中医药在防治NASH方面具有独特的作用和优势, 尤其是在保肝降酶降脂以及改善患者生活质量方面. 笔者认为NASH的关键病机为"脾虚肝郁, 痰浊瘀阻", 结合传统医学"见肝之病, 当先实脾"的理论, 从肝脾论治创立健脾疏肝方, 观察该方治疗NASH的疗效及对NASH肝脂代谢的分子调控机制.
本实验选用♂ 8周龄SD大鼠, 体质量120 g±20 g (北京维通利华实验动物技术有限公司提供)[7]. 常规饲养于北京中医药大学清洁级动物房, 12 h光照和黑夜循环, 温度22 ℃±2 ℃, 湿度50%-60%. 健脾疏肝方(炒白术15 g、茯苓15 g、绞股兰10 g、泽泻20 g、水飞蓟15 g、草决明10 g、广郁金10 g、丹参30 g、白芥子10 g、生山楂15 g)由北京同仁堂药材公司提供, 用药剂量按实验动物与人体体表面积比等效量核算比率, 计算动物的等效剂量制作成浸膏; 多烯磷脂酰胆碱(易善复)胶囊: 规格: 228 mg/粒, 由赛诺菲安万特(北京)制药有限公司生产, 按上述方法制成混悬液; 高脂饲料由北京科澳协力饲料有限公司加工制作(10 kg/包), 真空包装常温保存. ALT、AST、TG试剂盒由中生北控生物科技股份有限公司生产; SOD、MDA、GSH-PX试剂盒由南京建成生物工程公司生产; SREBP-1c、SCAP、PPARa、PGC-1a、LXR PCR引物由生工生物工程(上海)有限公司提供; TRIzol试剂盒购自美国Invitrogen公司; M-MLV反转录试剂盒购自日本TaKaRa公司; Real-time PCR扩增试剂盒购自北京泽平生物技术有限公司; Agarose购自Promega公司; DEPC、油红O及HE染色相关试剂购自Sigma公司; 100 bp DNA Ladder购自北京全式金生物技术有限公司.
1.2.1 造模: 采用高脂饲料(88%基础饲料+10%猪油+2%胆固醇)饲喂, 自由饮水、摄食, 连续8 wk(结合文献和前期预实验的动态监测结果), 建立NASH大鼠模型[8,9].
1.2.2 分组及处置: 40只大鼠按随机数字表随机分成空白组、模型组、健脾疏肝方组及易善复组4组, 每组10只. 空白组饲喂普通饲料, 其余各组饲喂高脂饲料连续8 wk. 模型成立后, 各组饲喂普通饲料, 健脾疏肝方组及易善复组分别予健脾疏肝方浸膏和易善复混悬液灌胃, 健脾疏肝方组给药量为: 15.05 g生药/kg, 易善复组给药量为: 137.3 mg/kg, 两组给药量相当于临床成人日用量的7倍(剂量根据人和动物体表面积折算的等效剂量比值表[10], 结合前期实验结果测定), 模型组和空白组按10 mL/kg鼠重灌服去离子水; 每日1次, 自由摄食、饮水, 连续4 wk, 观察动物进食、饮水、行为、精神状态、毛发及二便等情况, 每周计量动物体质量1次.
1.2.3 指标检测: 4 wk治疗结束后处死各组大鼠, 取大鼠腹主动脉血及肝组织用于各项指标检测, 处死前禁食禁水24 h. (1)血清生化指标、肝脂含量及抗氧化指标测定: 大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)采用全自动生化分析仪进行测定; 肝脏TG含量、SOD活性、MDA及GSH-PX含量测定: 精确称取肝组织0.5 g, 采用超声匀浆机制成匀浆(冰水中进行), 取1%肝匀浆, 离心后取上清, 按试剂盒说明进行检测; (2)肝组织病理学检测: 新鲜肝组织冰冻切片, 行常规油红O染色; 肝组织石蜡切片, 行常规HE染色. 油红O及HE切片光镜下评估肝脏脂肪变性和炎症活动情况. 根据NAFLD活动度积分(NAFLD Activity Score, NAS)[11]对大鼠肝组织病理改变进行评估. NAS组织学评分系统对14项病理改变, 3项指标进行了半定量评估计分: 肝脂肪变性程度(按发生脂肪变性实质细胞/总细胞数, <5%、5%-33%、33%-66%、>66%, 分别计0-3分)、小叶内炎症(按病灶大小, <2、2-4、>4, 分别计0-2分)、肝细胞气球样变(按无、少量气球样细胞、较多/显著气球样变, 分别计0-2分), 其中NAS≥5分者可明确NASH的诊断, NAS<3分则可排除NASH, 两者之间者为NASH可能. 油红O及HE切片使用Olympus摄像系统进行观察和摄片; (3)实时荧光定量PCR检测肝组织SREBP-1c、SCAP、PPARa、PGC-1a和LXR mRNA水平: 依据试剂盒说明提取组织RNA, 核酸紫外分光光度计测定经稀释的RNA提取物的吸光度(A)值和浓度, 判断RNA纯度, 并计算其浓度. 放-70 ℃冰箱保存备用; RNA逆转录: 37 ℃恒温1 h, 然后95 ℃, 3 min灭活, 将逆转录产物放-20 ℃冰箱备用; 定量PCR测定: 反应条件为: 94 ℃预变性15 min, 94 ℃ 15 s, 60 ℃ 34 s , 72 ℃ 15 s, 共40循环, 72 ℃ 10 min. PCR引物序列见表1. 选阳性标准梯度点分析, 若相关系数r2大于0.90, 表明线形关系良好, 可确定为定量标准曲线, 根据标准曲线得出样本荧光定量反应的绝对定量值, 定量的单位是B = 拷贝数/mL cDNA. 考虑到各个样本总RNA浓度的差异, 最终计算结果按下列公式换算: A(拷贝数/mg 总RNA) = B(拷贝数/mL cDNA)/样本RNA的A260值×5/6.
| 引物名称 | 探针 | 产物(bp) |
| XR | 5'-GACTTCGAGTCACGCCTTG-3' | 131 |
| 5'-GAGCTGTTTGGCAAAGTCAA-3' | ||
| PGC-1α | 5'-GACTGGCAGGGGCACATCT-3' | 156 |
| 5'-TGGGATGACCGAAGTGCTT-3' | ||
| PPARα | 5'-GGCGAACTATTCGGCTAAAG-3' | 138 |
| 5'-AACGGATTGCATTGTGTGAC-3' | ||
| SCAP | 5'-AGAGTTGCAAGGCAGTCTCA-3' | 153 |
| 5'-CGAGCAGCTACAATCCTCCT-3' | ||
| SREBP-1c | 5'-GGGCAGCTCTGTACTCCTTC-3' | 157 |
| 5'-ATGGCCTTGTCAATGGAACT-3' | ||
| GAPDH | 5'-CAACTCCCTCAAGATTGTCAGCAA-3' | 128 |
| 5'-GGCATGGACTGTGGTCATGA-3' |
统计学处理 应用SPSS17.0 for Windows软件进行资料的统计分析, 计量资料以mean±SD表示, 采用单因素方差分析(One-way ANOVA), 以P<0.05为有统计学意义.
空白组大鼠毛色洁白、富有光泽, 行动敏捷, 饮食量及排泄物无异常, 体质量随造模时间逐渐增加. 模型组大鼠毛色枯黄, 色泽黯淡, 喜团聚蜷卧, 饮食量较空白组减少, 大便干稀不调, 体质量随造模时间逐渐增加, 且增加幅度比空白组大. 各治疗组大鼠毛色、行为、饮食以及排泄物与空白组相比, 无明显异常, 个别大鼠可见大便稀软, 体质量增长介于模型组与空白组之间. 具体表现为: 与空白组相比, 模型组体质量及肝指数均明显升高, 均有显著性差异(均P<0.001). 与模型组相比, 中药组及西药组体质量及肝指数均显著下降(体质量: P中<0.001, P西 = 0.001; 肝指数: P中<0.001, P西 = 0.003), 且中药组体质量比西药组下降更明显(P = 0.045), 而中药组与西药组间肝指数无显著性差异(P = 0.054, 表2).
2.2.1 肝脏肉眼观察情况: 空白组大鼠肝脏呈红褐色, 表面光滑, 质软, 富有弹性, 边缘锐利, 肝脏切面光滑致密. 而模型组大鼠肝脏呈土黄色, 肝体积明显增大, 肝表面包膜紧张, 可见散在脂肪斑, 质地较韧, 边缘圆钝, 切面疏松. 各治疗组大鼠肝脏体积略增大, 色泽较空白组略浅, 质地、弹性较空白组略差, 各用药组之间肉眼无明显差异.
2.2.2 肝脏光镜观察情况: 空白组大鼠肝小叶结构清晰, 肝索排列整齐. 而模型组大鼠肝细胞弥漫性脂肪变性, 以中央静脉周围最为明显, 肝细胞体积增大, 胞浆内可见大小不一的脂滴, 部分肝组织汇管区、小叶内或者中央静脉管壁周围有炎细胞浸润, 未见纤维化表现. 各治疗组大鼠肝细胞脂肪变明显减轻, 胞浆内脂滴明显减少, 甚至消失, 肝索排列较为整齐, 可见少量炎细胞, 小叶内坏死灶明显减少.
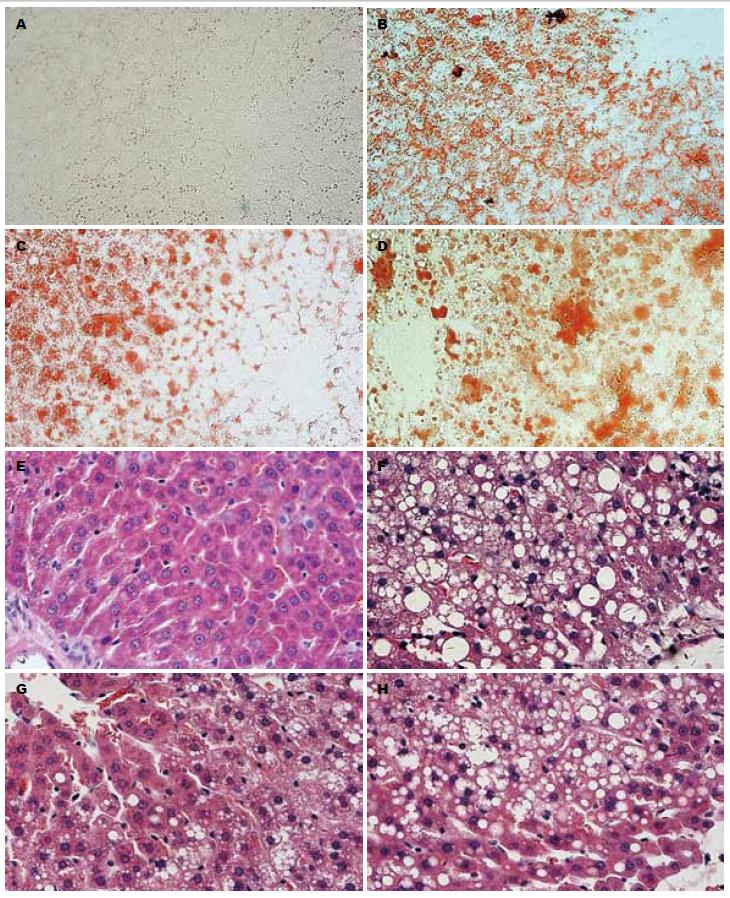
油红O染色结果显示: 空白组大鼠肝组织未见红色脂滴; 模型组大鼠肝组织可见大量红色脂滴, 表现为脂滴弥漫浸润入肝细胞中, 融合成片, 脂滴细胞数/总细胞数约为46%-60%. 健脾疏肝方治疗组及易善复治疗组大鼠肝组织内也可见红色脂滴, 但数量较模型组少, 且融合成片情况较少, 脂滴细胞数所占比例分别为20%-30%、30%-40%(图1A-D).
HE染色结果显示: 空白组大鼠肝组织形态结构均正常; 模型组大鼠肝组织出现脂肪变性, 表现为肝细胞肿胀呈圆形, 体积较正常明显增加, 胞质内可见大量脂肪空泡及气球样变, 其中汇管区和小叶内可见炎性细胞浸润, 呈灶状分布, 肝小叶内脂肪空泡、肝细胞气球样变、炎性细胞灶性浸润并存; 其中肝细胞损害主要集中在中腺泡3区, 炎性细胞以单核细胞、淋巴细胞为主; 健脾疏肝方治疗组及易善复治疗组大鼠肝组织脂肪病变较模型组减轻, 脂肪空泡、气球样便以及炎症浸润情况均有所改善(图1E-H).
按NAS病理评分标准进行评分: 模型组总分6.67±0.52, 与空白组相比有显著性差异(P<0.001); 与模型组相比, 健脾疏肝方治疗组及易善复治疗组无论脂肪变性、小叶内炎症、气球样变或者总分均明显下降, 均有显著性差异(均P<0.001); 健脾疏肝方治疗组与易善复治疗组之间无统计学差异(表3).
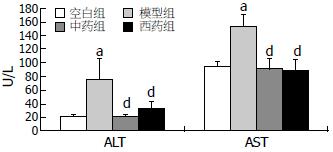
4 wk治疗结束后, 与空白组相比, 模型组血清ALT、AST水平均显著升高(均P<0.001); 与模型组相比, 中药组及西药组血清ALT、AST水平均明显下降(均P<0.001); 而中药组与西药组之间无显著性差异(表4, 图2).
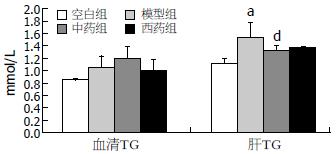
4 wk治疗结束后, 与空白组相比, 模型组血清及肝脏TG含量均增多, 尤其是肝内TG含量有统计学差异(P血清 = 0.068, P肝脏<0.001); 与模型组相比, 中药组及西药组肝TG含量均下降, 其中中药组下降较为明显(P中 = 0.032, P西 = 0.093); 中药组与西药组之间无显著性差异(P = 0.584, 表4, 图3).
2.5.1 大鼠抗氧化指标变化: 4 wk治疗结束后, 与空白组相比, 模型组SOD、GSH-PX活性下降(P = 0.384, P = 0.103), MDA含量升高(P<0.001). 与模型组相比, 中药组SOD、GSH-PX活性均明显升高(P = 0.003, P<0.001), MDA含量有所下降, 但无显著性差异(P = 0.874); 西药组SOD、GSH-PX活性也升高(P = 0.058, P<0.001), MDA含量下降(P = 0.05). 与西药组相比, 中药组SOD、GSH-PX活性升高更明显, 但无显著性差异(P = 0.16, P = 0.181, 表5).
2.5.2 脂质代谢相关因子肝组织mRNA表达: 与空白组相比, 模型组肝组织LXR、PPARa mRNA表达下降, 而SREBP-1c、SCAP mRNA表达上调, 其中PPARa、SREBP-1c mRNA表达与空白组相比有显著性差异(P = 0.025, P = 0.029). 与模型组相比, 中药组肝组织LXR、PPARa、PGC-1a mRNA表达上调, SREBP-1c、SCAP mRNA表达均下调, 其中PPARa、PGC-1a、SREBP-1c mRNA表达与模型组相比有显著性差异(P = 0.011, P = 0.003, P = 0.0001); 西药组LXR、SREBP-1c、SCAP mRNA表达下调, PPARa、PGC-1a mRNA表达略上调, 但仅SREBP-1c、SCAP mRNA表达与模型组相比有显著性差异(P = 0.0001, P = 0.013). 中药组与西药组相比肝组织LXR、PPARa、PGC-1a mRNA表达上调(P = 0.098, P = 0.012, P = 0.011), SREBP-1c、SCAP mRNA表达两组间无显著性差异(P = 0.952, P = 0.163, 表6, 图4).
目前, 国内外有关NASH的动物模型主要包括3类[12,13]: (1)基因敲除或基因突变模型; (2)营养、药物或毒物诱导模型; (3)复合模型(联合基因模型和营养模型). 其中, 高脂饮食诱导的NASH鼠类模型最为常见, 该模型在病因学、发病机制及组织病理学上与人类NASH极为相似, 且多合并肥胖、胰岛素抵抗及其他代谢综合征等全身疾病背景. 据文献报道[8,9], 该模型造模周期为8-12 wk, 本研究经过动态监测在较短的时间(8 wk)内成功复制了NASH大鼠模型. 其表现为: 模型组大鼠体质量及肝指数明显增加, 肝细胞弥漫性脂肪病变, 病变以腺泡3区为重, 肝小叶内炎性细胞浸润, 血清ALT、AST、TG水平及肝TG含量升高, 肝脏NAS病理评分模型组大于5分, 表明该模型复制成功.
我们认为本病病因病机较为复杂, 病理演变过程中各种因素相互影响, 互为因果. 如饮食不节、情志失调、病后失调等所致脾胃运化失司, 湿聚成痰, 阻滞脉络. 认为本病病机关键为"脾虚肝郁, 痰浊瘀阻", 结合"见肝之病, 当先实脾"的理论出发, 从肝脾论治创立健脾疏肝方. 其中绞股蓝甘、苦、寒, 归肺脾肾经, 健脾益气、活血降脂, 郁金辛、苦、寒, 归肝心肺经, 疏肝解郁、活血祛瘀, 二者共奏健脾疏肝, 故为君药; 白术甘、苦、温, 归脾胃经, 健脾益气、化湿降浊, 水飞蓟性寒、味苦, 归肝胆经, 疏肝利胆、化浊降脂, 泽泻甘淡渗泄、利湿化浊, 三者助君药健脾疏肝, 并可利湿化浊, 共为臣药; 茯苓甘、淡、平, 归心脾肾经, 健脾益气、淡渗利湿, 决明子甘、苦、咸、微寒, 归肝大肠经, 平降肝阳、通便化浊, 丹参活血化瘀、清心安神, 白芥子化痰降浊、散结通络, 山楂健胃消食、化瘀降浊, 共为佐使药. 全方共奏健脾疏肝、活血化浊.
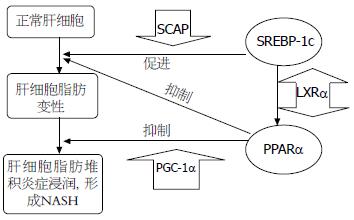
随着近年来对NASH发病机制的不断深入探讨, 已知NASH发病过程伴随脂质过氧化、炎症等病理过程, 其根源在于肝细胞脂质代谢紊乱, 其中SREBP-1c、SCAP、PPARa、PGC-1a、LXR等脂质代谢分子网络上的关键基因/蛋白表达异常是脂质代谢的关键因素. SREBP-1c和SCAP, PPARa和PGC-1以及LXRa是肝内脂质代谢的重要因子, 在脂质代谢过程中形成网络, 共同调控肝内脂质代谢.
其中, SREBPs是一种核转录因子, 其亚型SREBP-1c主要在啮齿类动物和人类的肝脏和脂肪细胞中表达, 选择性地调控脂肪酸、甘油三酯以及糖代谢中基因的表达水平. 其靶基因包括LDL受体、乙酰辅酶A羧化酶(ACC)、脂肪酸合酶(FAS)等[14]. 正常情况下, 大鼠肝脏SREBP-1c蛋白表达较低, 但在高脂饮食的诱导下, 其表达明显增高, 表明高脂饲料的摄入可明显促进FFA及TG合成, 诱导脂肪肝的形成[15], 而FFA及其衍生物可作为PPAR的配体而激活PPAR[16]. 而SCAP是哺乳动物脂质合成和摄入的中心调节因子, 在脂质代谢的平衡调节中起着非常重要的作用[17]. SCAP定位于内质网膜, 与膜结合转录因子胆固醇调节元件结合蛋白(SREBPs)等调节因子共同控制一系列酶编码基因的转录过程. SCAP具有感觉胆固醇的水平和条件性地把SREBPs从内质网运送到高尔基体的功能, 从而通过调控固醇调节元件结合蛋白(SREBPs)的水解反应而控制细胞内的脂质合成.
PPAR是一类由配体激活的核转录因子, 其中PPARa在肝细胞中大量表达. PPARa可通过对肝内脂肪酸氧化相关基因表达的调控, 在肝脏脂肪细胞分化、脂质贮存、转运和脂肪酸氧化中发挥重要作用. 肝脏脂肪酸水平的增高可激活PPARa, 然后转录激活参与脂肪酸氧化的基因, 主要包括线粒体和过氧化物酶体的b氧化系统及微粒体w氧化系统, 增加对脂肪酸氧化能力[18], 从而加速脂肪酸的分解. 而PGC-1a即PPARGC-1(PPAR gamma coactivator-1), 属于PGC-1(PPARg的辅激活因子)家族, 是PPAR的辅激活因子, 通过PPARa调控编码与脂质代谢、脂质运输有关功能蛋白的基因表达, 影响体内脂代谢平衡. PGC-1a参与多种代谢过程, 包括葡萄糖的摄取、肝脏糖异生、肝脏脂肪酸β氧化、脂肪细胞分化等. Miehael等[19]发现, PGC-1a敲除鼠导致了脂肪酸氧化基因表达的下调, 从PGC-1缺陷鼠分离出的肝细胞中的脂肪酸的氧化速率减少, 同时线粒体呼吸率也减少, 因此, PGC-1a缺陷, 线粒体呼吸率下降, 最终导致脂肪酸氧化能力下降.
而肝X受体a(liver X receptor a, LXRa)为胆固醇代谢关键感受器, 在调节胆固醇分解代谢中具有至关重要的作用. 肝细胞内过多的胆固醇通过代谢生成氧化甾醇激活LXRs, 而活化的LXRs可上调胆汁酸经典合成途径限速酶-胆固醇7a羟化酶(cholesterol 7a-hydroxylase, CYP7A1)的表达, 加速胆固醇向胆汁酸转化[20]. LXRa还可以通过对其下游基因, 如乙酰CoA羟化酶、脂肪酸合成酶等脂肪酸生成的关键酶基因的调控, 参与脂肪酸的代谢调节. 此外, Higuchi等[21]认为, LXR通过调控SREBP-1c的表达, 在NAFLD的发生发展过程中起着脂质代谢调控器的作用. 在高胆固醇条件下, LXRs上调SREBP-1c的表达[22]. 随着LXRa、SREBP-1c的过度表达, 脂肪酸合成异常增多, 导致NAFLD发生[23]. 而PPARa可通过LXRa对ABCA1间接调控, 促进胆固醇的逆向转运, 同时二者通过交互作用对细胞脂肪酸和胆固醇代谢进行复杂而精密的调节[24].
本研究显示: 模型组肝组织SREBP-1c、SCAP mRNA水平较空白组显著升高, 而PPARa和PGC-1a mRNA表达明显下降. 表明由SREBP-1c和SCAP介导的脂质代谢异常可能是NASH产生脂肪变性的重要机制, 而PPARa和PGC-1a mRNA表达减少, 导致脂肪酸在肝脏的氧化能力下降, 增加了脂质在肝脏的沉积, 可能成为新的刺激因素而增加ROS, 引起脂质过氧化, 从而导致NASH和肝纤维化.
健脾疏肝方组和易善复组肝组织SREBP-1c、SCAP mRNA水平与模型组比较显著降低, 表明健脾疏肝方和易善复可能通过下调SREBP-1c、SCAP mRNA水平从而改善脂肪代谢紊乱, 调节TG的合成量和TG在肝细胞内的贮存量, 减少NASH大鼠肝脏脂质积聚、脂肪变性, 从而防治NASH. 此外, 健脾疏肝方组大鼠肝脏PPARa和PGC-1a mRNA表达增强, 提示健脾疏肝方可能加速脂肪酸进入线粒体和微粒体进行氧化, 从而减少TG的合成, 调解肝脏脂肪代谢, 达到改善和减轻肝细胞脂肪变性和肝组织损伤的作用. 与此同时, 健脾疏肝方组大鼠血脂、血清转氨酶和肝脂含量明显降低, 肝脏病理情况改善明显, 肝脏SOD活性、GSH-PX含量升高, MDA含量下降, 肝脏SREBP-1c和SCAP mRNA表达减少, 表明健脾疏肝方不仅调节NASH发生发展的单个靶点, 而且对多个角度的相关因子进行调控, 影响脂质代谢和氧化应激、脂质过氧化等全过程, 表明其作用机制是通过多层次多靶点而发挥作用的, 从侧面反证了中医治疗疾病强调整体观念.
本研究显示, 易善复可下调SREBP-1c和SCAP mRNA在肝脏的表达, 促进脂质代谢, 减少肝内脂质蓄积; 而健脾疏肝方不仅可通过抑制SREBP-1c和SCAP的表达, 促进脂质代谢, 减少肝脏脂质蓄积, 且可通过上调PPARa和PGC-1a以及LXR的活性, 达到抑制脂质过氧化以及抗炎等, 从而防治NASH.
易善复乃大豆中提取的一种磷脂, 其主要活性成分为多聚磷脂酰胆碱二酰甘油或多聚乙酰卵磷脂, 是构成所有细胞膜和亚细胞膜的重要组成部分, 具有增加细胞膜完整性、稳定性、和流动性的功用, 可修复受损的细胞膜, 减少氧应激和脂质过氧化[25-27]. 易善复组成成分简单, 作用靶点相对单一, 本研究结果也表明, 易善复仅对部分脂质代谢因子起调控作用; 而中药复方为多种药物的配伍组合物, 其组成多样, 经过熬制等加工后成分更是复杂, 而这些复杂的成分又具有各自多样的功效, 可作用于脂质代谢多个不同的靶点, 从而达到网络调控的功用. 本研究结果也表明, 健脾疏肝方对脂质代谢多个因子均具有较好的调控作用, 从侧面反映了健脾疏肝方可通过对脂质代谢的网络调控而达到防治NASH的目的, 相较与易善复单一的作用靶点, 中药复方可通过多个不同的作用靶点达到网络调控的功效, 与中医整体观念的治病思想相符合.
总之, 健脾疏肝方可网络调控NASH肝脂代谢, 从而反证脾虚肝郁, 痰浊瘀阻证是NASH的关键病机, 也表明健脾疏肝方在改善NASH肝脂代谢方面较易善复有一定优势. 今后的研究中, 可将健脾疏肝方作为基础, 结合其他治法, 辨证施治, 进一步提高中医药防治NASH 的疗效.
非酒精性脂肪性肝炎(NASH)为目前常见的肝脏疾病之一, 其预后不佳, 可转化为肝纤维化、肝硬化, 而导致肝衰甚至死亡. 目前本病的发病机制尚未明确, 现代医学尚无特效药物治疗.
郑培永, 副研究员, 上海中医药大学附属龙华医院
由于NASH发病机制不清, 且无特效的防治药物, 本病已成为目前肝病界的研究热点. 现代医学尚无特效药物, 而本病为中医药治疗的特色病种之一, 从传统医学角度探讨中医药治疗本病的靶点, 为今后本病的防治具有重要意义.
近年来中医药领域对NASH发病机制的不断深入, 已知NASH发病过程伴随脂质过氧化、炎症等病理过程, SREBP-1c、SCAP、PPARα、PGC-1α、LXR等脂质代谢分子网络上的关键基因/蛋白表达异常是脂质代谢的关键因素.
本研究结合目前NASH中医病机特点以及中医传统理论, 采用中药治疗NASH, 以探讨中药对NASH大鼠肝脂代谢分子网络的调控, 明确中药的作用靶点以及与西药的异同点.
本研究采用中药治疗NASH, 以探讨中药对NASH大鼠肝脂代谢分子网络的调控, 为今后中医药防治NASH提供实验依据及理论依据.
本研究立题新颖, 条理清晰, 文字表述简明通顺, 有一定的学术价值.
编辑: 张姗姗 电编:何基才
| 1. | Adams LA, Sanderson S, Lindor KD, Angulo P. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies. J Hepatol. 2005;42:132-138. [PubMed] [DOI] |
| 2. | Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30:1356-1362. [PubMed] [DOI] |
| 3. | Kashi MR, Torres DM, Harrison SA. Current and emerging therapies in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:396-406. [PubMed] [DOI] |
| 4. | Hui JM, Kench JG, Chitturi S, Sud A, Farrell GC, Byth K, Hall P, Khan M, George J. Long-term outcomes of cirrhosis in nonalcoholic steatohepatitis compared with hepatitis C. Hepatology. 2003;38:420-427. [PubMed] [DOI] |
| 5. | Hashimoto E, Yatsuji S, Kaneda H, Yoshioka Y, Taniai M, Tokushige K, Shiratori K. The characteristics and natural history of Japanese patients with nonalcoholic fatty liver disease. Hepatol Res. 2005;33:72-76. [PubMed] [DOI] |
| 6. | Sanyal AJ, Banas C, Sargeant C, Luketic VA, Sterling RK, Stravitz RT, Shiffman ML, Heuman D, Coterrell A, Fisher RA. Similarities and differences in outcomes of cirrhosis due to nonalcoholic steatohepatitis and hepatitis C. Hepatology. 2006;43:682-689. [PubMed] [DOI] |
| 7. | Kirsch R, Clarkson V, Shephard EG, Marais DA, Jaffer MA, Woodburne VE, Kirsch RE, Hall Pde L. Rodent nutritional model of non-alcoholic steatohepatitis: species, strain and sex difference studies. J Gastroenterol Hepatol. 2003;18:1272-1282. [PubMed] [DOI] |
| 11. | Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41:1313-1321. [PubMed] [DOI] |
| 12. | London RM, George J. Pathogenesis of NASH: animal models. Clin Liver Dis. 2007;11:55-74, viii. [PubMed] [DOI] |
| 14. | Coleman RA, Lee DP. Enzymes of triacylglycerol synthesis and their regulation. Prog Lipid Res. 2004;43:134-176. [PubMed] [DOI] |
| 16. | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114:147-152. [PubMed] |
| 17. | Yu-Poth S, Yin D, Kris-Etherton PM, Zhao G, Etherton TD. Long-chain polyunsaturated fatty acids upregulate LDL receptor protein expression in fibroblasts and HepG2 cells. J Nutr. 2005;135:2541-2545. [PubMed] |
| 19. | Michael LF, Wu Z, Cheatham RB, Puigserver P, Adelmant G, Lehman JJ, Kelly DP, Spiegelman BM. Restoration of insulin-sensitive glucose transporter (GLUT4) gene expression in muscle cells by the transcriptional coactivator PGC-1. Proc Natl Acad Sci U S A. 2001;98:3820-3825. [PubMed] [DOI] |
| 20. | Lehmann JM, Kliewer SA, Moore LB, Smith-Oliver TA, Oliver BB, Su JL, Sundseth SS, Winegar DA, Blanchard DE, Spencer TA. Activation of the nuclear receptor LXR by oxysterols defines a new hormone response pathway. J Biol Chem. 1997;272:3137-3140. [PubMed] [DOI] |
| 21. | Schultz JR, Tu H, Luk A, Repa JJ, Medina JC, Li L, Schwendner S, Wang S, Thoolen M, Mangelsdorf DJ. Role of LXRs in control of lipogenesis. Genes Dev. 2000;14:2831-2838. [PubMed] [DOI] |
| 22. | Higuchi N, Kato M, Shundo Y, Tajiri H, Tanaka M, Yamashita N, Kohjima M, Kotoh K, Nakamuta M, Takayanagi R. Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease. Hepatol Res. 2008;38:1122-1129. [PubMed] [DOI] |
| 25. | Lieber CS. Pathogenesis and treatment of alcoholic liver disease: progress over the last 50 years. Rocz Akad Med Bialymst. 2005;50:7-20. [PubMed] |
| 26. | Lieber CS. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol. 2004;34:9-19. [PubMed] [DOI] |
| 27. | Bai J, Cederbaum AI. Overexpression of CYP2E1 in mitochondria sensitizes HepG2 cells to the toxicity caused by depletion of glutathione. J Biol Chem. 2006;281:5128-5136. [PubMed] [DOI] |