修回日期: 2011-12-13
接受日期: 2011-12-31
在线出版日期: 2012-01-18
目的: 探讨姜黄素对人肝癌耐药细胞株Bel7402/5-FU多药耐药性的逆转作用及可能的作用机制.
方法: 采用氟尿嘧啶(fluorouracil, 5-FU)药物浓度梯度递增法诱导建立肝癌耐药细胞亚系Bel7402/5-FU; MTT法检测人肝癌细胞株Bel7402及其耐药细胞株Bel7402/5-FU对6种化疗药物以及姜黄素的敏感性; Western blot法检测Bel7402细胞、Bel7402/5-FU细胞及经过0、5、10、20 mg/L姜黄素作用后的Bel7402/5-FU细胞中多药耐药相关蛋白1(MRP1)、肺耐药相关蛋白(LRP)、P-糖蛋白(P-gp)、程序化死亡因子5(PDCD5)蛋白的表达水平.
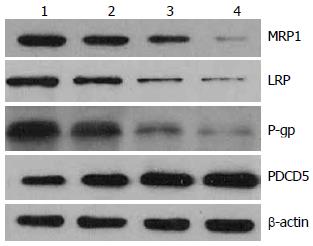
结果: Bel7402/5-FU细胞对6种化疗药物表现出交叉耐药性, 其中对5-FU耐药指数最高; 与Bel7402细胞相比, Bel7402/5-FU细胞中的MRP1、LRP、P-gp蛋白表达升高, PDCD5蛋白表达降低; 随姜黄素浓度的升高, Bel7402/5-FU细胞中MRP1、LRP、P-gp蛋白表达逐渐降低, PDCD5蛋白表达逐渐增高.
结论: 姜黄素具有逆转肝癌细胞多药耐药性的作用, 可能与下调多药耐药相关蛋白MRP1、LRP、P-gp, 上调凋亡相关蛋白PDCD5表达有关.
引文著录: 曹仕琼, 李萍, 尹太勇, 杨盛力. 姜黄素对人肝癌耐药细胞株Bel7402/5-FU多药耐药性的逆转作用. 世界华人消化杂志 2012; 20(2): 135-139
Revised: December 13, 2011
Accepted: December 31, 2011
Published online: January 18, 2012
AIM: To investigate whether curcumin reverses multidrug resistance of hepatocellular carcinoma drug-resistant cell line Bel7402/5-FU and to explore potential mechanisms involved.
METHODS: The cell line Bel7402 was induced to form a multidrug resistant cell subline Bel7402/5-FU by exposing increasing concentrations of fluorouracil (5-FU). The sensitivity of Bel7402 and Bel7402/5-FU cells to chemotherapeutics and curcumin were tested by MTT assay. The protein levels of multi-resistance related protein 1 (MRP1), lung resistance-related protein (LRP), p-glycoprotein (P-gp) and programmed cell death 5 (PDCD5) were detected by Western blotting in Bel7402 cells, Bel7402/5-FU cells and Bel7402/5-FU cells treated with different concentrations of curcumin.
RESULTS: The Bel7402/5-FU cell line showed cross-resistance to six drugs, among which 5-FU had the highest RI. The protein expression levels of MRP1, LRP and P-gp in Bel-7402/5-FU cells were obviously higher than those in Bel7402 cells, while the expression of PDCD5 protein in Bel7402/5-FU cells was lower than that in Bel7402 cells. The expression of MRP1, LRP and P-gp proteins was down-regulated after curcumin treatment, while the PDCD5 protein was significantly increased.
CONCLUSION: Curcumin can reverse multidrug resistance of the Bel7402/5-FU cell line via mechanisms possibly associated with down-regulation of MRP1, LRP and P-gp expression and up-regulation of PDCD5 expression.
- Citation: Cao SQ, Li P, Yin TY, Yang SL. Curcumin reverses multidrug resistance of human hepatocellular carcinoma bel7402/5-FU cells. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 135-139
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/135.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.135
肝癌是我国最常见、恶性程度最高的肿瘤之一, 治疗手段包括手术切除、化疗、介入、放疗、中医药治疗等, 其中化疗占有很重要的地位. 然而由于肝癌细胞多药耐药(MDR)作用的存在, 化疗效果并不理想. 因此寻找多药耐药逆转剂变得尤为重要. 姜黄素是从姜科植物姜黄中提取的一种色素, 有研究报道姜黄素具有预防和治疗肿瘤的作用. 本研究以人肝癌多药耐药细胞株Bel7402/5-FU为研究对象, 旨在探讨姜黄素对肝癌细胞多药耐药的逆转作用, 及其可能的作用机制.
人肝癌细胞株Bel7402购自南京凯基生物科技发展有限公司姜黄素(Sigma公司); MTT(北京索莱宝科技有限公司)、氟尿嘧啶(5-FU, 250mg/支, 南通总厂)、阿霉素(ADM, 10 mg/瓶, 浙江海正制药厂)、丝裂霉素(MMC, 2 mg/支, 浙江海正制药厂)、甲氨蝶呤(MTX, 5 mg/瓶, 上海华联制药厂)、环磷酰胺(CTX, 0.2 g/支, 连云港恒瑞制药厂)、顺铂(CDDP, 20 mg/瓶, 齐鲁制药厂)、鼠抗人MRP1抗体(美国Novus Biological公司)、鼠抗人LRP抗体(美国NeoMarker公司)、鼠抗人P-gp抗体(美国NeoMarker公司)、兔抗人PDCD5抗体(北大生科院)、b-actin抗体(美国Santa Cruz公司)、ECL试剂(碧云天公司).
1.2.1 Bel7402/5-FU的建立和姜黄素作用的Bel7402/5-FU细胞的培养: 用含100 mL/L胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养基培养人肝癌细胞株Bel7402, 置于37 ℃、50 mL/L CO2培养箱中培养. 采用5-FU药物浓度梯度递增诱导法建立Bel7402/5-FU细胞系. 取对数生长期Bel7402细胞, 计数后接种于培养瓶中, 使细胞浓度为5×105/mL. 待细胞贴壁后, 更换含5-FU的培养液继续培养细胞. 5-FU的起始浓度为2 000 mg/L, 培养3-5 d, 弃去上清及死亡后悬浮细胞, 更换含同等浓度的含药培养液继续培养3-5 d. 弃去上清及死亡后悬浮细胞, 再加入含剂量加倍浓度的含药培养液, 重复上述步骤. 4 mo后, 细胞可在含2×105 mg/L 5-FU的培养液中稳定生长增殖, 将该细胞亚系命名为Bel7402/5-FU. 更换培养液, 使Bel7402/5-FU细胞在含5-FU浓度为2×104 mg/L的培养液中继续培养维持其耐药性.
实验前2 wk撤去药物, 以正常的RPMI 1640培养液培养, 然后用于实验以及后续的检测. 分别用浓度为5、10、20 mg/L的姜黄素作用Bel7402/5-FU细胞, 置于50 mL/L CO2培养箱中 37 ℃、饱和湿度条件下培养48 h后, 换入新鲜培养液, 再培养24 h, 以备下阶段实验用.
1.2.2 MTT法检测Bel7402及Bel7402/5-FU细胞对6种化疗药物的敏感性: 分别取对数生长期的亲本和耐药细胞, 制成浓度为(2-5)×105/mL的细胞悬液, 每孔200 mL接种于96孔板中, 培养24 h, 使细胞贴壁良好. 更换新鲜培养液, 并加入不同的化疗药物. 每种化疗药物按2倍稀释成6种浓度梯度. 3孔/组, 并设3孔不加药的平行对照孔, 同时设不含细胞的培养液作为调零孔. 继续培养48 h后, 弃去含药培养液, 更换新鲜培养液培养24 h. 最后细胞中加入5 g/L的MTT溶液50 mL培养4 h后, 小心弃去上清, 加入200 mL DMSO/孔, 震荡溶解沉淀, 酶标仪在波长492 nm下读取吸光度(A)值. 使用改良寇氏法计算各种化疗药物对Bel7402细胞和Bel7402/5-FU细胞的50%抑制率的剂量(IC50), 计算耐药指数(RI) = IC50(Bel7402/5-FU)/IC50(Bel7402).
1.2.3 MTT法检测Bel7402/5-FU细胞对姜黄素的敏感性: 实验分组: (1)空白对照组: 含Bel7402/5-FU细胞的RPMI 1640培养液; (2)姜黄素组: 分别加5、10、20 mg/L浓度的姜黄素. 每组均设3个复孔, 用MTT法测定每组A值, 使用改良寇氏法计算姜黄素对Bel7402/5-FU细胞的50%抑制率的剂量(IC50).
1.2.4 Western blot法检测MRP1、LRP、P-gp、PDCD5蛋白的表达: 取Bel7402细胞、Bel7402/5-FU细胞以及姜黄素作用后的Bel7402/5-FU细胞, 分别加入200 mL含cocktail的裂解液提取总蛋白, 测定蛋白浓度, 计算含50 mg蛋白的溶液体积即为上样量, 各组样品加入上样缓冲液后于37 ℃放置40 min使蛋白变性, 于10% SDS-PAGE凝胶电泳分离, 2-3 h后将蛋白电转移至PVDF膜, 室温下于脱色摇床上用5%的脱脂奶粉摇动封闭40 min, 弃去封闭液, 于相应一抗中37 ℃孵育2 h, PBST洗4次×8 min, 加入二抗37 ℃孵育2 h, PBST洗4次×8 min. 然后加入ECL显色液暗室显色, 当出现明显条带后立即放入定影液中, 冲洗后室温下晾干. 将胶片进行扫描, 用凝胶图像分析软件分析目标带的吸光度值. 以b-actin蛋白作为内参, 用目的条带与内参条带吸光度值之比代表目的蛋白的相对表达水平, 每组重复3次.
统计学处理 采用SPSS16.0软件进行统计分析, 计数资料以mean±SD表示, 两样本均数比较采用独立样本t检验, P<0.05表示差异有统计学意义.
与Bel7402细胞相比, Bel7402/5-FU细胞对6种化疗药物表现出不同程度的耐药性. 其中对5-FU耐药指数最高, 耐药指数为109.55±14.30. 对ADM、MMC、MTX、CTX、CDDP的耐药指数分别为23.49±6.19、19.19±2.91、2.52±0.30、13.32±4.01、1.85±0.29 (表1).
不同浓度的姜黄素(5、10、20 mg/L姜黄素)对Bel7402/5-FU细胞的抑制率分别为: 6.74%±0.13%, 9.31%±0.21%, 4.45%±1.02%. 使用改良寇氏法计算姜黄素对Bel7402/5-FU细胞的50%抑制率的剂量(IC50)为28.28 mg/L±3.53 mg/L.
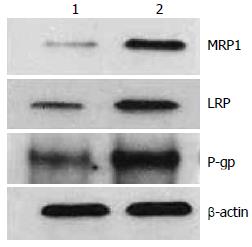
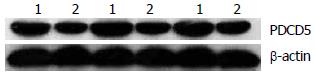
Bel7402/5-FU细胞中MRP1、LRP、P-gp蛋白的表达增高, PDCD5蛋白的表达降低, 与Bel7402细胞相比, 差异具有统计学意义(P<0.01, 图1, 2, 表2).
化疗是治疗肿瘤的重要手段之一, 但是由于肿瘤细胞多药耐药性的存在, 使得许多肝癌患者化疗失败. MDR是指肿瘤细胞对一种抗肿瘤药物具有耐药性的同时, 对其他结构不同、作用靶点不同的抗肿瘤药物也具有耐药性. 肿瘤细胞MDR的形成机制十分复杂, 需要多个因子的共同参与, 并通过多个途径来完成, 主要涉及: (1)耐药蛋白如MRP、P-gp、LRP的高表达; (2)与药物代谢相关的酶活性的异常, 如谷胱甘肽转移酶、DNA拓扑异构酶等; (3)凋亡抑制途径异常; (4)缺氧、低糖微环境等其他因素.
MRP1是由位于16号染色体的MRP基因编码的分子质量为190 kDa的糖蛋白. P-gp是由MDR1基因编码的分子量为170 kDa的跨膜糖蛋白. 两者都是ABC转运蛋白(ATP结合膜转运蛋白)超家族的重要成员, 可以利用ATP供能, 介导多种药物在细胞内外的转运, 使化疗药物在肿瘤细胞内的浓度降低, 从而产生MDR[1]. MRP1主要将与谷胱甘肽结合的底物泵出细胞外, 从而降低药物在细胞内的聚集, 介导MDR[2]. 而P-gp能够将一些亲脂类抗癌药物如阿霉素、柔红霉素、紫杉醇、长春碱类泵出肿瘤细胞外, 介导肿瘤细胞的多药耐药[3].
LRP由位于16号染色体短臂的LRP基因编码, 是分子量为110 KDa的非糖类蛋白质, 他不属于ABC转运蛋白超家族成员, 而是一种位于细胞质和核膜上的穹窿体蛋白(MVP). Scheper等[4]认为LRP介导肿瘤细胞产生MDR的主要机制是阻止药物通过核孔进入细胞核, 并将核内的药物转运到胞质, 从而降低药物的核质分布比率; 通过囊泡运输及胞吐机制将药物运输到细胞外, 降低细胞内的药物浓度. PDCD5原名TFAR19, 是一种人类新基因, 参与调控细胞凋亡[5]. PDCD5在人类50多种组织中均有表达, 其中在造血系统、成人心脏、肾脏、肾上腺、胎盘等组织中呈高表达, 而在胚胎组织中低表达[6]. 研究表明, PDCD5在卵巢上皮性癌[7]、胃癌[8]、肺癌[9]、肝癌[10]等恶性肿瘤中表达下降. PDCD5作为一种重要的凋亡调控因子, 他在肿瘤组织中的异常表达, 使肿瘤细胞的凋亡与增殖失衡, 导致肿瘤细胞的凋亡受到抑制, 从而引起多药耐药.
目前, 研究肝癌多药耐药的逆转, 从而提高肝癌的化疗效果是急需解决的问题. 许多已研制的逆转剂如环孢菌素A、维拉帕米、奎尼丁、三氟拉嗪、三氧苯胺等由于毒性明显或活性较低而难以在临床上推广[11]. 因此寻找高效、低毒、高选择性的逆转剂显得尤为重要. 姜黄素是从姜科植物姜黄中提取的一种色素, 具有抗炎、抗凝血、抗氧化、降血脂、抗病毒等广泛的药理作用. 近来有研究报道姜黄素具有抗肿瘤的作用[12], 其作用机制主要与诱导肿瘤细胞凋亡有关[13]. 另外, 姜黄素可以调节肿瘤细胞中耐药基因及凋亡基因的表达, 从而影响肿瘤细胞的多药耐药性. Limtrakul等[14]发现姜黄素能降低宫颈癌多药耐药细胞株KB-V1的MDR1基因及其产物P-gp的表达, 从而增加KB-V1对化疗药物的敏感性. 同时, 姜黄素可以增加卵巢癌多药耐药细胞COC1/DDP对顺铂的敏感性[15]. Tang等[16]发现姜黄素可以逆转胃癌SGC7901/VCR细胞的多药耐药性.
本研究采用不同浓度的姜黄素作用于肝癌耐药细胞株Bel7402/5-FU, 观测其是否可以逆转Bel7402/5-FU细胞株的耐药性. Western blot检测表明Bel7402/5-FU细胞中MRP1、LRP、P170的表达明显高于亲本bel7402细胞, PDCD5的表达明显低于亲本细胞. 经过姜黄素处理后, 随姜黄素浓度的增加其MRP1、LRP、P170的表达逐渐降低, PDCD5的表达则逐渐升高. 以上结果说明, 姜黄素对肝癌耐药细胞株Bel7402/5-FU的耐药性具有逆转作用, 其作用机制可能是通过降低耐药蛋白MRP1、LRP、P170的表达, 减少肿瘤细胞对化疗药物的外排, 增加细胞内药物浓度, 并上调PDCD5的表达, 抑制肿瘤细胞增殖, 促进肿瘤细胞凋亡, 从而部分逆转肿瘤细胞的多药耐药性. 因此, 姜黄素可以作为一种新的肝癌耐药逆转剂, 具有一定的临床应用价值.
肿瘤细胞多药耐药性的存在使得许多肝癌患者化疗失败. 研究肝癌多药耐药的逆转, 从而提高肝癌的化疗效果是急需解决的问题. 寻找高效、低毒、高选择性的逆转剂显得尤为重要.
郑培永, 副研究员, 上海中医药大学附属龙华医院
姜黄素是从姜科植物姜黄中提取的一种色素, 具有抗炎、抗凝血、抗氧化、降血脂、抗病毒等广泛的药理作用. 近来有研究报道姜黄素具有抗肿瘤的作用, 并影响肿瘤细胞的多药耐药性.
研究发现姜黄素对宫颈癌多药耐药细胞株KB-V1、卵巢癌多药耐药细胞COC1/DDP以及胃癌SGC7901/VCR细胞的多药耐药性具有一定的逆转作用.
本文研究了姜黄素对肝癌耐药细胞株中多药耐药相关蛋白及凋亡相关蛋白表达的影响, 进而探讨姜黄素对肝癌多药耐药性的逆转作用.
本文探讨了姜黄素对肝癌细胞多药耐药的逆转作用, 及其可能的作用机制, 为姜黄素作为耐药逆转剂在临床的应用奠定了基础.
课题研究了不同浓度的姜黄素对肝癌耐药细胞株BEL7402/5-FU的多药耐药蛋白的表达影响. 研究结果具有一定的学术意义和价值.
编辑: 张姗姗 电编:何基才
| 1. | Shukla S, Wu CP, Ambudkar SV. Development of inhibitors of ATP-binding cassette drug transporters: present status and challenges. Expert Opin Drug Metab Toxicol. 2008;4:205-223. [PubMed] [DOI] |
| 2. | Benlloch M, Ortega A, Ferrer P, Segarra R, Obrador E, Asensi M, Carretero J, Estrela JM. Acceleration of glutathione efflux and inhibition of gamma-glutamyltranspeptidase sensitize metastatic B16 melanoma cells to endothelium-induced cytotoxicity. J Biol Chem. 2005;280:6950-6959. [PubMed] [DOI] |
| 3. | Ho GT, Moodie FM, Satsangi J. Multidrug resistance 1 gene (P-glycoprotein 170): an important determinant in gastrointestinal disease? Gut. 2003;52:759-766. [PubMed] [DOI] |
| 4. | Scheffer GL, Schroeijers AB, Izquierdo MA, Wiemer EA, Scheper RJ. Lung resistance-related protein/major vault protein and vaults in multidrug-resistant cancer. Curr Opin Oncol. 2000;12:550-556. [PubMed] [DOI] |
| 5. | Chen Y, Sun R, Han W, Zhang Y, Song Q, Di C, Ma D. Nuclear translocation of PDCD5 (TFAR19): an early signal for apoptosis? FEBS Lett. 2001;509:191-196. [PubMed] [DOI] |
| 6. | Liu H, Wang Y, Zhang Y, Song Q, Di C, Chen G, Tang J, Ma D. TFAR19, a novel apoptosis-related gene cloned from human leukemia cell line TF-1, could enhance apoptosis of some tumor cells induced by growth factor withdrawal. Biochem Biophys Res Commun. 1999;254:203-210. [PubMed] [DOI] |
| 8. | Yang YH, Zhao M, Li WM, Lu YY, Chen YY, Kang B, Lu YY. Expression of programmed cell death 5 gene involves in regulation of apoptosis in gastric tumor cells. Apoptosis. 2006;11:993-1001. [PubMed] [DOI] |
| 9. | Spinola M, Meyer P, Kammerer S, Falvella FS, Boettger MB, Hoyal CR, Pignatiello C, Fischer R, Roth RB, Pastorino U. Association of the PDCD5 locus with lung cancer risk and prognosis in smokers. J Clin Oncol. 2006;24:1672-1678. [PubMed] [DOI] |
| 10. | Xu XR, Huang J, Xu ZG, Qian BZ, Zhu ZD, Yan Q, Cai T, Zhang X, Xiao HS, Qu J. Insight into hepatocellular carcinogenesis at transcriptome level by comparing gene expression profiles of hepatocellular carcinoma with those of corresponding noncancerous liver. Proc Natl Acad Sci U S A. 2001;98:15089-15094. [PubMed] [DOI] |
| 12. | Inano H, Onoda M, Inafuku N, Kubota M, Kamada Y, Osawa T, Kobayashi H, Wakabayashi K. Potent preventive action of curcumin on radiation-induced initiation of mammary tumorigenesis in rats. Carcinogenesis. 2000;21:1835-1841. [PubMed] [DOI] |
| 13. | Karunagaran D, Rashmi R, Kumar TR. Induction of apoptosis by curcumin and its implications for cancer therapy. Curr Cancer Drug Targets. 2005;5:117-129. [PubMed] [DOI] |
| 14. | Limtrakul P, Anuchapreeda S, Buddhasukh D. Modulation of human multidrug-resistance MDR-1 gene by natural curcuminoids. BMC Cancer. 2004;4:13. [PubMed] [DOI] |
| 16. | Garcea G, Jones DJ, Singh R, Dennison AR, Farmer PB, Sharma RA, Steward WP, Gescher AJ, Berry DP. Detection of curcumin and its metabolites in hepatic tissue and portal blood of patients following oral administration. Br J Cancer. 2004;90:1011-1015. [PubMed] [DOI] |