修回日期: 2012-05-22
接受日期: 2012-06-16
在线出版日期: 2012-07-08
目的: 探讨胆管腺瘤(bile duct adenoma, BDA)的临床病理特点、诊断及鉴别诊断.
方法: 报道2例肝脏BDA并结合文献分析其临床资料、形态学和免疫表型特征.
结果: 2例结节样肝脏肿块均在CT扫描被无意中发现, 患者无临床症状. 肉眼见肿块呈灰白色, 质硬, 其边界完整但无包膜. 组织学显示肿瘤由或圆或不规则的腺管状结构及丰富的纤维性间质构成. 这些腺样结构扩张不明显, 内衬柱状或立方上皮, 细胞核圆而规则, 缺乏异型性. 免疫组织化学显示CK(pan)、CK7及E-cadherin表达阳性.
结论: 胆管腺瘤是一种罕见的独具临床病理特点的良性肝脏肿瘤, 应与高分化胆管细胞癌及Von Meyenberg综合征等相鉴别.
引文著录: 方三高, 马强, 林俐, 李艳青, 曾英, 肖华亮. 胆管腺瘤临床病理特点. 世界华人消化杂志 2012; 20(19): 1791-1795
Revised: May 22, 2012
Accepted: June 16, 2012
Published online: July 8, 2012
AIM: To analyze the clinicopathological characteristics, diagnosis and differential diagnosis of bile duct adenoma (BDA) of the liver.
METHODS: Two cases of BDA of the liver were reported. Their clinical data, pathologic features, and immunophenotypes were analyzed. A review of related literature was also performed.
RESULTS: Asymptomatic nodular masses of the liver were revealed incidentally during a CT scan in both cases. Grossly, the masses were described as firm white lesions with well-defined margins, but were not encapsulated. Histologically, the tumors were composed of round ductal or irregular glandular structures and abundant fibrous stroma. Those adenoid components showed no obvious dilatation and were lined by columnar or cuboidal cells that have regular nuclei and lack dysplasia. Immunohistochemically, the tumor cells were positive for epithelial markers such as CK (pan), CK7 and E-cadherin.
CONCLUSION: BDA of the liver is a rare benigh tumor with unique clinicopathological features. It should be distinguished from some mimics such as well-differentiated intrahepatic cholangiocarcinoma (ICC) and Von Meyenburg's complex.
- Citation: Fang SG, Ma Q, Lin L, Li YQ, Zeng Y, Xiao HL. Analysis of clinicopathological features of bile duct adenoma of the liver. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1791-1795
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1791
胆管腺瘤(bile duct adenoma, BDA)非常罕见, 自1946年Bleyer[1]首次描述以来, 临床仅见个案报道[1-5]. 病理学检查尤其是在术中冷冻检查时, 易与胆管癌或肝脏转移癌相混淆, 可能引起过诊断(over-diagnosis)[6]而导致治疗过度(excessive medical treatment). 本文观察了2例BDA, 分析其临床资料、形态学改变及免疫组织化学表达特点, 结合文献探讨其诊断及鉴别诊断.
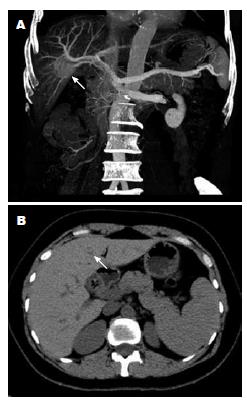
患者1, 男, 61岁, 因"急性胃肠炎"就诊. CT显示肝右叶后下段不均质性结节影, 增强后病变有强化(图1A), 考虑肝癌可能性大. 肝脏形态、轮廓无改变, 肝内胆管未见明显扩张, 肝外胆道无异常, 腹主动脉、肝动脉及其分支走行好, 无狭窄及充盈缺损改变. 未见腹水及明显肿大淋巴结. 入院后行"剖腹探查, 肝脏肿瘤切除术". 术中见右肝后下叶肿块与门静脉相连, 切除部分肝脏及肿瘤送病理检查. 术中及术后病理诊断: (肝右叶)非典型性胆管腺瘤(一种错构瘤)(病理号: 0812424). 随访44 mo未见肿瘤复发. 患者2, 女, 39岁, 门诊以"贫血原因待查"收住. B超发现胰头部实性肿物, CT提示胰头、十二指肠曲交界处见一大小约2.6 cm×2.2 cm的稍低密度结节影, 边界清楚, 增强后肿块强化, 而病灶周围强化更明显. 左肝内叶见一1.0 cm×0.8 cm的略低密度区, 增强后可强化, 呈结节状(图1B). 胰管、肝内、外胆管无明显狭窄及扩张. 肝脏外形、大小正常. 胆囊黏膜粗糙, 囊内见斑片状高密度灶. 脾不大, 质均匀. 腹腔及腹膜后未见肿大淋巴结, 无腹水. 印象: 胰头、十二指肠曲交界处占位, 考虑: (1)胰头癌肝转移? 胃肠间质瘤? (2)左肝占位; (3)胆囊结石; 遂于2011-09-09行胰头部肿块及部分左肝组织切除术. 术中冷冻病理诊断: (胰头)梭形细胞肿瘤, 倾向良性; (肝左叶)胆管腺瘤. 术后病理诊断: (1)(胰头)胃肠道间质瘤(低危险度); (2)(肝左叶)胆管腺瘤(病理号: 1112079). 随访6 mo, 患者恢复良好.
送检标本均由诊断医师规范化取材, 快速冷冻切片观察. 冷冻剩余组织及重新取材标本经40 g/L甲醛固定, 常规脱水, 石蜡包埋, 4 μm厚切片, HE染色, 光镜观察. 免疫组织化学采用EnVision法. 所选用抗体CK(pan)、CK7、CK20、HepPar-1、AFP、CEA、SAM、E-cadherin、P63、c-Myc及Ki-67均为美国DAKO公司产品. 操作步骤按照试剂盒说明书进行. 用PBS代替一抗作空白对照. 阳性细胞数占总细胞数的比例>10%时即判为阳性. Ki-67及P63胞核阳性, 其余抗体胞膜或胞质阳性.
例1的标本为灰白灰褐色组织1块, 大小1.2 cm×0.8 cm×0.5 cm; 例2送检物为右肝Ⅴ、Ⅵ及Ⅶ段, 大小15.0 cm×11.0 cm×6.0 cm, 其内见一结节样肿块, 大小4.0 cm×3.0 cm×3.0 cm, 灰红色及灰白色, 质地中等, 界限清楚, 无包膜.
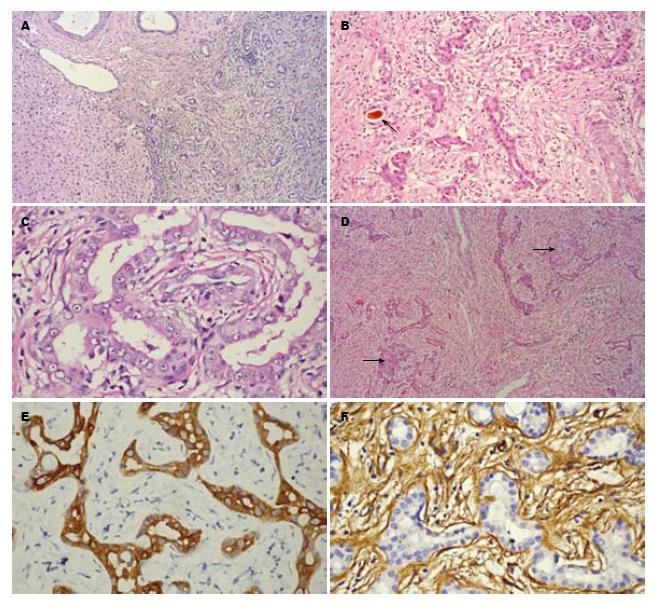
瘤组织与正常肝组织界限欠清, 呈实性小管状或腺样排列(图2A), 弥漫分布于纤维间质中. 增生的胆管密集, 管腔可有可无, 不扩张或扩张不明显, 能产生黏液, 个别区域可见胆栓(图2B). 瘤细胞呈立方形或矮柱状, 大小比较一致, 异型性不明显, 胞浆中等, 红染, 界限清楚. 核圆形或椭圆形, 染色质淡染, 部分可见小核仁, 未见核分裂(图2C). 肿瘤中央区域间质有不同程度的纤维化及透明变性, 外周慢性炎细胞浸润, 灶性肝细胞团被包绕或夹入(图2D). 肿块周围肝组织未见压迫及萎缩.
胆管腺瘤是由类似小叶间胆管或腺管样结构组成的良性或错构瘤性肝脏肿瘤, 比较罕见, 患者常无显著症状, 于影像学检查、腹部手术或尸检偶然发现. 组织学起源尚不明确, 有人认为BDA是一种肝脏错构瘤, 是胆管上皮对损伤作用的一种反应性增生性病变[3], 也有人认为是真性上皮肿瘤, 起源于胆管的异常增生[6,7]. 随着干细胞理论的兴起, 目前认为BDA可能起源于具有多种分化潜能的肝脏肿瘤干细胞. 正如将胆管细胞癌归于肝癌一样, 一般认为BDA是肝脏而不是胆管系统病变. 随着影像学技术进展, 临床检出率逐渐增多, 但经手术证实的较少, 往往表现为肝脏周边部较小的占位性病变. BDA见于任何年龄, 多位于肝膜下, 肿块小, 质地实, 境界清楚, 但无包膜, 内衬单层立方上皮, 细胞形态规则, 无明显异型性[3,6]. 本研究2例均由影像学检查发现, 尤其是患者2, CT发现胰头部占位及肝脏结节性病变, 临床考虑胰头癌肝转移. 术中快速冷冻病理检查见肿块呈腺管状结构, 形态规则, 细胞温和, 经过反复观察, 权衡再三, 诊断为非典型性胆管腺瘤, 随后石蜡切片及免疫组织化学证实这样报告的必要性. 如果观察者缺乏经验, 对其形态学认识不足, 极易误诊为高分化胆管细胞癌或转移性腺癌, 这也是本文展开论述的初衷. 值得一提的是胆管腺瘤与胆管腺纤维瘤的临床表现相似, 形态学改变相近, 抗体表达谱几乎相同, 二者关系非常密切[8]. 本研究中例2胆管腺瘤的间质增生显著, 诊断为胆管腺纤维瘤也未尝不可, 他们的腺管变化几乎无异, 只不过其大小及间质有点区别, 提示胆管腺纤维瘤很可能是在胆管腺瘤的基础上肌纤维母细胞增生进而间质纤维化形成, 或者两者为同一病变的不同发展阶段.
胆管腺瘤的形态学特点为: (1)病变较小, 一般直径0.1-1.0 cm(平均0.58 cm)[3]; (2)病变常位于肝包膜下, 多为单发性结节, 少数多发, 病变界限清楚, 无包膜; (3)病变内可见大量增生的小胆管, 腔内无胆汁, 可分泌黏液, 但管腔不扩张. 上皮细胞分化良好, 无明显的异型性, 伴多量慢性炎细胞浸润; (4)随着病变进展, 增生的胆管和炎细胞逐渐减少, 有的仅见少量胆管成分, 而纤维组织逐渐增多并胶原化, 偶见钙化[2].
胆管腺瘤需要与下列疾病鉴别: (1)高分化胆管细胞癌: 分化良好的腺管呈浸润性生长, 癌性腺体形如略扩大的闰管, 成角并见间质反应, 被覆立方或低柱状胆管上皮, 细胞轻度异型, 可见核分裂, 有时呈乳头状生长突入腔内, 可侵犯肝窦、血管或神经. 高分化胆管细胞癌CEA表达阳性、CD56阴性[9]; 而BDA恰恰相反, CEA表达阴性、CD56表达阳性; (2)Von Meyenberg综合征: 又叫微小错构瘤, 认为是胆管系统尤其小叶间胆管对损伤的局灶性反应, 往往与胆管梗阻或慢性淤胆有关, 实质上为外周小叶间胆管畸形[10]. 绝大多数发生于小儿, 偶有青少年患者的报道. 患者平均年龄15 mo, 男女比例2:1, 以肝右叶多见, 病变更小(平均直径0.5 cm), 多发. 镜下在纤维或者玻璃样变的间质中可见不规则或圆形的腺管样结构, 有轻微的扩张, 被覆扁平或立方上皮, 可有鳞状上皮化生; 而胆管腺瘤体积较大, 管腔不扩张, 腔内可见黏液; (3)胆管腺纤维瘤(biliary adenofibroma, BAF): 与BDA关系非常密切, 呈膨胀性生长, 切面实性, 可见微囊, 镜下病灶中的胆管或小腺管紧密排列, 大小及形态与小胆管相似, 腔内可见胆汁, 但缺乏黏液, 胆管上皮局部可成簇排列, 可见一定异型性, 偶见核分裂. 间质伴有丰富的纤维母细胞成分并致密胶原化[8,11], 伴散在的淋巴细胞、浆细胞浸润; (4)胆管囊腺瘤(bile duct cystadenoma): 临床上有时把胆管囊腺瘤简称为胆管腺瘤, 虽一字之差, 但他们的形态学及生物学行为截然不同. 胆管囊腺瘤起源于肝外胆管, 肿块较大, 呈多中心性囊实性, 囊壁除上皮及纤维外, 可夹杂平滑肌、血管及小胆管. 囊腔大小不等, 内含浆液或黏液[12]. 囊内可见乳头或绒毛样新生物, 被覆不同程度异型增生的分泌性柱状或立方上皮, 可见杯状细胞. 实性区腺腔大小不一, 可呈锯齿状或囊性扩张, 有时上皮形态温和, 貌似良性, 但可复发, 甚至发生侵袭. 而BDA起源于肝内胆管, 体积小, 腺管小而规则、密集, 扩张不明显; (5)肝转移性腺癌: 有消化系等处原发病灶, 结节通常靠近肝表面, 常多发, 呈浸润性生长, 细胞异型性明显, 核分裂易见. 腺体大小不等, 管腔扩张, 中央可见中性粒细胞浸润及其碎片, 背景"脏", 坏死明显. 增强扫描显示环状强化呈"牛眼征". 免疫组织化学villin, CDX2阳性[13]; (6)肝脏间叶性错构瘤: 可能与19号染色体异常转位有关[14]. 通常发生于2岁以下的幼儿, 女性多见, AFP可升高. 肿瘤多为单发巨块, 早期呈实性, 随着肿瘤生长, 逐渐分隔为多个囊肿. 镜下病灶由排列紊乱的原始间叶组织、血管及胆管构成, 但无肝小叶结构. 胆管扩张, 上皮细胞呈柱状, 分化成熟, 无核分裂; (7)原发性硬化性胆管炎: 可能是由免疫介导的进展性疾病, 可出现黄疸、血清学IgG4等异常并可见多脏器病变[15]. 以肝内、外胆管的弥漫性进行性炎性反应、纤维化和多发性狭窄为主要病理特征, 胆管增厚、僵硬及胶原化, 可见成角或扭曲、变形, 管壁周围同心圆样纤维素沉积, 管腔狭窄, 病变不均匀时呈串珠样改变. 胆管上皮往往萎缩, 形态学易与胆管细胞癌间质反应或纤维化的胆管腺瘤混淆, 但BDA病变局限, 一般无临床症状; (8)炎性假瘤: 常由肥胖的(肌)纤维母细胞和大量慢性炎细胞组成. 病变成份复杂, 多样性显著, 瘤组织排列疏密不均, 并可见不等量的泡沫细胞. 除非个别散在的小胆管被包绕, 一般无上皮成分; (9)肝脏胚胎性肿瘤: 如肝母细胞瘤, 主要见于婴幼儿, 肿块较大, 恶性, 呈浸润性生长, 组织结构复杂多变, 有上皮型(包括胎儿型、胚胎型)、上皮-间叶混合型和间叶型等亚型. 有时可见鳞状上皮灶及髓外造血. 免疫组织化学显示肿瘤细胞双向分化, 表达CK(pan)及vimentin; (10)肝局灶性结节性再生: 异常增生的肝细胞索组成, 血窦丰富, 病灶边界清晰, 但无包膜. 瘢痕性纤维从中问向周围将病灶分割, 呈结节状. 临床或影像学可能类似BDA, 但组织学容易鉴别: 再生结节的小胆管一般散在位于增生的肝细胞结节汇管区, 而BDA的腺管非常密集, 位于正常肝组织内.
胆管腺瘤的治疗首选手术, 可行局部切除, 关键是明确诊断, 为此, 预约术中冷冻且判断安全手术切缘是必要的. 患者一般预后良好, 文献上尚未见有肿瘤复发和恶变的报道[3,6]. 本文患者术后分别随访6 mo及51 mo, 恢复良好, 均未见复发.
胆管腺瘤(BDA)发生于肝脏被膜下, 极为罕见. 肿块较小, 多无临床症状, 如临床及病理医生对BDA的临床病理特征缺乏认识, 对肝细胞背景中出现灶性密集的腺管状结构感到困惑, 容易误诊.
邰升, 副教授, 哈尔滨医科大学附属二院肝胆外科
本文主要对2例肝脏BDA的临床资料、病理形态学特征及免疫表型进行总结, 并复习相关文献, 分析肝脏BDA临床及病理形态学特征, 重点探讨其病理诊断及鉴别诊断.
通过病例报道, 将肝脏中可能形成或者混杂有腺管样结构的疾病或病变进行纵向和横向对比. 拓展病理诊断思路, 防止误诊漏诊, 杜绝形态学诊断过头进而由此引起的临床治疗过度.
文章内容新颖, 病例资料完整, 鉴别诊断详细, 对胆管腺瘤的病理诊断有一定帮助.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Bleyer LF. Multiple bile duct adenoma. Proc Inst Med Chic. 1946;16:205. [PubMed] |
| 3. | Allaire GS, Rabin L, Ishak KG, Sesterhenn IA. Bile duct adenoma. A study of 152 cases. Am J Surg Pathol. 1988;12:708-715. [PubMed] [DOI] |
| 4. | Kim YS, Rha SE, Oh SN, Jung SE, Shin YR, Choi BG, Byun JY, Jung ES, Kim DG. Imaging findings of intrahepatic bile duct adenoma (peribiliary gland hamartoma): a case report and literature review. Korean J Radiol. 2010;11:560-565. [PubMed] [DOI] |
| 5. | Bhathal PS, Hughes NR, Goodman ZD. The so-called bile duct adenoma is a peribiliary gland hamartoma. Am J Surg Pathol. 1996;20:858-864. [PubMed] [DOI] |
| 6. | Bosman FT, Carneiro F, Hruban RH, Theise ND. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press 2010; 233-238. |
| 7. | Takahashi S, Takada K, Kawano Y, Miyanishi K, Ishiwatari H, Hayashi T, Sagawa T, Sato T, Sato Y, Takimoto R. [Cholangiocarcinoma with bile duct adenoma and hamartoma-like lesion in the bile duct]. Nihon Shokakibyo Gakkai Zasshi. 2010;107:461-469. [PubMed] |
| 8. | Tsui WM, Loo KT, Chow LT, Tse CC. Biliary adenofibroma. A heretofore unrecognized benign biliary tumor of the liver. Am J Surg Pathol. 1993;17:186-192. [PubMed] [DOI] |
| 9. | Gütgemann I, Haas S, Berg JP, Zhou H, Büttner R, Fischer HP. CD56 expression aids in the differential diagnosis of cholangiocarcinomas and benign cholangiocellular lesions. Virchows Arch. 2006;448:407-411. [PubMed] [DOI] |
| 10. | Salles VJ, Marotta A, Netto JM, Speranzini MB, Martins MR. Bile duct hamartomas--the von Meyenburg complex. Hepatobiliary Pancreat Dis Int. 2007;6:108-109. [PubMed] |
| 11. | Gurrera A, Alaggio R, Leone G, Aprile G, Magro G. Biliary adenofibroma of the liver: report of a case and review of the literature. Patholog Res Int. 2010;2010:504584. [PubMed] |
| 12. | Zen Y, Pedica F, Patcha VR, Capelli P, Zamboni G, Casaril A, Quaglia A, Nakanuma Y, Heaton N, Portmann B. Mucinous cystic neoplasms of the liver: a clinicopathological study and comparison with intraductal papillary neoplasms of the bile duct. Mod Pathol. 2011;24:1079-1089. [PubMed] [DOI] |
| 13. | Hughes NR, Goodman ZD, Bhathal PS. An immunohistochemical profile of the so-called bile duct adenoma: clues to pathogenesis. Am J Surg Pathol. 2010;34:1312-1318. [PubMed] [DOI] |
| 14. | Shehata BM, Gupta NA, Katzenstein HM, Steelman CK, Wulkan ML, Gow KW, Bridge JA, Kenney BD, Thompson K, de Chadarévian JP. Undifferentiated embryonal sarcoma of the liver is associated with mesenchymal hamartoma and multiple chromosomal abnormalities: a review of eleven cases. Pediatr Dev Pathol. 2011;14:111-116. [PubMed] [DOI] |
| 15. | Fujita T, Kojima M, Gotohda N, Takahashi S, Nakagohri T, Konishi M, Ochiai A, Kinoshita T. Incidence, clinical presentation and pathological features of benign sclerosing cholangitis of unknown origin masquerading as biliary carcinoma. J Hepatobiliary Pancreat Sci. 2010;17:139-146. [PubMed] [DOI] |