修回日期: 2012-05-05
接受日期: 2012-06-16
在线出版日期: 2012-07-08
目的: 检测食管癌组织中P-糖蛋白(P-glycoprotein, PgP)、胸苷酸磷酸化酶(thymidine phosphorylase, TP)、谷胱甘肽-S-转移酶π(glutathione S-transferase π, GST-π)、多药耐药相关蛋白(multidrug resistance-associated protein, MRP)表达情况, 探讨其与食管癌化疗敏感性的关系.
方法: 选取我院食管癌患者58例, 用免疫组织化学方法检测食管癌组织中多药耐药相关蛋白PgP、TP、GST-π、MRP蛋白的表达情况; 行双铂方案新辅助化疗, 分析化疗疗效与PgP、TP、GST-π、MRP蛋白表达差异的关系.
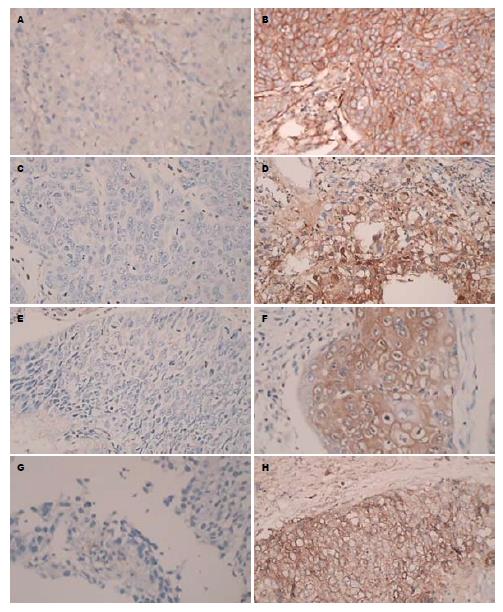
结果: PgP阳性颗粒分布于胞膜和胞浆; TP阳性颗粒分布于细胞胞浆和胞核; GST-π阳性颗粒分布于胞浆; MRP阳性颗粒分布于胞膜和胞浆, 他们在食管癌组织中都存在一定的表达率, 表达率分别为41.37%、32.76%、20.69%和37.93%. 化疗有效组患者与化疗无效组患者相比较, 食管癌组织中PgP、GSH和MRP的阳性表达率低, TP阳性表达率高, 两组之间有显著性差异.
结论: 食管癌组织中PgP、TP、GST-π、MRP存在一定的表达率; PgP、GST-π、MRP表达率低而TP表达率高, 化疗治疗的效果好.
引文著录: 李明, 张成辉, 张永喜. PgP、TP、GST-π、MRP在食管癌组织中的表达及与化疗的关系. 世界华人消化杂志 2012; 20(19): 1768-1772
Revised: May 5, 2012
Accepted: June 16, 2012
Published online: July 8, 2012
AIM: To study the relationship between expression of P-glycoprotein (PgP), thymidine phosphorylase (TP), glutathione S-transferase-π (GST-π), and multidrug resistance-associated protein (MRP) and response to chemotherapy in patients with esophageal cancer.
METHODS: Fifty-eight patients gastroscopically and pathologically diagnosed with esophageal cancer were included in this study. Esophageal cancer samples collected from these patients were used to detect the expression of PgP, TP, GST-π, and MRP by immunohistochemistry. All the patients underwent neoadjuvant chemotherapy with double-platinum regimen. Response to chemotherapy and expression of PgP, TP, GST-π, and MRP was analyzed.
RESULTS: PgP-positive particles were distributed in the membrane and cytoplasm, TP-positive particles in the cytoplasm and nucleus, GST-π-positive particles in the cytoplasm, and MRP-positive particles in the cytoplasm. The positive rates of PgP, TP, GST-π, and MRP expression in esophageal cancer were 41.37%, 32.76%, 20.69% and 37.93%, respectively. Compared to patients not responding to chemotherapy, the positive rates of PgP, GSH and MRP expression were significantly lower and that of TP was significantly higher in patients having response to chemotherapy.
CONCLUSION: Low expression of PgP, GST-π, and MRP and high expression of TP are conducive to chemotherapy in patients with esophageal cancer.
- Citation: Li M, Zhang CH, Zhang YX. Correlation between PgP, TP, GST-π and MRP expression and response to chemotherapy in patients with esophageal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1768-1772
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1768
肿瘤细胞多药耐药是肿瘤患者化疗失败的常见原因, 是肿瘤细胞逃逸和抵御化疗药物杀伤的内在基础. 他通过直接将药物排出、降低药物毒性、破坏药物作用靶点等方式参与肿瘤细胞的耐药. 食管癌是一种对化疗较敏感的实体瘤, 但临床上发现部分难治性食管癌对化疗极不敏感, 预后较差, 可能是内在性耐药机制作用的结果. 为了解食管癌患者肿瘤细胞的耐药机制及其对化疗的影响, 我们利用敏感的免疫组织化学技术, 对食管癌组织中的P-糖蛋白(P-glycoprotein, PgP)、胸苷酸磷酸化酶(thymidine phosphorylase, TP)、谷胱甘肽-S-转移酶π(glutathione S-transferase π, GST-π)、多药耐药相关蛋白(multidrug resistance-associated protein, MRP)进行测定, 观察其表达情况及与化疗疗效的关系.
58例取自2002-2005年在我院不能接受手术治疗的食管癌患者, 其中男32例, 女26例, 平均年龄52.4岁±10.9岁, 所有患者治疗前均未接受过放射和化学药物治疗. 行胃镜活检肿瘤组织, 行常规HE染色, 组织病理学确诊为食管癌, 其中鳞癌52例, 腺癌6例. 在化疗前, 行免疫组织化学染色测定PgP、TP、GSH、MRP的蛋白表达, 所用试剂鼠源性抗PgP、鼠抗人TP单克隆抗体、GST-π多克隆抗体、MRP1单克隆抗体、SP试剂盒、防脱片剂APES、显色剂DAB均购自北京中山生物技术有限公司. 化疗给予双铂方案, 具体用药为: CBP 300 mg/(m2·d), d1 iv; DDP 25 mg/(m2·d), d2-5 iv; 5-Fu 500 mg/(m2·d), d1-5 iv. 21 d为1周期, 至少2个周期.
将选取固定好的肿瘤标本经脱水、常规石蜡包埋, 制成4 μm连续组织切片, 按照常规的步骤进行免疫组织化学染色(SP法), 以已知染色阳性切片为阳性对照, PBS代替一抗为阴性对照. 光学显微镜400倍下随机计数5个高倍视野的癌细胞, 以细胞膜、浆、核中存在粗细一致的棕黄色颗粒为阳性, 其中PgP阳性颗粒分布于胞膜胞浆呈黄褐色, TP阳性颗粒分布于胞浆和/或胞核呈棕黄色, GST-π阳性颗粒分布于胞浆及胞核呈黄褐色或棕黄色, MRP阳性颗粒分布于胞浆呈黄褐色. 根据染色的分布范围和显色程度, 即阳性细胞数比例分为4级: 1级(-)阳性细胞<25%, 2级(+)阳性细胞25%-49%, 3级(+++)阳性细胞50%-74%, 4级(++++)阳性细胞>75%, 结果由2位病理医师双盲读片判定. 疗效评价参照WHO关于可测定或可评价病变标准进行评定; 疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)以及进展(PD); 临床有效为CR+PR; 临床受益为CR+PR+SD.
统计学方法 应用SPSS17.0统计软件进行处理, 率的比较采用χ2检验, 检验水准α = 0.05或0.01, P<0.05时认为两组之间的差异有显著性, P<0.01时认为两组之间的差异有极显著性.
58例食管癌标本全部进行免疫组织化学染色检测, PgP阳性颗粒分布于胞膜胞浆, 其表达率为24/58(41.37%); TP阳性颗粒分布于细胞胞浆和胞核, 呈棕黄色至深棕色染色, 强阳性染色的细胞大多位于肿瘤浸润的边缘部位, 其表达率为19/58(32.76%); GST-π阳性颗粒分布于胞浆, 其表达率为12/58(20.69%); MRP阳性颗粒分布于胞浆, 其表达率为22/80(37.93%)(图1).
58例患者在第2个疗程结束后3 wk进行化疗疗效评价, 其中缓解者(完全缓解及部分缓解)有41例, 有效率为70.69%(41/58); 无缓解者17例(无变化及进展), 占29.31%. 分析有效组患者和无效组患者癌组织中PgP、TP、GSH、MRP的表达情况: PgP在有效组中(完全缓解及部分缓解的41例患者)的阳性表达率为26.83%(11/41), 在无效组中(无变化及进展的17例患者)的阳性表达率为76.47%(13/17), 两组间差异有显著性(P<0.01); TP在有效组的阳性表达率为43.90%(18/41), 在无效组中的阳性表达率为5.88%(1/17), 两组间差异有显著性(P<0.01); GST-π在有效组的阳性表达率为7.32%(3/41), 在无效组中的阳性表达率为52.94%(9/17), 两组间差异有显著性(P<0.01); MRP在有效组的阳性表达率为24.39%(10/41), 在无效组中的阳性表达率为70.59%(12/17), 两组间差异有显著性(P<0.01, 表1).
| 有效组 | 无效组 | χ2值 | P值 | |||
| % | n | % | n | |||
| PgP阳性表达 | 26.83 | 11 | 76.47 | 13 | 12.21 | <0.01 |
| TP阳性表达 | 43.90 | 18 | 5.88 | 1 | 7.89 | <0.01 |
| GST-π阳性表达 | 7.32 | 3 | 52.94 | 9 | 12.59 | <0.01 |
| MRP阳性表达 | 24.39 | 10 | 70.59 | 12 | 10.89 | <0.01 |
根据资料报道[1], 90%的化疗失败和耐药有关, 肿瘤的多药耐药是指肿瘤细胞可耐受结构、功能和杀伤机制不同的多种药物的致死剂量, 耐药的最根本原因是多药耐药基因MDR表达升高. 他可使抗癌药物泵出细胞致细胞内药物浓度降低, 还可直接与药物结合, 使药物无法进入细胞发挥杀伤作用, 使肿瘤细胞产生耐药性.
Juliano等[2]最早在研究MDR表型的中国仓鼠卵巢细胞(cHo)发现一种分子量为170 kDa的细胞膜糖蛋白过度表达, 同时发现该耐药细胞对药物的摄入与亲代细胞无明显差异, 但细胞外排药物的能力显著增强, 他们推测细胞的多药耐药现象是由于该糖蛋白降低了细胞膜的通透性使药物外排增加, 细胞内药物积聚减少而产生多药耐药现象, 人们将此糖蛋白称为PgP. Goldstein等[3]采用狭缝印迹分析法检测了400多例各种肿瘤组织的MDRI mRNA表达水平, 食管癌低度表达, 本实验与其相符. 肿瘤细胞的耐药性可以存在于化疗之前, 即内在性耐药, 也可以在化疗中产生, 即获得性耐药[4]. 过去认为MDR是一种获得性耐药, 是多次反复化疗后药物诱发的结果, 但随着对MDR的深入研究, 有学者[5]对此观点提出疑问, 他们认为存在有先天耐药. 我们对未行化疗药物治疗的食管癌贲门癌患者的P-糖蛋进行检测, 发现阳性表达存在, 表明食管癌和贲门癌患者中有部分存在内在性耐药. 这与临床上食管癌贲门癌化疗效果欠佳, 化疗只起一定辅助作用的表现是一致的[6,7]. 因此, 在食管癌的综合治疗中仍应强调手术的作用, 同时合理制定化疗方案, 包括选择化疗药物的种类、剂量和应用时机. 本组资料显示, PgP在食管癌的表达中, 阳性组较对照组化疗反应率偏低, 差别有显著性. 治疗时, 应选用合适的PgP阴性的患者, 或者已被临床证明有效的MDR-1基因逆转剂或PgP阻断剂进行联合应用, 使化疗发挥更有效的作用.
5-Fu经胸苷酸磷酸化酶(thymidine phosphorylase, TP)作用转化为核苷酸类似物FDUMP, 抑制胸苷酸合成酶(thymidylate synthetase, TS), 干扰dTMP合成与DNA复制, 从而杀伤肿瘤细胞. 因此, TP作为5-Fu代谢途径中的关键酶, 其在肿瘤组织中的表达水平, 直接决定化疗的疗效. TP是一种同型二聚体酸性蛋白, 基因位于人染色体22q13, 每条单链含有482个氨基酸, TP分子以其丝氨酸残基与核营的磷酸通过共价键结合, 但不能与肝素结合. TP催化胸腺嘧啶核苷, 脱氧尿嘧啶核苷及其类似物可逆性磷酸化为相应的碱基和2-脱氧右旋核糖', 也催化脱氧核糖基转移形成新的核, 可促进5-Fu代谢, 他可能是5-Fu的关键基因, 催化药物前体5-DFUR去磷酸化转变为5-Fu, 增强药物的效应, 而5-Fu已广泛应用于临床作为食管癌的辅助治疗, 因此, 对癌组织中TP的表达进行检测, 有助于选择合适的化疗方案. 本研究发现: TP蛋白表达越高, 5-FU作用后, 化疗的效应就越好, 这于Mader等[8]在大肠癌中的研究结论相一致, TP可反映大肠癌对5-FU的化疗敏感性, 抑制TP活性可使该药细胞毒性下降79%.
MRP是分子量为190 kDa的膜糖蛋白, 具有能量依赖性药物外排泵作用, 参与某些亲电子药物的跨膜转运. MRP位于人染色体16p13.1区[9], 为ATP结合的盒式膜转运蛋白(ATP-binding cassette, ABC)家族成员, 由相互融合的5个相对独立的结构域组成: 3个疏水的跨膜区(membrane spanning domain, MSD)和2个核苷酸结合功能区(nucleotide binding domain, NBD)组成, 后者袋状结构中含两个ATP结合基调, 通过水解ATP供能逆浓度梯度转运相适底物. 用流式细胞仪观察柔红霉素在MRP过表达的多种细胞系中药代动力学的变化, 发现同敏感株相比, 药物在耐药细胞内蓄积的量明显减少, 胞吐和/或药物外排加快, 因而认为加快抗癌药物从靶细胞中排出, 降低药物浓度是MRP介导MDR的主要作用机制[10-12]. 本实验结果显示, MRP的表达对化疗影响较大, 患者MRP的表达率越高, 其化疗反应性越差, 化疗前MRP的表达越少, 化疗效果越好.
谷胱甘肽-S-转移酶(glutathione S transferase, GST)是一组具有多种生物功能的蛋白质, 能够催化谷胱甘肽与多种亲电子物质结合, 在细胞解毒和代谢中起重要作用[13]. GST-π是5个亚型中最重要的一型, 广泛存在于动植物中的酶, 分为α、μ、π 3类, 主要催化还原型谷胱甘肽与亲电性物质间的反应, 对生物细胞起保护作用. 有文献报道[14], GST-π是谷胱甘肽S-转移酶系统中的一个亚类, 在体内与各种电离化合物及细胞毒药物结合, 从而使之代谢、减毒. GST-π的表达在肿瘤发生起始阶段就已存在, 而与病变进展及肿瘤分期无关, GST-π可能是食管上皮癌变的一个早期标志物, 他是细胞内主要的非蛋白肽, 可使结合到细胞DNA的铂类减少, 使DNA-铂加合物修饰增强而导致瘤细胞对顺铂等铂制剂耐药. 本研究发现: GST-π蛋白表达越高, 顺铂化疗后的效果就越差, 这与Wang等[15]的研究结果"GST-π在耐烷基化物(包括铂类)药联合化疗中起重要作用"相符合.
化疗耐药是Ⅲ、Ⅳ期食管癌化疗效果不佳的一个重要原因, 通过以上PgP、TP、GST-π、MRP的表达的测定, 我们可以初步判断食管癌可能存在的化疗耐药状况, 从而在临床治疗时选择合适的化疗方案.
食管癌的多药耐药基因对化疗的影响如何, 可以通过分析化疗疗效与耐药基因表达之间的关系, 进而指导临床化疗的目的性. 耐药基因的表达是化疗研究的重点, 长期以来众多学者都做出了很多的努力, 发表了很多方面的报道, 但食管癌上较少, 且病理分型上不同, 需要更细化的分析和化疗疗效的关系.
姜慧卿, 教授, 河北医科大学第二医院消化科
本研究中的几个耐药基因都比较常见, 但是他们在食管癌中同时表达的研究少, 以及他们对化疗疗效的影响鲜有报道, 本文旨在这两方面做出研究.
本研究用免疫组织化学的方法检测耐药蛋白在食管癌组织中的表达, 并分析和化疗疗效间的关系, 有助于指导化疗药物的选择.
本文研究思路明晰, 方法经典, 总体评价良好.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Loe DW, Deeley RG, Cole SP. Biology of the multidrug resistance-associated protein, MRP. Eur J Cancer. 1996;32A:945-957. [PubMed] [DOI] |
| 2. | Juliano RL, Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants. Biochim Biophys Acta. 1976;455:152-162. [PubMed] [DOI] |
| 3. | Goldstein LJ. MDR1 gene expression in solid tumours. Eur J Cancer. 1996;32A:1039-1050. [PubMed] [DOI] |
| 5. | 戴 建华, 李 国仁, 刘 晓峰, 苗 福禄, 陈 光辉, 邵 仲凡, 王 燕清, 白 玲. 食管贲门癌组织相关耐药基因表达水平及其临床意义. 医学理论与实践. 2002;15:137-139. |
| 6. | Nooter K, Herweijer H. Multidrug resistance (mdr) genes in human cancer. Br J Cancer. 1991;63:663-669. [PubMed] [DOI] |
| 7. | al-Awqati Q. Regulation of ion channels by ABC transporters that secrete ATP. Science. 1995;269:805-806. [PubMed] [DOI] |
| 8. | Mader RM, Sieder AE, Braun J, Rizovski B, Kalipciyan M, Mueller MW, Jakesz R, Rainer H, Steger GG. Transcription and activity of 5-fluorouracil converting enzymes in fluoropyrimidine resistance in colon cancer in vitro. Biochem Pharmacol. 1997;54:1233-1242. [PubMed] [DOI] |
| 9. | Cole SP, Bhardwaj G, Gerlach JH, Mackie JE, Grant CE, Almquist KC, Stewart AJ, Kurz EU, Duncan AM, Deeley RG. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 1992;258:1650-1654. [PubMed] [DOI] |
| 10. | van der Kolk DM, Vellenga E, Müller M, de Vries EG. Multidrug resistance protein MRP1, glutathione, and related enzymes. Their importance in acute myeloid leukemia. Adv Exp Med Biol. 1999;457:187-198. [PubMed] |
| 11. | Stride BD, Valdimarsson G, Gerlach JH, Wilson GM, Cole SP, Deeley RG. Structure and expression of the messenger RNA encoding the murine multidrug resistance protein, an ATP-binding cassette transporter. Mol Pharmacol. 1996;49:962-971. [PubMed] |
| 12. | Zaman GJ, Flens MJ, van Leusden MR, de Haas M, Mülder HS, Lankelma J, Pinedo HM, Scheper RJ, Baas F, Broxterman HJ. The human multidrug resistance-associated protein MRP is a plasma membrane drug-efflux pump. Proc Natl Acad Sci U S A. 1994;91:8822-8826. [PubMed] [DOI] |
| 13. | Hamada S, Kamada M, Furumoto H, Hirao T, Aono T. Expression of glutathione S-transferase-pi in human ovarian cancer as an indicator of resistance to chemotherapy. Gynecol Oncol. 1994;52:313-319. [PubMed] [DOI] |
| 14. | Sasano H, Miuazaki S, Shiga K, Goukon Y, Nishihira T, Nagura H. Glutathione S-transferase in human esophageal carcinoma. Anticancer Res. 1993;13:363-368. [PubMed] |
| 15. | Wang LS, Chow KC, Wu YC, Lin TY, Li WY. Inverse expression of dihydrodiol dehydrogenase and glutathione-S-transferase in patients with esophageal squamous cell carcinoma. Int J Cancer. 2004;111:246-251. [PubMed] [DOI] |