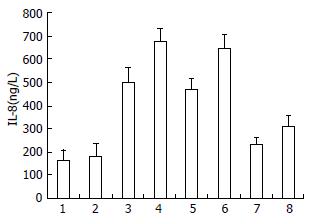修回日期: 2012-03-24
接受日期: 2012-04-19
在线出版日期: 2012-07-08
目的: 研究促肾上腺皮质释放因子(CRF)介导肠上皮细胞中Toll样受体4(toll-like receptor 4, TLR4)的表达, 并探讨其可能通过的受体途径.
方法: 常规培养人结肠上皮细胞株HT-29细胞, 将HT-29细胞分为正常对照组(不加刺激剂), 脂多糖(lipopolysaccharide, LPS)刺激组(LPS 20 μg/L刺激24 h), 促肾上腺皮质释放因子(corticotrophin-releasing factor, CRF)刺激组(CRF 20 μg/L刺激24 h), CRF+LPS刺激组(预先CRF 20 μg/L刺激12 h, 更换细胞液后再与LPS 20 μg/L刺激12 h), CRF+Antalarmin组(CRF与Antalarmin 20 μg/L共刺激24 h), CRF+LPS+Antalarmin组(CRF与Antalarmin 20 μg/L共刺激12 h后再以LPS刺激12 h), CRF+Astressin2B组(CRF与Astressin2B 20 μg/L共刺激24 h), CRF+LPS+Astressin2B组(CRF与Astressin2B 20 μg/L共刺激12 h后再以LPS刺激12 h). 刺激结束后, 收取各组HT-29细胞, RT-PCR法和免疫印迹法检测各组上皮细胞中TLR4 mRNA和蛋白的表达. ELISA法检测各组细胞上清液中IL-8的表达.
结果: CRF可以诱导人结肠上皮细胞株HT-29细胞中TLR4表达导致IL-8分泌增多(P<0.05), CRF1受体拮抗剂不能有效地阻滞CRF对TLR4的诱导(P>0.05, CRF+LPS组 vs CRF组), CRF2受体拮抗剂可阻滞CRF对TLR4的诱导(P<0.05, CRF+LPS组 vs CRF组).
结论: CRF通过CRF2受体通路介导肠上皮细胞中TLR4的表达.
引文著录: 杨丽, 郑鹏远, 刘志强. CRF通过CRF2受体介导肠上皮细胞中TLR4的表达. 世界华人消化杂志 2012; 20(19): 1763-1767
Revised: March 24, 2012
Accepted: April 19, 2012
Published online: July 8, 2012
AIM: To investigate the effect of corticotrophin-releasing factor (CRF) on the expression of toll-like receptor 4 (TLR4) in human intestinal epithelial cell line HT-29.
METHODS: HT-29 cells were divided into eight groups: non-treated group, LPS group (treated with 20 μg/L LPS for 24 h), CRF group (treated with 20 μg/L CRF for 24 h), LPS plus CRF group (pretreated with 20 μg/L CRF for 12 h and then treated with 20 μg/L LPS for 12 h), astressin 2B plus CRF group (pretreated with 20 μg/L astressin 2B for 12 h and then treated with 20 μg/L CRF), antalarmin plus CRF group (pretreated with 20 μg/L antalarmin for 12 h and then treated with 20 μg/L CRF), astressin 2B plus LPS group (pretreated with 20 μg/L astressin 2B for 12 h and then treated with 20 μg/L LPS), and antalarmin plus LPS group (pretreated with 20 μg/L antalarmin for 12 h and then treated with 20 μg/L LPS). The expression of TLR4 mRNA and protein was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blotting, respectively. The secretion of interleukin-8 in the culture supernatants was determined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: CRF could induce the expression of TLR4 in HT-29 cells and result in increased interleukin-8 secretion (P < 0.05). CRFR2 antagonist astressin 2B inhibited the expression of LR4 (P < 0.05, CRF+LPS group vs CRF group), while CRF1 antagonist antalarmin had no significant effect on the expression of TLR4 (P > 0.05, CRF+LPS group vs CRF group).
CONCLUSION: The induction of TLR4 expression by CRF in human intestinal epithelial cells is mediated by the CRF2 receptor.
- Citation: Yang L, Zheng PY, Liu ZQ. Activation of TLR4 by CRF in human intestinal epithelial cells is mediated by the CRF2 receptor. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1763-1767
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1763.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1763
大量研究发现精神心理压力不仅可以诱发和/或加剧炎症性肠病症状[1], 还可以促进实验性结肠炎的产生[2], 促肾上腺皮质释放因子(corticotrophin-releasing factor, CRF)是一个重要的应激效应因子, 下丘脑中枢中的CRF通过诱导乙酰胆碱(acetylcholine, ACTH)促进糖皮质激素生成限制炎症介质的释放, 进而限制炎症反应, 而周围组织中的CRF则由免疫细胞、神经纤维等其他细胞释放局部发挥着促炎作用[3]. 周围型的CRF已不局限于应激因子, 更多的是一种促炎因子, CRF通过与其不同受体(CRF-R1或CRF-R2)结合而发挥不同生物学效应. 胃肠道中普遍存在着CRF-R1和CRF-R2, 溃疡性结肠炎组织中亦发现CRF的表达增高[4,5], 但增高的CRF是如何导致肠黏膜炎症并不清楚, 有研究显示CRF可诱导巨噬细胞中TLR4表达[6], 而Toll样受体4(toll-like receptor 4, TLR4)在肠黏膜上皮组织中的先天性免疫调节中发挥着重要作用[7], 与炎症性肠病肠黏膜炎症的发生密切相关, 本实验通过CRF及脂多糖(lipopolysaccharide, LPS)以及CRF-R1受体拮抗剂Antalarmin和CRF-R2受体拮抗剂Astressin2B干预刺激结肠上皮细胞系HT-29细胞, 观察各组上皮细胞中TLR4的表达情况, 探讨CRF在肠上皮细胞中对TLR4的影响及可能通过的受体途径.
HT-29细胞株购自中国科学院细胞库, CRF购自Sigma公司; LPS购自Sigma公司; 兔抗人Toll4受体多克隆抗体购自Santa Cruz公司; 辣根过氧化物酶标记的羊抗兔IgG, 兔抗人β-actin单克隆抗体, 化学发光试剂盒, RPMI 1640培养液等.
1.2.1 细胞培养: 结肠癌上皮细胞株HT-29细胞复苏后, 接种培养于含100 mL/L小牛血清、100 U/mL青霉素、链霉素的RPMI 1640培养基中, 置于37 ℃、50 mL/L CO2孵箱中培养, 每天更换培养液, 4-5 d后以0.25%的胰酶消化传代. 取对数生长期细胞, 以5×105的密度接种于50 mL培养瓶, 细胞生长至5×106后, 换不含小牛血清的RPMI 1640培养液. 实验共分8组, 正常对照组(不加刺激剂), LPS刺激组(LPS 20 μg/L刺激24 h), CRF刺激组(CRF 20 μg/L刺激24 h), CRF+LPS刺激组(预先CRF 20 μg/L刺激12 h, 更换细胞液后再与LPS 20 μg/L刺激12 h), CRF+Antalarmin组(CRF与Antalarmin 20 μg/L共刺激24 h), CRF+LPS+Antalarmin组(CRF与Antalarmin 20 μg/L共刺激12 h后再以LPS刺激12 h), CRF+Astressin2B组(CRF与Astressin2B 20 μg/L共刺激24 h), CRF+LPS+Astressin2B组(CRF与Astressin2B 20 μg/L共刺激12 h后再以LPS刺激12 h). 刺激结束后, 收取各组HT-29细胞, PBS洗涤2次, 分别用来提取RNA, RT-PCR法检测各组TLR4受体mRNA; 提取总蛋白, 免疫印迹法检测各组TLR4蛋白量.
1.2.2 RT-PCR法检测HT-29细胞TLR4 mRNA的表达: 按照Triregent产品说明书提取RNA, 设计并合成人TLR4和人GAPDH(内参照)引物(表1). RT-PCR反应按照试剂盒说明书进行, 94 ℃预变性2 min; 94 ℃变性30 s, 58 ℃(内参58 ℃)退火30 s, 72 ℃延伸2 min, 35个循环; 72 ℃补延伸6 min. 阴性对照用RNase-free Water代替cDNA进行反应, 琼脂糖凝胶电泳、凝胶图像系统处理分析测定.
| 引物名称 | 引物序列(5'-3') | 引物大小(bp) |
| TLR4 | ||
| sense | TGGATACGTTTCCTTATAAG | 507 |
| Anti-asense | GAAATGGAGGCACCCCTTC | |
| GAPDH | ||
| sense | GCACCGTCAAGGCTGAGAAC | 138 |
| Anti-asense | TGGTGAAGACGCCAGTGGA |
1.2.3 免疫印迹法检测各组HT-29细胞TLR4蛋白的表达: 将刺激后的各组HT29细胞, 分别加入细胞蛋白裂解液提取蛋白, Bradford方法测定蛋白浓度, 配置8%的SDS-PAGE凝胶, 将总蛋白加样, 恒压电泳, 恒流转膜, 加入5%的脱脂奶粉封闭过夜, 加一抗兔抗人Toll4受体多克隆抗体, 孵育2 h, PBS洗涤2次, 加辣根过氧化物酶标记的羊抗兔IgG, 孵育2 h, ECL显色, 暗室曝光. 凝胶图像分析.
1.2.4 ELSIA法检测IL-8: 取各组细胞上清液, 按照说明书进行检测.
统计学处理 所有数据计量资料用mean±SD表示, 多组间比较采用单因素方差分析, 采用SPSS13.0软件做统计学分析, P<0.05有统计学意义.
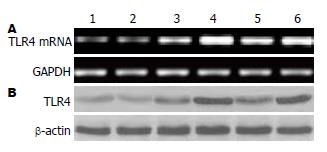
LPS刺激组TLR4 mRNA(0.31±0.04 vs 0.28±0.02)和蛋白表达水平(0.48±0.17 vs 0.45±0.12)与对照组相比较, 差异无统计学意义(P>0.05); CRF组TLR4 mRNA(1.05±0.06 vs 0.28±0.02)和蛋白表达水平(1.08±0.21 vs 0.45±0.12)与对照组相比较, 差异有统计学意义(P<0.05), 而CRF+LPS组则更高于CRF组(1.68±0.05 vs 1.05±0.06, 1.81±0.18 vs 1.08±0.21), 两组之间差异有统计学意义(P<0.05, 图1, 2). 进一步检测各组细胞中IL-8水平, 发现与TLR4活化一致, 也相应增高(图3).
CRF+Antalarmin组中TLR4 mRNA和蛋白表达水平与CRF组比较, 差异无统计学意义(1.01±0.03 vs 1.05±0.06, 1.01±0.16 vs 1.08±0.21, P>0.05); CRF+LPS+Antalarmin组与CRF+LPS相比较, 亦无显著性差异(1.62±0.04 vs 1.68±0.05, 1.78±0.21 vs 1.81±0.18, 图1).
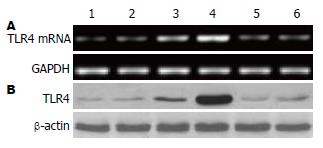
CRF+Astressin2B组中TLR4 mRNA和蛋白表达水平与CRF组比较, 两组之间差异有统计学意义(0.29±0.03 vs 1.05±0.06, 0.48±0.26 vs 1.08±0.21, P<0.05), CRF+LPS+Astressin2B组与CRF+LPS组比较, 两组之间差异亦有统计学意义(0.31±0.06 vs 1.68±0.05, 0.51±0.22 vs 1.81±0.18, P<0.05, 图2).
近年研究发现CRF信号系统活化可能是压力诱发或加剧炎症性肠病的机制[8], 已经证实肠道活化的CRF信号可以导致促炎反应, 并有研究发现肽聚糖诱导的结肠炎组织中CRF表达是增高的; 相反CRF缺陷小鼠肠道炎症反应会减轻[9], 溃疡性结肠炎组织中CRF表达也增高, 但是增高的CRF是如何导致炎症发生并不清楚. 已有研究显示CRF可以促进单核细胞释放趋化因子, 巨噬细胞释放IL-6、TNF-α、IL-1[10], 但对肠上皮细胞的作用了解甚少.
肠上皮细胞暴露于高浓度的细菌及共栖菌, 对腔内细菌的识别是肠腔内环境稳定的关键. 而TLR对宿主的保护起着重要作用, 他们通过启动先天性免疫反应调整对细菌病毒的适应性免疫[11,12]. 研究显示, 正常结肠上皮细胞中TLR4呈低表达水平, 对LPS反应很弱, 但在炎症性肠病肠黏膜组织中呈现显著高表达[13,14]. TLR4低水平表达及信号微弱是肠上皮细胞的适应性免疫调节, 使肠上皮免遭对腔内细菌不必要的免疫反应所引起的组织破坏, 因此TLR4与腔内共栖菌之间的调节信号对于增强保护, 促进损伤修复, 维持肠黏膜的正常屏障作用至关重要[15].
本研究显示正常肠上皮细胞中LPS不能刺激TLR4表达增高, 但是CRF刺激组TLR4 mRNA和蛋白表达水平则增高, 提示CRF可以促进肠上皮细胞中TLR4表达, 而CRF刺激后再次以LPS刺激则TLR4 mRNA和蛋白表达水平显著增高, 提示CRF不仅可直接刺激结肠上皮TLR4增高, 还可促进结肠上皮对LPS反应增加, 进而促进TLR4表达增高. 而肠上皮细胞中TLR4表达增高可导致对腔内细菌免疫耐受异常, 导致对LPS的反应增加, 引起促炎因子IL-8释放增多[16]. 我们进一步检测各组细胞中IL-8水平, 发现与TLR4活化一致, 也相应增高.
CRF肽家族的受体分为CRF1型受体和CRF2型受体, 二者均属于G蛋白耦联受体, 胃肠组织中均有CRF1受体和CRF2受体分布, CRF与不同受体结合而发挥不同的生物学效应. 例如胃排空与CRF2受体有关, 结肠动力与CRF1受体有关[17], CRF2受体缺陷性小鼠肠道炎症是减轻的[18]. 但是CRF在结肠上皮中对TLR4的调节作用通过何种受体尚不清楚. 我们对以上实验分别以CRF1受体拮抗剂和CRF2受体拮抗剂进行干预阻滞发现, CRF2受体拮抗剂可有效阻滞CRF对TLR4的诱导表达, 而CRF1受体拮抗剂不能有效地阻滞, 与TLR4表达水平一致的肠上皮细胞分泌IL-8的变化, 均提示CRF对结肠上皮细胞TLR4的诱导有可能是通过CRF2受体通路.
近年已有发现TLR4抗体可以减轻实验性结肠炎中的炎症反应[19], 有效阻滞TLR4的活化已成为近年为减轻炎症性肠病中肠道炎症的治疗热点. 而本实验明确CRF在结肠上皮中对TLR4的调节作用以及通过的受体途径, 将为明确应激导致炎症的发生以及可能的治疗提供理论基础.
越来越多临床观察及实验数据发现, 心理压力不仅可以导致功能性肠病的发生, 也可诱发或加剧器质性疾病如炎症性肠病的产生, 但是压力等应激因素是如何导致肠黏膜免疫紊乱并不清楚.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
促肾上腺皮质释放因子(CRF)是一个重要的应激因子, 不仅中枢组织中有表达, 周围组织也存在, 近年已发现肠黏膜组织中也有CRF的表达, 并发现其与炎症发生有关.
TLR4作为先天性免疫与获得性免疫的桥梁, 在肠上皮细胞对腔内共栖菌的稳定中起着关键作用. 肠黏膜TLR4的表达调控异常可导致肠黏膜炎症的发生.
本实验通过研究CRF在结肠上皮中对TLR4的调节作用以及通过的受体途径, 将为明确应激导致炎症的发生提供理论基础.
本研究立意较新, 研究结果对阐明IBD的发病机制有一定意义, 结论可靠, 统计学正确, 为今后进一步开展体内研究奠定了基础.
编辑: 张姗姗 电编:鲁亚静
| 1. | Mawdsley JE, Rampton DS. Psychological stress in IBD: new insights into pathogenic and therapeutic implications. Gut. 2005;54:1481-1491. [PubMed] [DOI] |
| 2. | Melgar S, Engström K, Jägervall A, Martinez V. Psychological stress reactivates dextran sulfate sodium-induced chronic colitis in mice. Stress. 2008;11:348-362. [PubMed] [DOI] |
| 3. | Lightman SL. The neuroendocrinology of stress: a never ending story. J Neuroendocrinol. 2008;20:880-884. [PubMed] [DOI] |
| 4. | Gross KJ, Pothoulakis C. Role of neuropeptides in inflammatory bowel disease. Inflamm Bowel Dis. 2007;13:918-932. [PubMed] [DOI] |
| 5. | Kawahito Y, Sano H, Mukai S, Asai K, Kimura S, Yamamura Y, Kato H, Chrousos GP, Wilder RL, Kondo M. Corticotropin releasing hormone in colonic mucosa in patients with ulcerative colitis. Gut. 1995;37:544-551. [PubMed] [DOI] |
| 6. | Tsatsanis C, Androulidaki A, Alissafi T, Charalampopoulos I, Dermitzaki E, Roger T, Gravanis A, Margioris AN. Corticotropin-releasing factor and the urocortins induce the expression of TLR4 in macrophages via activation of the transcription factors PU.1 and AP-1. J Immunol. 2006;176:1869-1877. [PubMed] |
| 7. | Abreu MT, Thomas LS, Arnold ET, Lukasek K, Michelsen KS, Arditi M. TLR signaling at the intestinal epithelial interface. J Endotoxin Res. 2003;9:322-330. [PubMed] |
| 8. | Paschos KA, Kolios G, Chatzaki E. The corticotropin-releasing factor system in inflammatory bowel disease: prospects for new therapeutic approaches. Drug Discov Today. 2009;14:713-720. [PubMed] [DOI] |
| 9. | Gay J, Kokkotou E, O'Brien M, Pothoulakis C, Karalis KP. Corticotropin-releasing hormone deficiency is associated with reduced local inflammation in a mouse model of experimental colitis. Endocrinology. 2008;149:3403-3409. [PubMed] [DOI] |
| 10. | Moss AC, Anton P, Savidge T, Newman P, Cheifetz AS, Gay J, Paraschos S, Winter MW, Moyer MP, Karalis K. Urocortin II mediates pro-inflammatory effects in human colonocytes via corticotropin-releasing hormone receptor 2alpha. Gut. 2007;56:1210-1217. [PubMed] [DOI] |
| 11. | Takahashi K, Sugi Y, Nakano K, Tsuda M, Kurihara K, Hosono A, Kaminogawa S. Epigenetic control of the host gene by commensal bacteria in large intestinal epithelial cells. J Biol Chem. 2011;286:35755-35762. [PubMed] [DOI] |
| 12. | Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol. 2009;124:3-20; quiz 21-22. [PubMed] [DOI] |
| 13. | Abreu MT, Arnold ET, Thomas LS, Gonsky R, Zhou Y, Hu B, Arditi M. TLR4 and MD-2 expression is regulated by immune-mediated signals in human intestinal epithelial cells. J Biol Chem. 2002;277:20431-20437. [PubMed] [DOI] |
| 14. | Suzuki M, Hisamatsu T, Podolsky DK. Gamma interferon augments the intracellular pathway for lipopolysaccharide (LPS) recognition in human intestinal epithelial cells through coordinated up-regulation of LPS uptake and expression of the intracellular Toll-like receptor 4-MD-2 complex. Infect Immun. 2003;71:3503-3511. [PubMed] [DOI] |
| 15. | Rakoff-Nahoum S, Paglino J, Eslami-Varzaneh F, Edberg S, Medzhitov R. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. Cell. 2004;118:229-241. [PubMed] [DOI] |
| 16. | Bhattacharyya S, Borthakur A, Pant N, Dudeja PK, Tobacman JK. Bcl10 mediates LPS-induced activation of NF-kappaB and IL-8 in human intestinal epithelial cells. Am J Physiol Gastrointest Liver Physiol. 2007;293:G429-G437. [PubMed] [DOI] |
| 17. | Mayer EA, Collins SM. Evolving pathophysiologic models of functional gastrointestinal disorders. Gastroenterology. 2002;122:2032-2048. [PubMed] [DOI] |
| 18. | Kokkotou E, Torres D, Moss AC, O'Brien M, Grigoriadis DE, Karalis K, Pothoulakis C. Corticotropin-releasing hormone receptor 2-deficient mice have reduced intestinal inflammatory responses. J Immunol. 2006;177:3355-3361. [PubMed] |
| 19. | Ungaro R, Fukata M, Hsu D, Hernandez Y, Breglio K, Chen A, Xu R, Sotolongo J, Espana C, Zaias J. A novel Toll-like receptor 4 antagonist antibody ameliorates inflammation but impairs mucosal healing in murine colitis. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1167-G1179. [PubMed] [DOI] |