修回日期: 2012-04-26
接受日期: 2012-05-18
在线出版日期: 2012-06-18
目的: 研究肠上皮细胞(intestinal epithelial cells, IEC)来源的整合素αVβ6对骨髓来源树突状细胞(bone marrow-derived dendritic cells, BMDCs)功能的影响.
方法: 分离、培养小鼠IEC和DC, IEC经卵清蛋白(ovalbumin, OVA)刺激后, 多步离心法制备外泌体(exosome). 应用免疫胶体金对外泌体中的整合素αVβ6进行定性, 通过免疫磁珠技术, 分离获取DC, 流式细胞仪检测分离后DC纯度. 然后将分离后的DC分5组, 分别为空白组、OVA组、外泌体组、外泌体+抗整合素αVβ6抗体组、外泌体+羊抗小鼠IgG组, 观察各组对脂多糖(lipopolysaccharide, LPS)刺激的反应. ELISA法检测DC在LPS刺激前后IL-12p70的表达. LPS刺激前活性转化生长因子β1(transforming growth factor-β1, TGF-β1)以及总TGF-β1的表达.
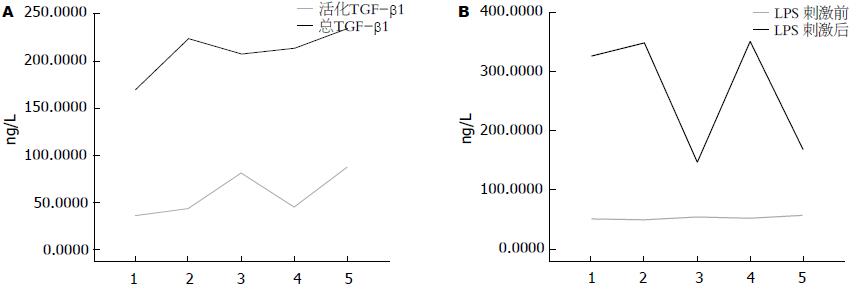
结果: OVA组与空白组相比, 总TGF-β1表达明显增高(226.636±40.355 vs 176.947±23.072, P<0.05), 但活化TGF-β1表达无明显变化(P>0.05). 空白组与外泌体+抗整合素αVβ6抗体组相比, 活化TGF-β1表达无明显变化(P>0.05), 但总TGF-β1表达明显增高(P<0.05). 外泌体组和外泌体+羊抗小鼠IgG组与空白组相比, 活化TGF-β1和总TGF-β1表达均明显增高(P<0.05). 相比空白对照组, LPS刺激48 h后外泌体组和外泌体+羊抗小鼠IgG组IL-12p70表达明显降低(P<0.05), OVA组及外泌体+抗整合素αVβ6抗体组IL-12p70表达无明显差异(P>0.05).
结论: IEC来源整合素αVβ6能增加DC活性, 以及TGF-β1和总TGF-β1的表达量, 并拮抗LPS对BMDC的促成熟作用.
引文著录: 李晓蕾, 郑鹏远, 李付广, 刘志强. 肠上皮细胞来源整合素αVβ6对树突状细胞功能的影响. 世界华人消化杂志 2012; 20(17): 1553-1558
Revised: April 26, 2012
Accepted: May 18, 2012
Published online: June 18, 2012
AIM: To investigate the effect of intestinal epithelial cell (IEC)-derived integrin αVβ6 on the biological characteristics of bone marrow-derived dendritic cells (BMDCs).
METHODS: IECs and BMDCs were separated from BALB/c mice and cultured. After IECs were stimulated with ovalbumin (OVA), exosomes were prepared by multiple-step centrifugation. The expression of integrin αVβ6 in exosomes was examined by using the immune colloidal gold technique. Dendritic cells (DCs) were separated using immunomagnetic beads, and the concentration of DCs was determined by flow cytometry. DCs were then divided into five groups: blank group, OVA group, exosomes group, exosomes plus anti-αVβ6 antibody group, and exosomes plus goat anti-mouse IgG group. After these groups of DCs were treated with LPS, the expression of IL-12p70 was detected. In addition, the expression of active and total TGF-β1 was detected before LPS stimulation.
RESULTS: Compared to the blank group, the expression levels of total TGF-β1 increased (both P < 0.05) and those of active TGF-β1 showed no significant changes (both P > 0.05) in the OVA group and exosomes plus anti-αVβ6 antibody group; and the expression levels of both active and total TGF-β1 increased in the exosomes group and exosomes plus goat anti-mouse IgG group (both P < 0.05). Compared to the blank group, the expression of IL-12p70 was significantly reduced (both P < 0.05) in the exosomes group and exosomes plus goat anti-mouse IgG group, but showed no significant changes in the OVA group and exosomes plus anti-αVβ6 antibody group (both P > 0.05) 48 h after stimulation with LPS.
CONCLUSION: Intestinal epithelial cell-derived integrin αVβ6 can increase the expression of active TGF-β1 and total TGF-β1 in DCs and antagonize LPS-induced BMDC maturation.
- Citation: Li XL, Zheng PY, Li FG, Liu ZQ. Intestinal epithelial cell-derived integrin αVβ6 affects the function of dendritic cells. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1553-1558
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1553
随着新型抗生素和疫苗的发展及其在临床上的应用, 感染性疾病的治疗已取得巨大成功, 但是在过去的几十年中, 过敏性疾病却呈现出明显上升趋势[1]. 食物过敏(food allergy, FA)和相关疾病在全球范围内迅速增加, 大约4%-8%的儿童和1%-2%的成年人对食物抗原具有IgE介导的高反应性[2]. FA是以肠道口服耐受受损和Th2极化为特征的免疫反应, Treg功能失常将导致过敏性疾病的发生[3,4], 导致口服耐受(oral tolerance)受损和以Th2细胞为主的免疫反应. 耐受型树突状细胞(tolerogenic dendritic cell, TolDC)[5,6]是一类未成熟DC亚型, 高表达TGF-β或/和IL-10, 但表达低水平共刺激分子, TolDC在Treg产生和口服耐受中起关键作用.
肠道黏膜细胞特别是肠上皮细胞(intestinal epithelial cells, IEC), 能够促进TolDC的分化[7-9]. 正常IEC能够增加DC细胞表达TGF-β, 而TGF-β在维持DC耐受表型中起重要作用[10]. TGF-β主要通过与TGF-β受体结合来调节免疫功能, 可通过凋亡方式诱导细胞死亡[11]. 整合素αVβ6(integrin αVβ6)可结合在非活性(latent form)TGF-β的羧基末端的精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid)RGD序列上[12], 从而使TGF-β更易于与其受体结合并进一步形成活化TGF-β. 外泌体是由一些细胞分泌的直径在30-100 nm的小囊泡, 由多囊泡体膜与细胞膜融合而生成[13,14], 他可作为细胞间信息传递、转运的载体. IEC来源的外泌体能够携带细胞成分和摄入的蛋白质成分, 从而诱导肠道免疫反应[15,16].
卵清蛋白(OVA)因具有可靠的抗原性而被认为是一种理想的食物抗原模型. 脂多糖(lipopolysaccharide, LPS)是内毒素, 可引起强烈免疫反应, 促进炎性细胞分泌多种细胞因子. 由于肠道组织分离的DC数量少, 无法满足实验需求, 所以本研究是通过体外培养小鼠IEC和骨髓来源DC, 用OVA刺激IEC后来源的外泌体与DC共同培养, 用来研究整合素αVβ6对TolDC产生的影响, 从而进一步了解食物过敏发生的分子机制, 并为临床治疗提供理论依据.
Balb/c小鼠购自河南省实验动物中心. 明胶、胶原酶Ⅺ、中性蛋白酶Ⅰ、LPS、OVA均购自北京鼎国公司; 高糖DMEM完全培养基由高糖DMEM培养液(Gibco公司)、HEPES 2×10-2 mol/L、L-谷氨酰胺2×10-3 mol/L、青霉素100 kU/L、链霉素0.1 g/L和100 mL/L胎牛血清(杭州四季青公司)构成; RPMI 1640完全培养基由RPMI 1640培养液(Gibco公司)、HEPES 2×10-2 mol/L、L-谷氨酰胺2×10-3 mol/L、青霉素100 kU/L、链霉素0.1 g/L和100 mL/L胎牛血清(杭州四季青公司)构成. 重组小鼠表皮生长因(epidermal growth factor, EGF)、重组小鼠GM-CSF(rmGM-CSF)、重组小鼠IL-4(rmIL-4)均购自Peprotech公司. PE-抗小鼠CD11c(美国BioLegend公司), 抗整合素αVβ6的单克隆抗体2G2(Biogen公司, 美国), 小鼠IL-12p70、TGF-β1 ELISA定量试剂盒(武汉博士德生物科技有限公司), 胶体金标记马抗小鼠lgG(华美公司), 羊抗小鼠lgG(上海工硕生物技术有限公司).
1.2.1 小鼠肠上皮细胞的分离培养: 小鼠IEC分离培养参照文献[17]: 孕17-19 d Balb/c小鼠, 颈椎脱臼法处死, 浸入750 mL/L乙醇中5-7 min, 无菌条件下取胎鼠肠组织, PBS液冲洗多次, 眼科剪将肠组织剪碎至1 mm3, 用胶原酶Ⅺ和中性蛋白酶Ⅰ消化肠组织, 滤网过滤后离心洗涤4次, 将沉淀物用含有EGF 10 μg/L的高糖DMEM培养基重悬后转移至铺有2%明胶的细胞培养板上, 置于37 ℃、50 mL/L CO2培养箱中常规培养, 48 h后换液. 以后每72 h换液1次, 细胞为贴壁细胞, 培育14 d收取细胞. 参照文献[17], 用HE染色进行细胞形态学检查, 细胞呈圆形或多角形, 细胞核为圆形或卵圆形, 核周可见空泡结构. 免疫组织化学染色, 用抗小鼠CK-18抗体来定性小鼠肠上皮细胞, 可见细胞质中出现棕黄色颗粒, 染色细胞占细胞总数90%以上, 满足实验的要求.
1.2.2 外泌体的制备: IEC在培养液中加入OVA 20 mg/L刺激4 h后, 收集IEC, PBS液冲洗细胞3次, 以去除多余的OVA, 再重新置于不含胎牛血清的培养基过夜. 4 ℃ 300 r/min离心10 min, 4 ℃ 1 200 r/min离心20 min, 4 ℃ 10 000 r/min离心30 min, 以去除细胞碎片, 然后将上清液4 ℃ 100 000 r/min超速离心1 h后, 收集外泌体, 重悬于PBS液备用. 用紫外分光光度计对外泌体进行定量, 最后用RPMI 1640完全细胞营养液调整其浓度为1 g/L, Western blot和胶体金检测参照试剂说明书进行操作. 每孔加入外泌体30 μL, 6%PAGE分离胶进行SDS-PAGE电泳分离, 电转移至醋酸纤维膜上, 加入一抗4 ℃结合10 h, 加入胶体金标记的二抗孵育2 h, 观察染色结果.
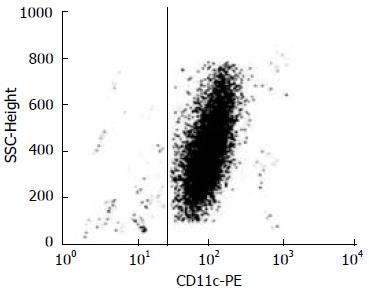
1.2.3 小鼠骨髓来源树突细胞的分离培养: 取Balb/c小鼠, 颈椎脱臼法处死, 浸入750 mL/L乙醇中5-7 min, 无菌取出股骨和胫骨, 用灭菌注射器抽取PBS液, 将针头从两端插入骨髓腔, 反复冲洗出骨髓, 收入离心管中, 以1 500 r/min离心6 min, 弃上清, 加入红细胞裂解液, 移液管吹打2-3 min, 离心洗涤后, 用RPMI 1640完全培养液调整细胞浓度为2×108/L, 接种于6孔培养板, 每孔3 mL, 加入添加20 μg/L的rmGM-CSF和10 μg/L的rmIL-4的培养基, 置于37 ℃、50 mL/L CO2培养箱中培养. 48 h后全量换液, 之后隔天半量换液. 收集培养7 d后的悬浮细胞, PBS液重悬细胞, 轻轻吹打混匀. 取200 μL链霉亲和素标记磁珠与CD11c抗体混匀, 磁条上过柱, 然后将含有DC细胞PBS液在磁条上过柱, 磁珠抗体与DC复合物滞留于柱内, 样品滴加完毕后, 将分选柱从磁分离器上取下, 再向柱内滴加PBS液洗涤磁珠, 收集冲洗液, 用PBS液重悬细胞, 调整细胞浓度至1×109/L, 1 mL PBS重悬细胞, 流式细胞仪检测CD11c阳性细胞达到90%以上, 达到实验要求.
1.2.4 DC细胞和外泌体的共培养: 培养7 d的DC分为5组: 分别为OVA组(加入OVA 20 mg/L)、空白对照组(不加任何刺激物质)、外泌体组(加入外泌体10 μL)、外泌体+抗整合素αVβ6抗体组(加入外泌体10 μL和抗整合素αVβ6抗体10 mg/L)、外泌体+羊抗小鼠IgG组(加入外泌体10 μL+羊抗小鼠IgG 10 mg/L), 各组分别加入1 mg/L LPS共培养, 收集LPS加入前后的上清液冻存待测.
1.2.5 活性TGF-β1和总TGF-β1的检测: 收集各组LPS刺激前的上清液, 分成2份, 一份加入2 mol/L盐酸10 μL, 反应10 s后, 再加入2 mol/L的碳酸氢钠10 μL; 另一份加入2 mol/L盐酸10 μL和2 mol/L的碳酸氢钠10 μL发生化学反应后的混合液. 按ELISA试剂盒说明书进行操作, 未经过盐酸酸化的为活化TGF-β1量, 经盐酸酸化的为总TGF-β1量.
1.2.6 IL-12p70的检测: 收集各组LPS刺激前后的上清液, 检测各组LPS刺激前后IL-12p70的表达量, 按ELISA试剂盒说明书进行操作.
统计学处理 结果以mean±SD表示, 实验结果采用SPSS17.0统计软件包分析, 用单因素方差分析比较各组间的统计学差异, 采用α = 0.05为假设检验标准.
分离培养后的小鼠IEC的HE和CK-18免疫组织化学染色如图1. 整合素αVβ6的免疫胶体金标注如图2, 流式细胞仪筛选分析DC的结果如图3.
OVA刺激DC后,与空白组对比, 总TGF-β1表达(226.636±40.355 vs 176.947±23.072, P<0.05)明显增加, 而活化的TGF-β1表达(43.322±13.479 vs 35.930±10.108, P>0.05)无明显变化. 外泌体组与空白组相比, 活化TGF-β1表达(80.532±26.167 vs 35.930±10.108, P<0.05)和总TGF-β1表达(210.749±31.509 vs 176.947±23.072, P<0.05)均明显增加. 与空白组对比, 抗整合素αVβ6抗体组总TGF-β1表达明显增加(P<0.05), 而活化TGF-β1表达无明显变化(P>0.05), 作为对照抗体羊抗小鼠IgG组活化TGF-β1和总TGF-β1表达均明显上升(P<0.05, 图4A, 表1). 结果提示IEC来源的αVβ6可以使非活性的TGF-β1转换成活化状态.
FA和相关疾病在世界上广泛存在, 但其发病机制仍不清楚. 一般认为Th2细胞极化、DC激活、Treg、微生物产物及食物蛋白等参与FA的发生发展[18,19]. 口服耐受是指通过口服途径接触抗原后, 机体免疫系统对该抗原表现为低反应状态, 即免疫抑制状态. 口服免疫耐受功能受损或诱导口服耐受的失败将导致肠道对食物抗原的高反应性[20]. 口服耐受表现为肠道免疫环境的一种特殊状态, 是多种免疫细胞参与的复杂网路[20], 其机制可能包括克隆无反应力或克隆清除, 或Treg产生及其调节作用, 活化的Treg能够表达调节性分子TGF-β、IL-10, 从而抑制其他T细胞(如Th1和Th2细胞)的功能. Treg活性丧失很可能在打破口服耐受和食物过敏发生中起重要作用[21,22], 而TolDC在Treg产生和口服耐受中起关键作用. 肠道固有层拥有更多的TolDC, IEC在该细胞产生过程中具有重要作用, 而TolDC能够使肠道针对食物抗原保持免疫耐受状态.
αVβ6是整合素αV亚家族的一种(包括: αVβ1、αVβ3、αVβ5、αVβ6和αVβ8), 只在肠道、呼吸道上皮细胞中表达. 他在正常上皮细胞中表达量很少或难以检测, 但其表达量随着上皮细胞的激活而迅速增加[23]. 我们前期研究结果显示: 体外培养IEC, 经食物抗原刺激后, IEC中αVβ6的表达量增加; 体外得到的外泌体经食物抗原刺激后, 能够携带αVβ6和抗原, 并可被DC捕获. DC可表达具有生物活性的IL-12p70, 他是启动Th1反应的关键细胞因子, 可诱导Th0向Th1分化, 启动细胞免疫, 决定免疫激活还是免疫耐受. 基于前期研究基础, 我们推测: IEC来源的αVβ6在肠道TolDC产生中可能具有关键作用, 本实验表明经OVA刺激的IEC来源外泌体含有αVβ6, 外泌体使DC表达活性TGF-β1的量明显增加. TolDC高表达TGF-β, TGF-β1不影响DC的分化, 因此也不影响DC的特异性标志CD11c的表达, 但他抑制DC的成熟和IL-12p70的表达. 研究发现, 当肠黏膜屏障被破坏, 上皮通透性增高时, 食物抗原的经上皮转运会明显加强, 肠道免疫系统对微生物产物和食物大分子抗原摄取增多, 这样会加剧机体对食物抗原的Th2极化, 发生食物过敏[24].
总之, 本实验证明, 完整的IEC经OVA刺激后形成的含有αVβ6的外泌体对DC的成熟、功能以及细胞因子的表达均有抑制作用. 在DC的培养体系中加入IEC来源的αVβ6能够培养出更为幼稚的DC, 且对外源性的刺激(LPS)呈低反应性, 所以IEC来源的αVβ6在诱导免疫耐受上可能更有优势, 对TolDC的产生具有关键作用.
食物过敏在世界上广泛存在, 最近几十年发病率在全球范围内提高, 然而食物过敏的病因和发病机制尚不清楚.
陈敬贤, 教授, 安徽医科大学微生物学教研室
最新研究发现, IEC来源的整合素αvβ6在肠道耐受型树突状细胞(TolDC)产生中可能具有关键作用, 成为研究热点.
Yang等研究表明, 体外培养IEC, 经食物抗原刺激后, IEC中整合素αvβ6的表达量增加; 体外得到的外泌体经食物抗原刺激后, 能够携带整合素αvβ6和抗原, 并可被树突状细胞(DC)捕获.
本研究结果显示, IEC来源的整合素αvβ6可以使转化生长因子(TGF)发生活化, 并能够有效抑制脂多糖(LPS)对DC的催熟作用, 提示IEC来源的整合素αvβ6在TolDC产生中具有重要作用, 为后期研究提供理论依据.
本文通过体外实验, 研究肠上皮来源的整合素αVβ6对DC功能的影响, 这对剖析口服耐受形成的分子机制, 做了有意义的探索.
编辑: 张姗姗 电编:鲁亚静
| 1. | Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2008. J Allergy Clin Immunol. 2009;123:319-327. [PubMed] [DOI] |
| 2. | Vierk KA, Koehler KM, Fein SB, Street DA. Prevalence of self-reported food allergy in American adults and use of food labels. J Allergy Clin Immunol. 2007;119:1504-1510. [PubMed] [DOI] |
| 3. | Mizrahi M, Ilan Y. The gut mucosa as a site for induction of regulatory T-cells. Curr Pharm Des. 2009;15:1191-1202. [PubMed] [DOI] |
| 4. | Shreffler WG, Wanich N, Moloney M, Nowak-Wegrzyn A, Sampson HA. Association of allergen-specific regulatory T cells with the onset of clinical tolerance to milk protein. J Allergy Clin Immunol. 2009;123:43-52. e7. [PubMed] |
| 5. | Lagaraine C, Lemoine R, Baron C, Nivet H, Velge-Roussel F, Lebranchu Y. Induction of human CD4+ regulatory T cells by mycophenolic acid-treated dendritic cells. J Leukoc Biol. 2008;84:1057-1064. [PubMed] [DOI] |
| 6. | Massacand JC, Kaiser P, Ernst B, Tardivel A, Bürki K, Schneider P, Harris NL. Intestinal bacteria condition dendritic cells to promote IgA production. PLoS One. 2008;3:e2588. [PubMed] [DOI] |
| 7. | Bozza S, Montagnoli C, Gaziano R, Rossi G, Nkwanyuo G, Bellocchio S, Romani L. Dendritic cell-based vaccination against opportunistic fungi. Vaccine. 2004;22:857-864. [PubMed] [DOI] |
| 8. | Watanabe T, Higuchi K, Kobata A, Nishio H, Tanigawa T, Shiba M, Tominaga K, Fujiwara Y, Oshitani N, Asahara T. Non-steroidal anti-inflammatory drug-induced small intestinal damage is Toll-like receptor 4 dependent. Gut. 2008;57:181-187. [PubMed] [DOI] |
| 9. | Ehlers M, Ravetch JV. Opposing effects of Toll-like receptor stimulation induce autoimmunity or tolerance. Trends Immunol. 2007;28:74-79. [PubMed] [DOI] |
| 10. | Butler M, Ng CY, van Heel DA, Lombardi G, Lechler R, Playford RJ, Ghosh S. Modulation of dendritic cell phenotype and function in an in vitro model of the intestinal epithelium. Eur J Immunol. 2006;36:864-874. [PubMed] [DOI] |
| 11. | Godlewski MM, Hallay N, Bierła JB, Zabielski R. Molecular mechanism of programmed cell death in the gut epithelium of neonatal piglets. J Physiol Pharmacol. 2007;58 Suppl 3:97-113. [PubMed] |
| 12. | Munger JS, Huang X, Kawakatsu H, Griffiths MJ, Dalton SL, Wu J, Pittet JF, Kaminski N, Garat C, Matthay MA. The integrin alpha v beta 6 binds and activates latent TGF beta 1: a mechanism for regulating pulmonary inflammation and fibrosis. Cell. 1999;96:319-328. [PubMed] [DOI] |
| 13. | Luketic L, Delanghe J, Sobol PT, Yang P, Frotten E, Mossman KL, Gauldie J, Bramson J, Wan Y. Antigen presentation by exosomes released from peptide-pulsed dendritic cells is not suppressed by the presence of active CTL. J Immunol. 2007;179:5024-5032. [PubMed] |
| 14. | Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol. 2009;9:581-593. [PubMed] [DOI] |
| 15. | Mallegol J, Van Niel G, Lebreton C, Lepelletier Y, Candalh C, Dugave C, Heath JK, Raposo G, Cerf-Bensussan N, Heyman M. T84-intestinal epithelial exosomes bear MHC class II/peptide complexes potentiating antigen presentation by dendritic cells. Gastroenterology. 2007;132:1866-1876. [PubMed] [DOI] |
| 16. | Ghannad F, Nica D, Fulle MI, Grenier D, Putnins EE, Johnston S, Eslami A, Koivisto L, Jiang G, McKee MD. Absence of alphavbeta6 integrin is linked to initiation and progression of periodontal disease. Am J Pathol. 2008;172:1271-1286. [PubMed] [DOI] |
| 18. | Ramirez-Espain X, Ruiz L, Martin-Malpartida P, Oschkinat H, Macias MJ. Structural characterization of a new binding motif and a novel binding mode in group 2 WW domains. J Mol Biol. 2007;373:1255-1268. [PubMed] [DOI] |
| 19. | Mandron M, Ariès MF, Brehm RD, Tranter HS, Acharya KR, Charveron M, Davrinche C. Human dendritic cells conditioned with Staphylococcus aureus enterotoxin B promote TH2 cell polarization. J Allergy Clin Immunol. 2006;117:1141-1147. [PubMed] [DOI] |
| 20. | Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2009. J Allergy Clin Immunol. 2010;125:85-97. [PubMed] [DOI] |
| 21. | Huter EN, Punkosdy GA, Glass DD, Cheng LI, Ward JM, Shevach EM. TGF-beta-induced Foxp3+ regulatory T cells rescue scurfy mice. Eur J Immunol. 2008;38:1814-1821. [PubMed] [DOI] |
| 22. | Khattri R, Cox T, Yasayko SA, Ramsdell F. An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat Immunol. 2003;4:337-342. [PubMed] [DOI] |
| 23. | DiCara D, Rapisarda C, Sutcliffe JL, Violette SM, Weinreb PH, Hart IR, Howard MJ, Marshall JF. Structure-function analysis of Arg-Gly-Asp helix motifs in alpha v beta 6 integrin ligands. J Biol Chem. 2007;282:9657-9665. [PubMed] [DOI] |