修回日期: 2012-05-18
接受日期: 2012-05-18
在线出版日期: 2012-06-18
目的: 研究藤梨根提取物(ethanol extract from radix of Actinidia chinensis, EERAC)对人大肠癌HT-29荷瘤裸鼠移植瘤的抑制和诱导凋亡作用.
方法: 提取EERAC, 以大肠癌HT-29细胞对40只Balb/c-nu/nu裸鼠进行荷瘤造模, 并随机将分为3个EERAC处理组(低剂量组5 mg/kg、中剂量组10 mg/kg、高剂量组20 mg/kg), 空白对照组(生理盐水)和阳性对照组(5-Fu, 25 mg/kg), 每组8只, 连续用药8 d后, 测定各实验组的肿瘤抑制率、脾脏指数. 通过脾脏效应细胞培养, 测定NK细胞的活性度. 免疫组织化学法测定各组荷瘤裸鼠体内凋亡相关基因Bcl-2、Bax、Caspase-3的蛋白表达水平.
结果: 与空白对照组相比, EERAC对HT-29移植瘤均有明显的抑制作用, 各剂量组的抑瘤率为9.12%、20.13%、37.81%, 与药物剂量呈正比; EERAC各剂量组对荷瘤裸鼠脾脏指数较生理盐水组和5-Fu组有显著增加(P<0.05); 不同剂量的EERAC均可使NK细胞活性度增加(P<0.05); EERAC作用后, HT-29荷瘤裸鼠体内的Bcl-2表达减弱, Bax、Caspase-3表达水平增高, Bcl-2/Bax比值下降, 其作用也呈剂量相
关性.
结论: EERAC对大肠癌细胞HT-29荷瘤裸鼠具有抑制瘤体生长和诱导癌细胞凋亡的作用, 其作用机制可能为抑制荷瘤裸鼠体内Bcl-2的表达, 提高Bax、Caspase-3表达水平, 下调Bcl-2/Bax. EERAC对荷瘤裸鼠免疫系统无不良影响, 且能一定程度上提高机体的免疫功能.
引文著录: 陈永杰, 史仁杰. 藤梨根提取物对HT-29荷瘤裸鼠的抑制及诱导凋亡作用的影响. 世界华人消化杂志 2012; 20(17): 1547-1552
Revised: May 18, 2012
Accepted: May 18, 2012
Published online: June 18, 2012
AIM: To explore the regulatory effect of ethanol extract from radix of Actinidia chinensis (EERAC) on tumor growth and cell apoptosis in HT-29 human colon cancer xenografts in nude mice.
METHODS: Forty BALB/C-nu/nu nude mice were used to prepare xenograft models of HT-29 human colon cancer, and model mice were randomly divided into five groups (n = 8), including three treatment groups (treated with 5, 10 and 20 mg/kg of EERAC, respectively), normal control group (treated with normal saline) and positive control group (treated with 5-FU, 25 mg/kg). After 8 d of treatment, spleen index and tumor inhibition rate were determined; the degree of NK cell activity was measured by culturing spleen effect cells; and the expression of apoptosis-related proteins Bcl-2, Bax and Caspase-3 in tumor tissue was determined by immunohistochemistry.
RESULTS: Compared to the control group, EERAC treatment had obvious inhibition on the growth of HT-29 xenograft tumor. The inhibition rate for each dose group was 9.12%, 20.13% and 37.81%, and there is a positive correlation between tumor growth inhibition and drug dose. Compared to the saline group and 5-Fu group, EERAC treatment significantly increased the spleen index (all P < 0.05) and the activity of NK cells (all P < 0.05), decreased the expression of Bcl-2 and Bcl-2/Bax ratio, and up-regulated the expression of Bax and Caspase-3 in a dose-dependent manner.
CONCLUSION: EERAC inhibits tumor growth and induces cell apoptosis in HT-29 human colon cancer xenografts in nude mice possibly via mechanisms associated with the inhibition of Bcl-2 expression, lowering of Bcl-2/Bax ratio, and up-regulation of Bax and Caspase-3 expression.
- Citation: Chen YJ, Shi RJ. Effect of ethanol extract from radix of Actinidia chinensis on tumor growth and cell apoptosis in HT-29 human colon cancer xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1547-1552
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1547.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1547
藤梨根是植物猕猴桃科猕猴桃属中华猕猴桃(actinidia chinensis planch)的根, 又名阳桃根. 其味咸、酸、涩, 性凉, 无毒, 主要功效为清热解毒、祛风除湿、利尿止血, 是常用的治疗大肠癌的中草药之一. 其抗癌作用符合的中医有关大肠发病的"癌毒"[1]和"湿热致病"学说的相关治则. 临床上, 朱秀山等[2]用昭黄散(藤梨根为主药)治疗不能手术胃癌患者72例, 疗效与5-Fu相当, 能明显提高生存质量和延长生存时间, 不良反应明显小于西药对照组. 薛瑞等[3]将体外培养的人胃腺癌SGC-7901细胞接种于Balb/c裸鼠的皮下, 建立人胃癌移植瘤模型, 以藤梨根醇提物大、中、小剂量组、阴性对照组、康力欣胶囊对照组进行疗效对比观察, 提示藤梨根乙酸乙酯提取物具有抑瘤作用, 其机制可能与提高机体的免疫功能有关. 基于上述的研究基础, 本实验将观察藤梨根提取物(ethanol extract from radix of Actinidia chinensis, EERAC)对大肠癌细胞HT-29荷瘤裸鼠的肿瘤抑制作用和诱导凋亡的影响, 并探讨其可能的作用机制.
藤梨根提取物根据中国科学院化学研究所公布的藤梨根抗癌有效活性成分醇提取工艺(专利公开号: CN1977869A), 由中国药科大学生命科学院实验中心制备; 胎牛血清为上海尚宝产品; RPMI 1640培养基为Hyclone公司产品; 0.25%胰酶为天津吉诺生物公司产品; DAB显色试剂盒; Bcl-2、Bax、Caspase-3抗体(鼠抗人多抗, 稀释度1:80)、生物素IgG为南京凯基产品; MTT、BIOSHARP、Amresco0793; 5-氟尿嘧啶(5-Fu)注射液为北京舟鼎国公司产品; 倒置显微镜(LeicaDMIL, Germany); 24孔/96孔培养板及细胞培养瓶为美国Corning/costar公司产品; Elx800多功能酶标仪为美国Bioelisa reader公司产品; Balb/c-nu/nu裸鼠,♂, 7周龄, 40只, 体质量18-22 g, 购自上海克莱斯动物公司, 许可证号: SCXK(沪)2003-0003; 裸鼠在中国药科大学中心实验室, 无特定病原体SPF级动物房饲养, 温度21 ℃-25 ℃, 湿度45%-55%. 人大肠癌细胞株HT-29购自中国科学院上海细胞库.
1.2.1 藤梨根抗癌有效活性成分的制取: (1)称取藤梨根1 000 g, 溶于5 000 mL乙醇, 回流10 h, 提取3次, 合并提取液后蒸发, 干燥后进行硅胶柱色谱分离并利用二氯甲烷、甲醇和乙酸溶液进行梯度洗脱, 在400 ℃除去溶剂, 收集粉状物, 真空干燥24 h; (2)蒸馏水100 mL, 加入步骤(1)所制作的干燥品100 g, 原液稀释成50 mg/L、100 mg/L、200 mg/L药物浓度, 所得溶液用0.22 μm微孔滤膜无菌过滤, 分装, 置4 ℃冰箱备用.
1.2.2 藤梨根有效活性成分醇提取物的质量控制: (1)EERAC主要成分的鉴定: EERAC的主要活性化学成分为三萜皂苷类, 对所提取的EERAC采用醋酐浓硫酸反应和泡沫实验加以鉴定: 醋酐浓硫酸反应(Liebrmann Burchard反应)呈现红紫色并接着变成污色绿色. 可考虑样品中含三萜类、皂苷或甾类. 泡沫实验, 若显示两管中泡沫高度相等, 证实其主要成份为三萜皂苷.
1.2.3 HPLC(高效液相色谱)指纹图谱鉴定: 药藤梨根由南京中医药大学中药与生药重点实验室物进行测定, 标本存放于南京中医药大学标本馆. 在测定中, 运用HPLC-DAD对10批次的藤梨根样品进行了分析研究. 结果显示, HPLC-DAD获得的指纹图谱, 显示本实验使用的中药藤梨根各批次化学成分稳定均一, 具有可重复性.
1.2.4 HT-29荷瘤裸鼠造模: (1)分组: 随机将40只Balb/c♂裸鼠, 分为5组: 生理盐水组(空白对照组)、5-Fu组(阳性对照组)、EERAC高剂量组20 mg/kg、EERAC中剂量组10 mg/kg、EERAC低剂量组5 mg/kg, 每组8只; (2)造模: 在无菌操作环境下, 将HT-29传代后, 稳定培养24 h, 在指数生长期, 调整细胞浓度至1×107个/mL. 加入适量的生理盐水, 以200 μL/只的细胞悬液浓度, 注射器接种于裸鼠右腋皮下, 操作在1 h内完成; (3)给药: 分组后, 5-Fu组按25 mg/kg体质量, 腹腔注射; EERAC组, 按0.2 mL/10 g等容量不等浓度(分别为EERAC 20 mg/kg、10 mg/kg、5 mg/kg[4,5]), 灌胃给药, 每天1次, 连续8 d. 生理盐水组灌服相同体积的生理盐水.
1.2.5 EERAC对荷瘤裸鼠体质量的影响: 造模后、取材前测量实验裸鼠体质量, 记录差值.
1.2.6 EERAC对裸鼠种植瘤的生长抑制作用: 裸鼠颈椎脱臼处死, 750 mL/L乙醇浸泡3 min, 取出裸鼠置于无菌纸上, 取出瘤体和脾脏并称质量. 瘤质量(g). 抑瘤率 = (C-T)/C×100%, T为各处理组平均瘤质量, C为生理盐水组平均瘤质量.
1.2.7 EERAC对荷瘤裸鼠免疫功能的影响: 前期处理同实验2.4, 摘取裸鼠脾脏并测量, 脾指数 = 脾脏质量(mg)/裸鼠体质量(g).
1.2.8 MTT法测定NK细胞活性度: (1)HT-29细胞传代并用RPMI 1640培养液调配细胞终浓度为4×105个/mL; (2)脾细胞悬液的制备: 无菌取脾, 在完成脾脏测量后, 移入的培养皿中, 进行沉降, 高速离心, 裂解红细胞后, 用RPMI 1640培养液调整细胞浓度为2×107个/mL; (3)NK细胞(效应细胞)分离: 步骤(2)所得溶液取1 mL用RPMI 1640稀释至2×106/mL, 分别按5 mg/L的终浓度加入ConA, 于37 ℃、50 mL/L CO2孵箱中培养24 h, 利用贴壁效应去除成纤维细胞、单核巨噬细胞等基质细胞, 通过尼龙毛柱过滤去除B细胞, 余液加入rhIL-2, 令NK细胞贴壁生长, 收集NK细胞; (4)NK细胞活性检测: 取靶细胞和效应细胞各50 μL(效靶比50:1), 置37 ℃、50 mL/L CO2培养箱中培养4 h, 在酶标仪490 nm处测定各孔吸光度(A)值, 以各组A值代表NK细胞活力.
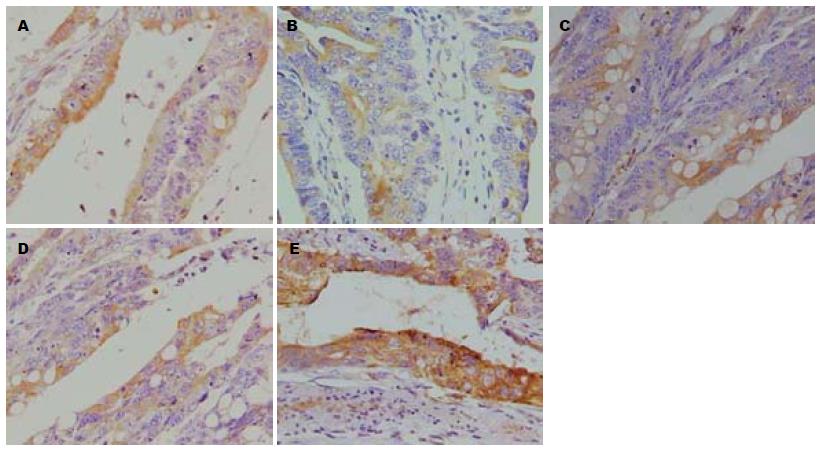
1.2.9 免疫组织化学法测定凋亡相关基因Bax、Bcl-2、Caspase-3的蛋白表达变化: (1)组织处理: 取厚度<0.2 cm的组织块, 10%的中性缓冲甲醛液固定10-12 h; (2)组织脱水、透明、浸蜡: 组织经固定后进行无水酒精脱水l h×3次、二甲苯透明化处理l h×2次, 65 ℃以下进行浸蜡及包埋; (3)切片: 切片厚度为5 μm, 切片在60 ℃温箱中60 min, 垂直烤片; (4)免疫组织化学染色: 切片常规脱蜡至水; 加入3%H2O2于室温下10 min灭活内源性酶; 0.01 mol/L枸橼酸盐缓冲液(pH 6.0)进行热修复抗原; 5%BSA封闭液; 滴加Caspase-3、Bcl-2、Bax抗体, 用PBS(pH 7.4)洗2 min×3次; 滴加IgG, PBS(pH 7.4)洗2 min×3次; 再滴加SABC, 37 ℃ 20 min. PBS(pH 7.4)洗5 min×4次; DAB显色: 室温显色, 时间为5-30 min; HE染色, 脱水, 透明, 封片. 显微镜观察, 摄片. 采用Image-Pro Plus 6.0图像分析系统, 计算积分吸光度(IA)值.
统计学处理 SPSS17.0分析, 数据以mean±SD表示, 计量资料用t检验, 计数资料用χ2检验分析, 多组间比较用方差分析, 百分数用U检验.
实验进行过程到第4天, 5-Fu组出现1只裸鼠死亡, 症状表现为极度瘦弱, 其原因可能与5-Fu所导致的不良反应有关. 与生理盐水组比较, 除EERAC低剂量组能明显增加荷瘤裸鼠的体质量(P<0.05)外, EERAC中、高剂量组对荷瘤裸鼠的体质量均无明显影响, 而5-Fu组裸鼠体质量明显下降(P<0.05, 表1).
与生理盐水组比较, EERAC中、高剂量组和5-Fu组能显著降低荷瘤裸鼠的瘤体质量(P<0.05 vs 中剂量组, P<0.01 vs 高剂量组和5-Fu组), 与5-Fu组比较, 而EERAC高剂量组无明显差异(P>0.05); 在肿瘤抑制率上, EERAC实验组随着剂量的增加, 抑瘤率不断上升, 而EERAC各剂量组均与5-Fu组有明显差异(高剂量组为P<0.05, 中、低剂量组为P<0.01, 表1).
脾脏指数高剂量组为6.14±0.42、中剂量组为6.67±0.59、低剂量组为3.98±0.45、5-Fu组为3.98±0.45、生理盐水组为4.91±0.38. 与生理盐水组比较, EERAC各剂量组均能非常显著增加荷瘤裸鼠的脾脏指数(P<0.01), 而5-Fu组则非常显著降低荷瘤裸鼠的脾脏指数(P<0.01).
NK细胞活性高剂量组为0.924±0.041、中剂量组为1.067±0.082、低剂量组为0.958±0.129、5-Fu组为0.642±0.061、生理盐水组为0.812±0.027. 与生理盐水组比较, EERAC各剂量组均能明显增加荷瘤裸鼠体内NK细胞的活性度(P<0.05或0.01), 而5-Fu组则显著降低荷瘤裸鼠的NK细胞的活性(P<0.05).
经过HE染色后, 吸光度测量的IA值显示, EERAC高剂量组为Bcl-2: 0.308±0.024, Bax: 0.341±0.006, Caspase-3: 0.331±0.008; EERAC中剂量组为Bcl-2: 0.319±0.011, Bax: 0.322±0.008, Caspase-3: 0.325±0.014; EERAC低剂量组为Bcl-2: 0.329±0.021, Bax: 0.314±0.037, Caspase-3: 0.308±0.048; 5-Fu组为Bcl-2: 0.255±0.097, Bax: 0.353±0.012, Caspase-3: 0.338±0.031; 生理盐水组为Bcl-2: 0.354±0.018, Bax: 0.309±0.023, Caspase-3: 0.309±0.023; 与生理盐水组比较, 5-Fu组、EERAC高剂量组的Bax、Caspase-3的表达水平均有明显升高(P<0.01, 其中EERAC中剂量组也能显著增强Caspase-3的表达, P<0.01), 从Bax表达图像可见, 随着EERAC剂量的增加, 蓝染颜色变深, 蓝染细胞的数量增多; 而5-Fu组、EERAC高剂量组均能明显降低Bcl-2的表达(P<0.05). EERAC对Bcl-2、Bax、Caspase-3蛋白表达的影响呈剂量相关性(图1).
肿瘤的发生是一个多因素、整体病变的过程, 其过程涉及机体多方面的改变[6], 其中免疫监控的失效或功能状态的低下是其重要的发病因素. 既往研究表明[7], 癌细胞移植造模后, 能引起裸鼠脾脏指数下降, NK细胞活性度低下, 免疫功能抑制的紊乱状态. 机体内的NK细胞是早期肿瘤免疫的重要效应细胞, 具有广谱的抗肿瘤性, 既能直接杀伤肿瘤细胞, 又可以通过细胞毒性作用间接抑制癌细胞增殖[8,9]. 本研究结果显示, 荷瘤裸鼠NK细胞的活性处于明显低下的状态, 脾指数降低, 表明其免疫功能紊乱, 而EERAC实验组荷瘤裸鼠的脾脏, NK细胞的活性度明显升高, 提示EERAC能在一定程度纠正荷瘤裸鼠免疫失衡状态, 提高免疫功能, 从而实现肿瘤生长的调控. 在实验过程中发现, EERAC对大肠癌细胞荷瘤裸鼠的瘤体生长具有明显抑制作用, 与剂量呈正相关作用, 虽然EERAC实验组的抗肿瘤作用要弱于5-Fu组, 但5-Fu组荷瘤裸鼠脾脏指数和NK细胞活性度显著下降, 对免疫系统有较强的不良反应, 而EERAC无免疫抑制作用, 还能一定程度地增加裸鼠的免疫力, 体现出其药物的安全性. 在EERAC低剂量时, 有明显增加荷瘤裸鼠体质量的作用(P<0.05), 该现象的原因初步估计为低剂量EERAC作用时, 与诱导肿瘤细胞的分化有关, 有待今后的实验进一步验证.
细胞凋亡是在凋亡刺激信号作用下, 激活细胞内部的程序变性和死亡机制, 并经过各种凋亡信号和转导途径协同完成, 而细胞表面死亡受体通路和线粒体通路是目前公认的两条重要的调节细胞凋亡的途径[10]. Bcl-2家族蛋白在细胞凋亡中具有重要作用, 其主要功能为调控线粒体凋亡途径. Bcl-2属于Bcl-2家族中抑制细胞凋亡的重要基因, 在大肠癌的发生发展中具有重要意义[11,12], Bax是Bcl-2家族中最重要的凋亡促进基因, 同时也对凋亡抑制基因Bcl-2起着主要调控作用[13,14], 其表达水平的变化, 能反映肿瘤的发生发展和预后及肿瘤细胞对治疗药物的敏感性[15]. 在线粒体凋亡途径中, Caspase蛋白家族处于细胞凋亡信号转导的中心位置, 而Caspase-3是信号转导通路中的核心效应分子, 他能导致细胞发生一系列凋亡形态和生化改变[16,17].
本研究发现, 经EERAC作用后, 裸鼠肿瘤组织中Bax蛋白表达水平较空白对照组增高, 而Bcl-2蛋白的表达降低, Bcl-2/Bax比值显著低于对照组(P<0.05), 其中以增强Bax的表达为主; 在Caspase-3的表达上也显著高于空白对照组(P<0.01), 提示EERAC的抗癌机制可能是通过抑制Bcl-2的表达, 下调Bcl-2/Bax的比值, 增强Bax、Caspase-3的表达, 从而激活线粒体凋亡途径来实现的. 从EERAC对HIT-29荷瘤裸鼠机体免疫功能的提高, 抑制肿瘤增殖和诱导肿瘤细胞凋亡方面, 说明中药藤梨根的抗肿癌作用具有多靶点、多中心的效应, 其应用和开发前景良好.
大肠癌是最常见的消化系肿瘤之一, 对人类健康的威胁性极大, 中药藤梨根是大肠癌术后常用的有效药物, 其抗癌的机制尚未完全明确; Bcl-2、Bax、Caspase-3调控肿瘤增殖与凋亡的重要调控基因, 可在一定程度上反应抗肿瘤药物的内在机制.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
肛肠科常用中药藤梨根, 经临床实践证明, 有着较好的抗肿瘤作用, 其疗效确切, 越来越受到人们关注藤梨根抗肿瘤的化学成分和药理作用虽己有初步的研究, 但其有效部位、作用机制缺乏系统的药理跟踪研究.
朱秀山等用昭黄散(藤梨根为主药)治疗不能手术胃癌患者72例, 疗效与5-Fu相当, 能明显提高生存质量和延长生存时间, 不良反应明显小于西药对照组, 证实昭黄散能明显抑制胃癌患者的病情进展.
本研究为中药藤梨根治疗大肠癌的临床应用和新剂型的开发, 提供客观的实验依据.
本研究选题新颖, 结论可靠, 具有一定的学术价值.
编辑: 李军亮 电编:鲁亚静
| 4. | 郑 树. 结直肠肿瘤-基础研究与临床实践. 北京: 人民卫生出版社 2006; 3-4. |
| 5. | Chung-Faye GA, Kerr DJ, Young LS, Searle PF. Gene therapy strategies for colon cancer. Mol Med Today. 2000;6:82-87. [PubMed] [DOI] |
| 7. | Jachimowicz RD, Fracasso G, Yazaki PJ, Power BE, Borchmann P, Engert A, Hansen HP, Reiners KS, Marie M, von Strandmann EP. Induction of in vitro and in vivo NK cell cytotoxicity using high-avidity immunoligands targeting prostate-specific membrane antigen in prostate carcinoma. Mol Cancer Ther. 2011;10:1036-1045. [PubMed] [DOI] |
| 8. | Mondal B, Saha S. Inhibition of subcutaneous growth of Ehrlich ascites carcinoma (EAC) tumor by post-immunization with EAC-cell gangliosides and its anti-idiotype antibody in relation to tumor angiogenesis, apoptosis, cell cycle and infiltration of CD4+, CD8+ lymphocytes, NK cells, suppressor cells and APC-cells in tumor. Indian J Exp Biol. 2011;49:574-584. [PubMed] |
| 9. | Dowell AC, Oldham KA, Bhatt RI, Lee SP, Searle PF. Long-term proliferation of functional human NK cells, with conversion of CD56(dim) NK cells to a CD56 (bright) phenotype, induced by carcinoma cells co-expressing 4-1BBL and IL-12. Cancer Immunol Immunother. 2012;61:615-628. [PubMed] [DOI] |
| 10. | Xu YZ, Zheng RL, Zhou Y, Peng F, Lin HJ, Bu Q, Mao YQ, Yu LT, Yang L, Yang SY. Small molecular anticancer agent SKLB703 induces apoptosis in human hepatocellular carcinoma cells via the mitochondrial apoptotic pathway invitro and inhibits tumor growth invivo. Cancer Lett. 2011;313:44-53. [PubMed] [DOI] |
| 11. | Zhang H, Li Y, Huang Q, Ren X, Hu H, Sheng H, Lai M. MiR-148a promotes apoptosis by targeting Bcl-2 in colorectal cancer. Cell Death Differ. 2011;18:1702-1710. [PubMed] [DOI] |
| 12. | Zhang MS, Hu AH, Qiu H, Xiong HH, Chen Y. The correlation between IGF-II and Bcl-2 expression in colorectal adenocarcinoma. Med Oncol. 2012;29:928-932. [PubMed] [DOI] |
| 13. | Anvari K, Seilanian Toussi M, Kalantari M, Naseri S, Karimi Shahri M, Ahmadnia H, Katebi M, Sedighi Pashaki A, Dayani M, Broumand M. Expression of Bcl-2 and Bax in advanced or metastatic prostate carcinoma. Urol J. 2012;9:381-388. [PubMed] |
| 14. | Zhong ZG, Wu DP, Huang JL, Liang H, Pan ZH, Zhang WY, Lu HM. Progallin A isolated from the acetic ether part of the leaves of Phyllanthus emblica L. induces apoptosis of human hepatocellular carcinoma BEL-7404 cells by up-regulation of Bax expression and down-regulation of Bcl-2 expression. J Ethnopharmacol. 2011;133:765-772. [PubMed] [DOI] |
| 15. | Wang W, Lu J, Zhu F, Wei J, Jia C, Zhang Y, Zhou L, Xie H, Zheng S. Pro-apoptotic and anti-proliferative effects of mitofusin-2 via Bax signaling in hepatocellular carcinoma cells. Med Oncol. 2012;29:70-76. [PubMed] [DOI] |
| 16. | Sabine VS, Faratian D, Kirkegaard-Clausen T, Bartlett JM. Validation of activated caspase-3 antibody staining as a marker of apoptosis in breast cancer. Histopathology. 2012;60:369-371. [PubMed] [DOI] |
| 17. | Li S, Tian D, Fei P, Gao Y, Chen Z, Wang Q, Tong Q. A cyclooxygase-2 inhibitor NS-398-enhanced apoptosis of esophageal carcinoma cell EC9706 by adjusting expression of survivin and caspase-3. Cancer Invest. 2011;29:102-106. [PubMed] [DOI] |