修回日期: 2012-05-07
接受日期: 2012-05-18
在线出版日期: 2012-06-18
目的: 建立Walker256大鼠肝癌模型, 探讨碘油、栓塞及化疗在肝动脉化疗栓塞术中的作用.
方法: 将皮下种植生长出的Walker256细胞瘤结节切成约1.5 mm3大小的瘤块, 植入35只♂SD大鼠肝包膜下, 植入后9 d用磁共振(magnetic resonance imaging, MRI)测量肿瘤体积V1, 经胃十二指肠动脉逆行插管至肝动脉注入不同药物, 分为实验组: A组(n = 7), 0.1 mg丝裂霉素(mitomycin, MMC)+0.1 mL碘油(lipiodol, LP)+肝动脉结扎(hepatic artery ligation, HAL); B组(n = 7), 0.1 mg MMC +0.1 mL LP; C组(n = 7), 0.1 mg MMC+HAL; D组(n = 7), 0.1 mL LP+HAL; 对照组: E组(n = 7), 0.1 mL 0.9%生理盐水. 介入术后9 d采用MRI测量肿瘤体积V2及肿瘤增长率(V2/V1).
结果: 介入治疗术前, A、B、C、D、E各组肿瘤平均体积V1分别为: 0.017 cm3±0.008 cm3、0.019 cm3±0.011 cm3、0.022 cm3±0.010 cm3、0.019 cm3±0.008 cm3、0.021 cm3±0.006 cm3, 术后肿瘤平均体积V2分别为: 0.038 cm3±0.017 cm3、0.152 cm3±0.069 cm3、0.302 cm3±0.134 cm3、0.382 cm3±0.049 cm3、0.715 cm3±0.307 cm3. 肿瘤平均增长率V2/V1分别为: 2.50±1.08、8.73±2.38、14.66±4.96、21.26±5.19、33.10±8.17. 治疗后A、B、C、D各实验组肿瘤平均增长率明显低于对照组E组(P<0.05); A、B、C、D各组间两两比较肿瘤平均增长率也具有显著性差异(P<0.05).
结论: 丝裂霉素与碘油及肝动脉结扎(LP+MMC+HAL)三者联合应用治疗肝癌取得了满意的疗效, 较其中任2种联合应用有明显优势, 有较好的临床应用前景.
引文著录: 周利华, 彭俊红, 钱坤, 钱骏. 联合丝裂霉素、碘油及肝动脉栓塞对大鼠肝癌的介入治疗. 世界华人消化杂志 2012; 20(17): 1542-1546
Revised: May 7, 2012
Accepted: May 18, 2012
Published online: June 18, 2012
AIM: To establish a rat model of Walker 256 liver cancer to evaluate the role of embolic agents, lipiodol (LP) and chemotherapeutic agents in transcatheter arterial chemoembolization.
METHODS: Subcapsular implantation of carcinoma tissue of Walker 256 in the liver was carried out in 35 male SD rats. Tumor volume (V1) was measured by magnetic resonance imaging (MRI) on day 9 after implantation. All rats were randomly divided into experiment groups and control group by the agents which were injectd via the gastroduodenal artery to hepatic artery. The experiment groups included group A (n = 7), mitomycin (MMC, 0.1 mg) + LP (0.1 mL) + hepatic artery ligation (HAL); group B (n = 7), MMC (0.1 mg) + LP (0.1 mL); group C (n = 7), MMC (0.1 mg) + HAL; group D (n = 7), LP (0.1 mL) + HAL. The control group (group E, n = 7) was given 0.9% NaCl (0.1 mL). Tumor volume (V2) was assessed by MRI (on day 9 after treatment) and the growth ratio of tumor (V2/V1) was calculated.
RESULTS: The mean tumor volume before and after treatment was 0.017 cm3 ± 0.008 cm3, 0.038 cm3 ± 0.017 cm3; 0.019 cm3 ± 0.011 cm3, 0.152 cm3 ± 0.069 cm3; 0.022 cm3 ± 0.010 cm3, 0.302 cm3 ± 0.134 cm3; 0.019 cm3 ± 0.008 cm3, 0.382 cm3 ± 0.049 cm3; and 0.021 cm3 ± 0.006 cm3, 0.715 cm3 ± 0.307 cm3 in groups A, B, C, D and E, respectively. The tumor growth ratio (V2/V1) was 2.50 ± 1.08, 8.73 ± 2.38, 14.66 ± 4.96, 21.26 ± 5.19, 33.10 ± 8.17 in groups A, B, C, D and group E, respectively. The tumor growth ratio was significantly lower in the experiment groups than in the control group (all P < 0.05). There were significant differences in the tumor growth ratio among groups A, B, C and D (all P < 0.05).
CONCLUSION: Combined use of mitomycin, lipiodol and hepatic artery ligation could achieve satisfactory results in the treatment of liver cancer.
- Citation: Zhou LH, Peng JH, Qian K, Qian J. Combined use of mitomycin, lipiodol and hepatic artery ligation for treating liver cancer in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1542-1546
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1542.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1542
目前, 外科手术包括部分肝切除及肝移植仍然被认为是治愈肝癌最彻底、最有效的治疗手段, 但符合治疗条件的患者不多, 西方国家大概只有30%, 亚洲不到10%[1,2]. 而非手术疗法多种多样, 如经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)、射频消融术(radio frequency ablation, RFA)、经皮无水酒精瘤内注射(percutaneous ethanol injection, PEI)、微波治疗(microwave coagulation therapy, MCT)、电化学治疗(electrochemotherapy, ECT)、激光诱导热疗(laser-induced thermotherapy, LITT)、冷冻治疗(cryotherapy)、放射治疗(radiotherapy, RT)等. 其中, TACE已成为治疗不可切除性肝癌的重要手段, 在部分选择性病例中能取得显著疗效, 并能延长患者的生存率.
TACE中化疗药一般与碘油混合形成碘油乳剂使用, 提高瘤内化疗药的浓度, 并减轻全身不良反应. 但近年来碘油作为栓塞剂这一说法存在争议, 有学者认为其不能栓塞动脉, 而且没有数据表明其可以缓慢地释放化疗药, 因此不应被应用. 另外, 比较肝动脉注入化疗药-碘油乳剂和TACE的疗效, 有研究表明两种治疗方法无显著性差异[3,4]; 也有报道[5]认为采用肝动脉注入化疗药-碘油乳剂治疗肝癌的生存率高于TACE组, 还有研究结果与之完全相反[6]. 对于化疗药而言, Pleguezuelo等[7]报道TACE的疗效并不一定优于肝动脉栓塞(transarterial embolization, TAE). 基于以上研究, 本实验主要建立与人类原发性肝癌血供特点和生长方式极其相近的Walker256大鼠肝癌模型, 探讨碘油、栓塞及化疗在TACE术中的作用.
200 g±20 g SD♂大鼠35只, 100 g±10 g SD♂幼鼠1只, 由华中科技大学同济医学院动物中心提供. 其中幼鼠皮下种瘤用, 35只成年大鼠供肿瘤肝脏移植所用. Walker256细胞悬液由上海索研生物科技有限公司.
1.2.1 Walker256大鼠肝癌模型的建立: 参考文献[8,9]制作肝癌模型: 将Walker256细胞悬液以1 000 r/min离心5 min, 弃上清, 取0.4×107个Walker256细胞注射于幼鼠背部皮下, 8 d后长出直径约1 cm大小的瘤结节. 将携带母瘤动物处死后取出瘤结节, 选择新鲜活组织部分切取约1.5 mm3大小的瘤块, 植入另外35只大鼠肝左叶包膜下.
1.2.2 介入治疗前磁共振检查: 于瘤块接种9 d后行磁共振扫描. 采用MR仪(Siemens, 3.0T), 选择腕部小线圈, 测量肿瘤体积. 序列参数如下: SE序列, T1WI: TR200 ms, TE3.98 ms; FSE序列, T2WI: TR3373 ms, TE86 ms; 矩阵256×256, 层厚2.0 mm, 无间断横断面扫描. 根据肿瘤体积公式V(cm3)=ab2/2计算肿瘤介入术前体积V1(其中a: 肿瘤最大径, b: 与之呈垂直方向的最小径)[10].
1.2.3 介入治疗: 在完成MRI检查后将35只大鼠随机分为实验组和对照组, 行肝动脉插管介入治疗, 具体治疗方案如下: 实验组: A组(n = 7): 经肝动脉灌注丝裂霉素(mitomycin, MMC)(0.1 mg)+碘油(lipiodol, LP)(0.1 mL)+肝动脉结扎(hepatic artery ligation, HAL)(HAL替代栓塞术, 即TACE); B组(n = 7): 经肝动脉灌注MMC(0.1 mg) + LP(0.1 mL); C组(n = 7): 经肝动脉灌注MMC(0.1 mg)+ HAL; D组(n = 7): 经肝动脉灌注LP(0.1 mL)+ HAL. 对照组: E组(n = 7): 经肝动脉灌注0.9%生理盐水(0.1 mL). 根据各组治疗方案缓慢注药. 其中, A、C及D组另外均行肝动脉结扎.
1.2.4 MRI复查: 介入治疗术9 d后对各组大鼠再次行MRI检查, 测得肿瘤体积V2. 根据介入术前术后体积V1、V2计算肿瘤增长率(V2/V1×100%).
统计学处理 采用SPSS16.0进行统计分析, 数据以mean±SD表示, 计量资料采用单因素方差分析, 两两间比较采用LSD检验; 以P<0.05为差异有统计学意义.
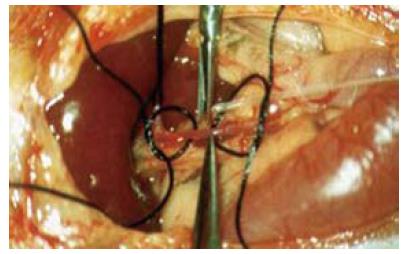
插管方法参照文献[8,9], 行胃十二指肠动脉逆行插管(聚乙烯微导管, PortexPE10, 内径0.28 mm, 外径0.61 mm, 德国海德堡Wenzel公司)至肝固有动脉(图1). 所有大鼠均成功制作成肝癌模型, 肝癌移植率100%, 3只大鼠在第2次MRI扫描前抵抗力低下感染死亡. 介入治疗前肝癌移植大鼠行常规MRI扫描, T1WI呈均匀低信号, T2WI呈中-高信号, 边界较为清楚, 周围未见明显子灶, 无腹水形成. 行不同介入治疗方案治疗后, 各组肿瘤体积均有不同程度增大, MR信号欠均匀, 病灶主体在T1WI上呈低信号, 在T2WI呈中-高信号.
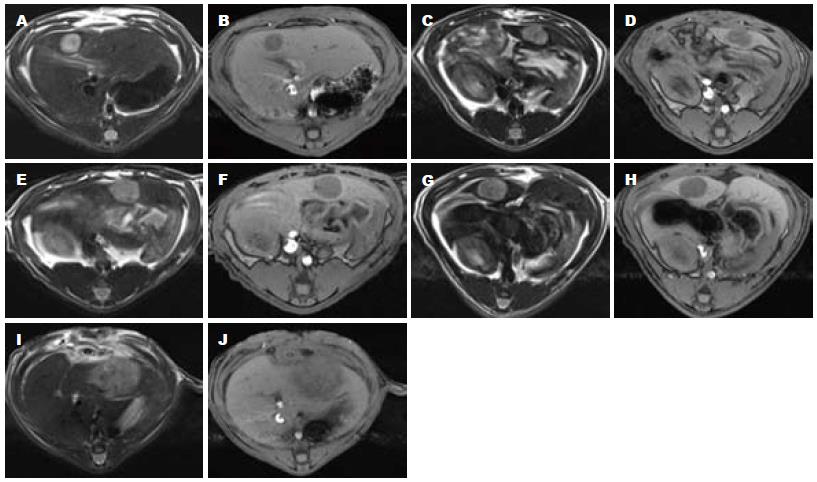
MRI评价各组动物模型肝癌治疗效果如下: MMC+LP+HAL治疗组的T1WI、T2WI图像, 约为术前的2.5倍; MMC+LP治疗组的T1WI、T2WI图像, 约为术前的8.7倍; MMC+HAL治疗组的T1WI、T2WI图像, 约为术前的14.7倍; LP+HAL治疗组, 约为术前的21.3倍; 阴性对照组T1WI、T2WI图像, 约为术前的33.1倍(图2).
经统计学分析, A、B、C、D和E各组在介入治疗前肿瘤体积无显著性差异(P>0.05), 而在介入治疗9 d后LP+MMC+HAL组、LP+MMC组、MMC+HAL组、LP+HAL组与对照组相比, 肿瘤体积及增长率具有显著性差异(P<0.05); LP+MMC+HAL组、LP+MMC组、MMC+HAL组、LP+HAL组两两间进行方差分析比较, 肿瘤增长率具有显著性差异(P<0.05). 治疗前后, A、B、C、D和E组肿瘤平均体积及增长率见表1.
| 分组 | n | V1(cm3) | V2(cm3) | 增长率 |
| A组(MMC +LP+HAL) | 6 | 0.017±0.008 | 0.038±0.017 | 2.50±1.08 |
| B组(MMC+LP) | 6 | 0.019±0.011 | 0.152±0.069 | 8.73±2.38 |
| C组(MMC+HAL) | 7 | 0.022±0.010 | 0.302±0.134 | 14.66±4.96 |
| D组(LP+HAL) | 6 | 0.019±0.008 | 0.382±0.049 | 21.26±5.19 |
| E组(生理盐水) | 7 | 0.021±0.006 | 0.715±0.307 | 33.10±8.17 |
我国是肝癌高发国, 肝癌严重威胁着我国人民的健康, 由于其发病隐匿, 进展迅速, 60%-70%的病例临床发现时已进展到中晚期, 失去了手术切除的机会. 这部分患者一般采用非手术方法进行治疗, 可获得较好的疗效. 其中, TACE已成为治疗不可切除性肝癌的重要手段[11]. TACE治疗肝癌主要依赖于肝脏的双重血供, 正常肝组织的血供75%来源于门静脉, 25%来自肝动脉. 原发性肝癌大部分属于富血供肿瘤, 其血供正好相反, 90%以上来自于肝动脉, 瘤周由门静脉和肝动脉双重供血. TACE通过栓塞剂在不影响正常肝组织血液灌注的情况下阻断肝癌的血供, 引发肝癌组织缺血、缺氧, 促使癌细胞坏死.
本实验用HAL替代栓塞术[12,13], MMC+LP+HAL疗效优于MMC+LP, 通过肝动脉结扎阻断肝动脉血流, 造成肿瘤组织局部缺血缺氧坏死, 并且减少血流对碘油乳剂的冲洗, 使化疗药物高浓度积聚于肿瘤组织, 高效杀伤肿瘤细胞. 该结果与Hatanaka等[6]的报道相符: 应用碘油-化疗药混合乳剂加明胶海绵的患者1、3、5年生存率分别为86.3%、34.8%、26.1%, 而应用单纯碘油-化疗药混合乳剂的分别为65.9%、36.2%、18.1%. Takayasu等[14]也认为TACE组疗效优于没有栓塞剂的碘油-化疗药组, TACE组1、3、5年生存率分别为81%、46%、25%; 无栓塞剂治疗组的分别为71%、33%、16%. 但也有研究表明两种治疗方法无显著性差异[3,4], 还有报道[5]认为采用肝动脉注入化疗药-碘油乳剂治疗肝癌的生存率高于TACE组. 分析其原因可能与使用的栓塞剂类型有关, 研究中没有统一永久性栓塞剂和短暂性栓塞剂, 不能达到相同的效果.
TACE中的化疗药一般与碘油混合, 以乳剂的形式应用于进展性肝癌的治疗. 由于肝癌富血供以及肝癌组织缺乏正常肝组织的Kupffer细胞系统的特点, 碘油可以破坏毛细血管床, 通过导向"虹吸"的作用, 携带化疗药物沉积于肿瘤组织中, 延长化疗药与肿瘤组织的作用时间, 诱导肿瘤细胞广泛坏死, 同时减轻全身不良反应. 碘油可在肿瘤组织中沉积数星期甚至数月, 靶向提高局部化疗药物的浓度. Nakamura等[15]比较肝动脉注射阿霉素与阿霉素-碘油乳剂2种治疗方法, 发现后者阿霉素可以从碘油乳剂中缓慢释放, 集中于肿瘤组织中, 而血液中阿霉素浓度很低. 这充分表明了碘油的携带作用. 本实验中MMC+LP+HAL组疗效优于MMC+HAL组体现了碘油的用处. 但单独使用碘油的意义不大, 所以MMC+HAL组疗效优于LP+HAL组, 正如Takayasu等[16]报道, 单纯的碘油是没有实在的治疗作用的.
碘油除了携带剂的作用外, 还具有栓塞功能, 他可以栓塞肿瘤周边供血门静脉分支[17]. 有研究表明[18], 与无碘油的化疗栓塞相比, TACE中的碘油沉积于肿瘤周边的门静脉分支, 有加强抗肿瘤的作用, 被认为是抗肿瘤的增强因子. 而且碘油大量沉积于门静脉可以使局部肿瘤的复发率大大降低[19].
TACE和TAE在肝脏恶性肿瘤中经常应用, TACE是TAE与化疗药物联合使用的综合治疗方法. Takayasu等[16]阐明经肝动脉注射阿霉素-碘油乳剂, 随后栓塞疗效优于单纯栓塞. 本实验中肝动脉结扎替代栓塞术, MMC+LP+HAL疗效优于LP+HAL, 与报道相符. Llovet等[20]也通过临床病例证实TACE的疗效优于TAE, 统计TACE患者1、2年生存率分别为82%、63%, TAE的分别为75%、50%. 但也有研究表明, TACE疗效并不一定优于TAE[9]. 追其原因可能与肝癌对化疗药的敏感性、单一用药和联合用药以及TACE的技术问题以致化疗药未产生作用等有关.
临床上由于肿瘤、病例的多样性因素, 通过收集临床病例评价TACE有一定难度. 本研究主要建立与人类原发性肝癌血供特点和生长方式极其相近的Walker256大鼠肝癌模型, 采用肝动脉结扎和肝动脉插管的方法, 评价TACE中的3要素(碘油、栓塞及化疗)在TACE术中相辅相成的作用. 但是仍存在一些问题: Walker256大鼠肝癌模型没有经过自然条件下肝炎、肝硬化的过程, 不能完全等同于人类原发性肝癌, 选取更好的肝癌模型还有待进一步研究. 目前国际上对栓塞剂的种类、标准大小、剂量尚没有统一标准方案, 以致同种治疗方案的治疗效果可能存在差异. 碘油与化疗药结合形成油包水型制剂、水包油型制剂、三明治式法注入肝动脉, 哪种更能缓慢释放化疗药; 化疗药如何选择疗效更好; 化疗药-碘油与栓塞剂何时注入肝动脉可以充分发挥各自的作用等还有待进一步研究.
60%-70%的肝癌患者临床发现时已进展到中晚期, 失去了手术切除的机会. 这部分患者一般采用非手术方法进行治疗, 可获得较好的疗效. 其中, 经导管肝动脉化疗栓塞术(TACE)已成为治疗不可切除性肝癌的重要手段.
钱林学, 主任医师, 首都医科大学附属北京友谊医院
以TACE为基础的综合治疗方法越来越多地用于临床, 充分了解TACE中各要素的作用, 有助于制定有效的治疗方案, 提高疗效, 延长患者的生存率.
临床上由于肿瘤、病例的多样性因素, 通过收集临床病例评价TACE有一定难度. 本研究主要建立与人类原发性肝癌血供特点和生长方式极其相近的Walker256大鼠肝癌模型, 采用肝动脉结扎和肝动脉插管的方法, 评价TACE中的三要素: 碘油、栓塞及化疗在TACE术中相辅相成的作用.
本文实验设计思路很好, 有很好的创新性, 并有较好的临床研究和应用价值.
编辑: 张姗姗 电编:闫晋利
| 1. | A1 Samuel M, Chow PK, Chan Shih-Yen E, Machin D, Soo KC. Neoadjuvant and adjuvant therapy for surgical resection of hepatocellular carcinoma. Cochrane Database Syst Rev. 2009;CD001199. [PubMed] |
| 2. | Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology. 2003;37:429-442. [PubMed] [DOI] |
| 3. | Maeda S, Fujiyama S, Tanaka M, Ashihara H, Hirata R, Tomita K. Survival and local recurrence rates of hepatocellular carcinoma patients treated by transarterial chemolipiodolization with and without embolization. Hepatol Res. 2002;23:202-210. [PubMed] [DOI] |
| 4. | Ikeda M, Maeda S, Shibata J, Muta R, Ashihara H, Tanaka M, Fujiyama S, Tomita K. Transcatheter arterial chemotherapy with and without embolization in patients with hepatocellular carcinoma. Oncology. 2004;66:24-31. [PubMed] [DOI] |
| 5. | Lu CD, Qi YG, Peng SY. Lipiodolization with or without gelatin sponge in hepatic arterial chemoembolization for hepatocellular carcinoma. Chin Med J (Engl). 1994;107:209-215. [PubMed] |
| 6. | Hatanaka Y, Yamashita Y, Takahashi M, Koga Y, Saito R, Nakashima K, Urata J, Miyao M. Unresectable hepatocellular carcinoma: analysis of prognostic factors in transcatheter management. Radiology. 1995;195:747-752. [PubMed] |
| 7. | Pleguezuelo M, Marelli L, Misseri M, Germani G, Calvaruso V, Xiruochakis E, Pinelopi M, Burroughs AK. TACE versus TAE as therapy for hepatocellular carcinoma. Expert Rev Anticancer Ther. 2008;8:1623-1641. [PubMed] [DOI] |
| 8. | Yang R, Rescorla FJ, Reilly CR, Faught PR, Sanghvi NT, Lumeng L, Franklin TD, Grosfeld JL. A reproducible rat liver cancer model for experimental therapy: introducing a technique of intrahepatic tumor implantation. J Surg Res. 1992;52:193-198. [PubMed] [DOI] |
| 9. | 钱 骏, Truebenbach J, Eul T, Graepler F, Pereira P, Huppert P, 冯 敢生, Claussen C. ACI大鼠肝细胞癌模型在介入治疗实验中的初步应用. 中华放射学杂志. 2003;37:16-19. |
| 10. | Carlsson G, Gullberg B, Hafström L. Estimation of liver tumor volume using different formulas - an experimental study in rats. J Cancer Res Clin Oncol. 1983;105:20-23. [PubMed] [DOI] |
| 11. | 郑 石磊, 张 祥林, 董 福仁, 雷 振, 王 刚, 李 国策, 徐 娜. 强力霉素与碘油栓塞对兔VX2肝肿瘤移植瘤VEGF、MMP-2表达的影响. 世界华人消化杂志. 2010;18:3338-3342. |
| 12. | Ekelund L, Stigsson L, Jonsson N, Sjögren HO. Transcatheter arterial embolization of normal livers and experimental hepatic tumours in the rat. Acta Radiol Diagn (Stockh). 1977;18:641-651. [PubMed] |
| 13. | Tanaka N, Okamoto E, Toyosaka A, Nakao N. [Pathohistological evaluation of hepatic artery ligation (HAL) or transcatheter arterial embolization (TAE) on primary carcinoma of the liver]. Nihon Geka Gakkai Zasshi. 1983;84:518-528. [PubMed] |
| 14. | Takayasu K, Arii S, Ikai I, Kudo M, Matsuyama Y, Kojiro M, Makuuchi M. Overall survival after transarterial lipiodol infusion chemotherapy with or without embolization for unresectable hepatocellular carcinoma: propensity score analysis. AJR Am J Roentgenol. 2010;194:830-837. [PubMed] [DOI] |
| 15. | Nakamura H, Hashimoto T, Oi H, Sawada S. Transcatheter oily chemoembolization of hepatocellular carcinoma. Radiology. 1989;170:783-786. [PubMed] |
| 16. | Takayasu K, Shima Y, Muramatsu Y, Moriyama N, Yamada T, Makuuchi M, Hasegawa H, Hirohashi S. Hepatocellular carcinoma: treatment with intraarterial iodized oil with and without chemotherapeutic agents. Radiology. 1987;163:345-351. [PubMed] |
| 17. | Kan Z, Sato M, Ivancev K, Uchida B, Hedgpeth P, Lunderquist A, Rosch J, Yamada R. Distribution and effect of iodized poppyseed oil in the liver after hepatic artery embolization: experimental study in several animal species. Radiology. 1993;186:861-866. [PubMed] |
| 18. | Sasaki Y, Imaoka S, Kasugai H, Fujita M, Kawamoto S, Ishiguro S, Kojima J, Ishikawa O, Ohigashi H, Furukawa H. A new approach to chemoembolization therapy for hepatoma using ethiodized oil, cisplatin, and gelatin sponge. Cancer. 1987;60:1194-1203. [PubMed] [DOI] |
| 19. | Miyayama S, Matsui O, Yamashiro M, Ryu Y, Kaito K, Ozaki K, Takeda T, Yoneda N, Notsumata K, Toya D. Ultraselective transcatheter arterial chemoembolization with a 2-f tip microcatheter for small hepatocellular carcinomas: relationship between local tumor recurrence and visualization of the portal vein with iodized oil. J Vasc Interv Radiol. 2007;18:365-376. [PubMed] [DOI] |
| 20. | Llovet JM, Real MI, Montaña X, Planas R, Coll S, Aponte J, Ayuso C, Sala M, Muchart J, Solà R. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet. 2002;359:1734-1739. [PubMed] [DOI] |