修回日期: 2012-05-09
接受日期: 2012-05-18
在线出版日期: 2012-06-18
目的: 观察厄洛替尼联合放疗对人胃癌MKN45细胞周期和凋亡的影响, 了解厄洛替尼对放疗增敏的作用机制.
方法: 通过MTT法和集落形成实验, 检测厄洛替尼和放射线对MKN45细胞的生长抑制作用, 计算出半数抑制浓度(50% inhibitory concentration, IC50)和放射生物学参数平均致死剂量(mean lethal dose, D0)、准阈剂量(quasi-threshold, Dq)值, 得出放射增敏比; 流式细胞仪检测MKN45细胞经厄洛替尼及联合放射线处理后细胞的凋亡率及周期分布情况; Western blot法检测厄洛替尼及联合放射线对MKN45细胞的Bax与Bcl-2蛋白表达的影响.
结果: 厄洛替尼及放射线均能抑制MKN45细胞的生长, 随用药浓度或剂量的增高, 抑制作用增强(P<0.01). 厄洛替尼与放射线联合对MKN45细胞的抑制作用大于单药和单纯照射(P<0.01); 两者联合使S期细胞比率明显降低, 放射敏感的G2/M期和G0/G1期细胞比率明显增加(71.87±0.77 vs 60.72±0.26, P<0.01), 细胞凋亡率增加; 厄洛替尼联合放射线作用于细胞后, Bcl-2蛋白表达明显减少, Bax蛋白表达则明显增加.
结论: 厄洛替尼通过增加G2/M和G0/G1期细胞比率, 降低Bcl-2、升高Bax蛋白表达, 从而降低Bcl-2/Bax比率, 增加细胞凋亡, 以此提高MKN45细胞的放射敏感性.
引文著录: 张圣林, 刘春丽, 王淑萍, 郝玉静, 王雅棣, 李青山. 厄洛替尼联合放疗对MKN45细胞株的影响. 世界华人消化杂志 2012; 20(17): 1502-1508
Revised: May 9, 2012
Accepted: May 18, 2012
Published online: June 18, 2012
AIM: To observe the effect of erlotinib combined with radiotherapy on cell cycle progression and apoptosis of human gastric carcinoma MKN45 cells to explore the mechanism by which erlotinib increases the sensitivity of MKN45 cells to radiotherapy.
METHODS: The effect of erlotinib and radiotherapy on MKN45 cells was examined by MTT assay and colony formation assay. The median inhibitory concentration (IC50) and radiobiological parameters D0 and Dq were calculated. Cell apoptosis and cell cycle progression were examined by flow cytometry. The expression of Bcl-2 and Bax proteins was detected by Western blot.
RESULTS: Both erlotinib and radiotherapy could inhibit MKN45 cell growth in a concentration- and dose-dependent manner (both P < 0.01). The inhibitory effect of erlotinib combined with radiotherapy on MKN45 cell growth was better than that of erlotinib or radiation alone. Combination treatment significantly decreased the percentages of cells in S phase cells and increased those in G2/M and G0/G1 phases (71.87 ± 0.77 vs 60.72 ± 0.26, P < 0.01) and cell apoptosis. After treatment with erlotinib combined with radiotherapy, Bcl-2 protein expression decreased and Bax protein expression increased.
CONCLUSION: Erlotinib increases radiosensitivity of MKN45 cells by increasing the percentages of cells in G2/M and G0/G1 phases and decreasing Bcl-2/Bax ratio to induce apoptosis.
- Citation: Zhang SL, Liu CL, Wang SP, Hao YJ, Wang YD, Li QS. Erlotinib increases sensitivity of MKN45 cells to radiotherapy. Shijie Huaren Xiaohua Zazhi 2012; 20(17): 1502-1508
- URL: https://www.wjgnet.com/1009-3079/full/v20/i17/1502.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i17.1502
胃癌早期症状隐匿, 超过70%的胃癌患者确诊时已是中晚期, 胃癌5年总存活率仅为20%左右[1]. 术后同期放化疗可将3年总生存率和无病生存率由单纯手术的41%、31%提高到50%、48%[2]. 因此, 2007的NCCN指南将胃癌R0切除术后(T3/4、N0, 任何T、N+)行5FU同步放化疗列入标准治疗[3]. 厄洛替尼是表皮生长因子酪氨酸激酶抑制剂[4], 对非小细胞肺癌[5]、晚期胰腺癌[6]均有明显的抑制作用. 文献显示表皮生长因子受体(epidermal growth factor receptor, EGFR)在胃癌组织中的阳性率接近50%[7-9], 提示厄洛替尼有可能成为胃癌的一个靶向药物, 但厄洛替尼在胃癌中的研究及应用尚未见报道. 最近Kishida等[10]报道吉非替尼对胃癌细胞有放射增敏作用, 启发我们观察厄洛替尼对胃癌及对放射线的影响.
DMEM培养基为GIBCO公司产品, 胰蛋白酶(trypsin)、二甲基亚砜(DMSO)、碘化丙啶(PI)为Sigma公司产品, MTT为华美生物技术有限公司产品, Annexin V-EGFP为南京凯基生物科技发展有限公司产品; 颗粒酶一抗、穿孔素一抗、β-actin一抗及Western blot二抗为Santa Cruz公司产品; 厄洛替尼由罗氏公司(Roche, Penzberg, Germany)生产.
1.2.1 细胞培养: 人胃癌MKN45细胞株由南京凯基生物科技发展有限公司传代保存, 为单层贴壁生长. 用含100 mL/L胎牛血清, 100 U/mL青霉素, 100 mg/L链霉素的DMEM培养基, 在37 ℃、50 mL/L CO2培养箱内进行传代培养.
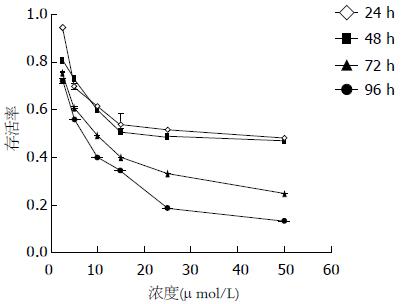
1.2.2 MTT法检测厄洛替尼和放射线对MKN45细胞的作用: (1)MTT法检测厄洛替尼对MKN45细胞的增殖抑制作用: 取对数生长期的MKN45细胞, 消化、计数后以3×103/孔密度均匀接种于96孔板, 24 h细胞贴壁后加入浓度为2.5、5.0、10.0、15.0、25.0、50.0 µmol/L厄洛替尼培养液, 每种浓度6个复孔, 并设不加药的细胞对照. 分别培养24、48、72、96 h, 吸弃原含药培养液, 加入无血清培养液100 mL, 每孔加MTT(5 g/L)20 µL, 继续培养4 h, 吸去原培养液, 加入DMSO 150 µL/孔溶解沉淀, 用酶标仪(波长570 nm)测定每个孔的吸光度(A)值. 抑制率(%) = [(Ac-A0)-(At-A0)]/(Ac-A0)×100%(Ac和At分别是细胞对照和实验组的A值, A0是背景对照的A值), 计算出不同时间各浓度细胞的存活分数(SF, SF = At/Ac×100%), 并根据改良Herbst法计算IC50, 以0.2×IC50作为后续的实验浓度. 实验重复3次; (2)MTT法检测放射线对MKN45细胞的增殖抑制作用: 取对数生长期MKN45细胞, 以3×103/孔密度接种于96孔板, 培养24 h后给予0、2、4、6、8 Gy剂量的照射. 每个剂量设6个复孔. 继续培养72 h, 用上面同样的方法在酶标仪(波长570 nm)测定每个孔的A值, 计算细胞抑制率. 实验重复3次; (3)MTT法检测厄洛替尼联合放射线对MKN45细胞的增殖抑制作用: MKN45细胞按4×103/孔密度接种于96孔板, 培养24 h后, 给予6 Gy照射, 随后加入含厄洛替尼浓度为2.5、5.0、10.0、15.0、25.0、50.0 µmol/L的培养液, 100 µL/孔, 每种浓度6个复孔. 再继续培养72 h, 以同样的方法计算细胞抑制率. 实验重复3次; (4)单细胞集落形成实验检测厄洛替尼及放射线对MKN45细胞的增殖抑制作用: 取对数生长期MKN45细胞, 消化、计数并逐级稀释后, 将细胞接种于6 cm平皿中. 分为对照组、照射组、厄洛替尼组和厄洛替尼+照射组, 每组3个平皿. 照射组、厄洛替尼+照射组接受0、2、4、6、8 Gy的照射后, 更换含或不含2 µmol/L厄洛替尼的新鲜培养液培养2 wk. 显微镜下计数细胞数>50个的克隆数. 单细胞集落形成率(PE) = (克隆数/接种的细胞数)×100%. 细胞存活率(SF) = [各实验组克隆数/(各实验接种的细胞数×PE)]×100%. 应用多靶单击模型S = 1-(1-e-D/D0)N, 采用GraphPad Prism4.0拟合存活曲线, 分别计算平均致死剂量(mean lethal dose, D0)、准阈剂量(quasi-threshold, Dq)值, 放射增敏比为单纯照射组与厄洛替尼+照射组D0值之比. 实验重复3次.
1.2.3 厄洛替尼及放射线对细胞形态的影响: 在倒置显微镜下观察培养瓶中细胞的生长状况及形态学改变.
1.2.4 厄洛替尼及放射线对细胞周期的影响: 取对数生长期MKN45细胞, 用6 Gy照射, 分组同上. 每组3瓶, 用含2 µmol/L洛替尼的新鲜培养液分别培养24、48 h, 胰酶消化后, PBS洗2遍、离心, 用预冷的75%酒精于-20 ℃固定24 h, 测定前取固定保存的细胞, PBS洗2遍, 再离心收集细胞, 加入500 µL PI混匀染色, 置于4 ℃避光保存0.5 h. 流式细胞仪测DNA-PI的荧光强度, 结果用Muticycle软件系统进行分析以检测细胞周期分布. 实验重复3次.
1.2.5 厄洛替尼及放射线对细胞凋亡的影响: 取对数生长期的以上4组细胞, 每组3瓶, 照射后用含2 µmol/L厄洛替尼的新鲜培养液分别培养24、48 h, 胰酶消化, PBS洗2遍、离心、收集细胞, 调整细胞浓度为(5×105)/mL; 加入500 µL的Binding Buffer悬浮细胞和5 µL Annexin V-EGFP混匀后, 再加入5 µL PI混匀; 置于4 ℃室温避光反应15 min; 在1 h内上流式细胞仪检测, 结果用Muticycle软件系统进行分析. 实验重复3次.
1.2.6 Western blot法检测厄洛替尼及放射线对Bax和Bcl-2的蛋白表达的影响: 细胞培养及分组同上. 处理后用含2 µmol/L厄洛替尼的新鲜培养液培养48 h. 分别收集细胞约5×106个, 加入裂解液提取蛋白, BCA法测定蛋白浓度. 取已变性并混有溴酚蓝的蛋白样品, 进行稳压电泳(浓缩胶, 80 V; 分离胶, 120 V)2 h. 电泳后将蛋白以2 mA/cm2恒流转膜, β-actin 4 ℃转膜2 h, MMP-1 4 ℃转膜3 h, MMP-2 4 ℃转膜4 h. 取等体积的蛋白样品与电泳上样液混合后高温水浴处理10 min, 用10% SDS-PAGE分离蛋白, 采用湿转法转移蛋白至膜上, 室温封闭2 h, TBST漂洗3次, 加入一抗(MMP-1及MMP-2, 1:200稀释; 鼠抗人β-actin抗体1:1 000稀释)4 ℃反应过夜, TBST漂洗3次, 加入HRP标记的羊抗鼠IgG(1:5 000稀释), 室温摇床反应2 h, ECL显色、X线胶片曝光, 以β-actin蛋白作内参照, 以BAND-SCAN图像分析软件进行光密度积分值分析. 实验重复3次.
统计学处理 所有数据资料以mean±SD表示. 采用SPSS11.5统计学软件进行统计处理, 均数比较采用单因素方差分析, LSD-t检验, 相关分析采用析因设计方差分析, 以P<0.05为有统计学差异.
2.1.1 MTT法检测厄洛替尼对MKN45细胞的作用: 厄洛替尼能明显抑制MKN45细胞的生长, 随用药时间的延长和用药浓度的提高, 抑制率明显增强(P<0.05, 图1).
2.1.2 MTT法检测放射线对MKN45细胞的作用: 给予MKN45细胞0、2、4、6、8 Gy照射后72 h, 显示随着照射剂量的增大, 抑制作用增强.
2.1.3 MTT法检测厄洛替尼和放射线对MKN45细胞的抑制作用: 浓度为2.5、5.0、10.0、15.0 µmol/L厄洛替尼与放射线联合对细胞增殖的抑制作用大于单药或单独照射的作用, 差异有统计学意义(P<0.01, 表1).
| 厄洛替尼(μmol/L) | 厄洛替尼 | 厄洛替尼+放射组 | ||
| A570 | 抑制率(%) | A570 | 抑制率(%) | |
| 2.5 | 3.157±0.008 | 6.7 | 2.298±0.054 | 31.4 |
| 5.0 | 3.012±0.015 | 8.9 | 1.782±0.113 | 51.2 |
| 10.0 | 1.801±0.072 | 49.0 | 0.934±0.043 | 73.6 |
| 15.0 | 1.139±0.053 | 69.3 | 0.261±0.005 | 91.5 |
| 25.0 | 0.151±0.015 | 94.8 | 0.139±0.036 | 94.7 |
| 50.0 | 0.142±0.012 | 95.8 | 0.141±0.023 | 96.5 |
| t值 | 38.653 | 33.786 21.978 | 37.660 | 0.672 -0.144 |
| P值 | 0.000 | 0.000 0.000 | 0.000 | 0.689 0.991 |
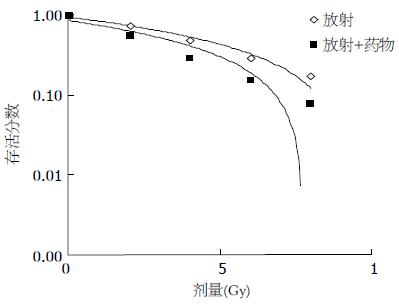
单细胞集落形成实验发现厄洛替尼+照射组与单纯照射组的集落形成率分别是1.97%±0.14%、5.1%±0.21%, 两者有显著差异(P<0.05), 显示厄洛替尼联合放疗能明显抑制MKN45细胞的克隆性增殖. 应用多靶单击模型求得, 经厄洛替尼处理后D0值减低, Dq值变小, 放射增敏比为1.54. 提示厄洛替尼对MKN45细胞有放射增敏作用(图2).
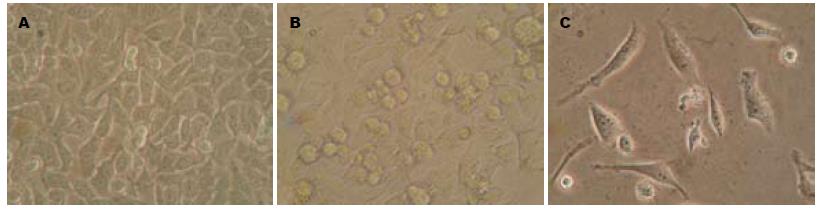
厄洛替尼及放射联合作用于MKN45细胞24 h后, 随着药物浓度的增大和时间的延长, 细胞表面可见突起小膜泡(凋亡小体)不断地脱落于培养液中; 48 h后细胞变小变圆, 皱缩变形的细胞进一步增多; 72 h后细胞数目显著减少, 部分细胞胞膜破裂, 胞浆浓缩呈泡状, 核仁消失. 对照组细胞生长活跃, 呈梭形、多角形、大小不一, 细胞形态完整, 细胞核大, 核仁明显(图3).
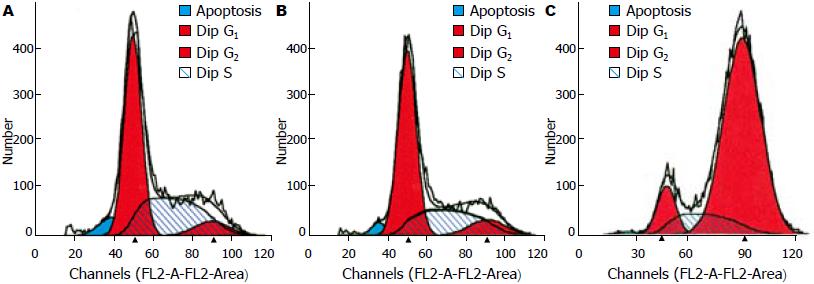
经厄洛替尼作用后, MKN45细胞周期中的G1/G0期比例明显增多, 随着时间的延长S期比例减少, 24、48 h各时间段之间的差异有统计学意义(P<0.01), 显示厄洛替尼可使MKN45细胞相对放射敏感期细胞增多. MKN45细胞经单纯照射后, G2/M期比例明显升高. 厄洛替尼+照射组的G2/M期比例较对照组也升高, 与照射组比较有统计学意义(P<0.01, 表2, 图4).
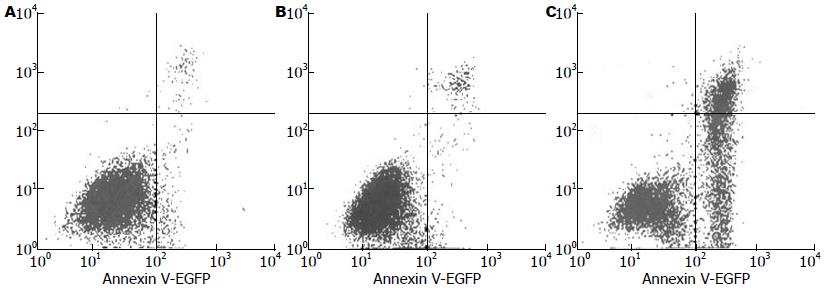
照射后48 h, 对照组、照射组和厄洛替尼组+照射组的凋亡率分别为4.34%±0.63%、11.10%±1.45%和23.2±0.41%, 经析因设计方差分析方法统计, 各组间有统计学意义(P<0.05, 表3, 图5).
| 对照组 | 厄洛替尼组 | 放射组 | 厄洛替尼+放射组 | F 值 | P 值 | |
| 24 h | 5.23±0.32 | 9.87±1.65 | 11.35±1.12 | 18.09±2.56 | 13.238 | 0.002 |
| 48 h | 4.34±0.63 | 11.10±1.45 | 12.14±0.87 | 23.20±0.41 | 123.728 | 0.000 |
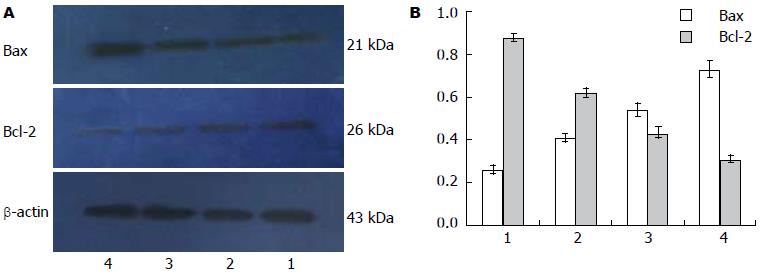
对照组的Bax蛋白表达较低, Bcl-2表达较高; 厄洛替尼及照射后, 出现Bcl-2蛋白表达量明显减少, 厄洛替尼+照射组减少最明显; Bax蛋白表达则以厄洛替尼+照射组增加最明显. 厄洛替尼可增强放射调解Bcl-2、Bax蛋白表达及Bcl-2/Bax比率的作用而在分子水平上抑制肿瘤生长(图6).
厄洛替尼是一种小分子的酪氨酸激酶抑制剂, 主要通过与三磷酸腺苷竞争结合至EGFR胞内酪氨酸激酶功能域, 抑制受体自磷酸化而阻止下游信号传导, 产生抗肿瘤作用[11], 对EGFR过表达的肿瘤细胞EGFR自身磷酸化有明显的抑制作用[12]. 研究发现厄洛替尼可以抑制许多癌细胞的生长, 如肺癌[13,14]、头颈部恶性肿瘤[15]、胰腺癌[16]. 但对于仅次于肺癌的世界第2大致死肿瘤-胃癌[17], 2007年NCCN提出5FU同步放化疗是胃癌R0切除术后的标准治疗[3], 治疗疗效较之前明显提高, 但患者依从性差. Kishida等[10]在研究吉非替尼抑制胃癌细胞中SN38的诱导作用机制时提出吉非替尼对胃癌细胞有放射增敏作用. Nakata等[18]研究发现选择性环氧合酶-2抑制剂增强肿瘤细胞对放射的敏感性. 本研究首次显示厄洛替尼对胃癌MKN45细胞有明显的生长抑制作用, 厄洛替尼与放射线联合随药物剂量或放射剂量的增大和作用时间的延长, 抑制增强, 厄洛替尼联合照射对MKN45细胞的抑制作用, 要强于二者单独时的作用. 厄洛替尼联合放疗能明显抑制MKN45细胞的克隆性增殖, 应用多靶单击模型求得, 放射增敏比为1.54, 提示厄洛替尼对MKN45细胞有放射增敏作用. 这也是我们首次报道厄洛替尼对MKN45细胞有放射增敏效应.
ToGA试验[19]结果显示: 22.1%的胃癌Her-2阳性, 加用赫赛汀的治疗组与仅接受化疗的对照组比较, 总生存延长了2.7 mo, 且Her-2高表达者获益更大, 总生存期长达16 mo. ToGA研究改变了胃癌的治疗模式, 使根据患者的基因特性寻找肿瘤特定的生物标志进行个体化治疗成为可能. 胃癌Her-2阳性仅占20%左右, 而文献报道EGFR在胃癌组织中存在的高表达, 约在40%-65%之间. 研究[20,21]证实EGFR的高表达与年龄、分化程度、分级相关, 多因素分析提示EGFR的高表达可能为一个独立的预后不良的标志. 一项Ⅱ期临床试验[22]第一次证明使用针对EGFR的靶向药物在EGFR表达并且低配体水平的胃癌患者中有较好的预后. 厄洛替尼是EGFR酪氨酸激酶抑制剂, 有研究[23]显示在人肝癌细胞系的体外作用中其与西妥昔单抗协同作用的分子机制是进一步下调了活化EGFR的信号转导通路关键酶的表达. 多项研究证明EGFR的靶向治疗可以对胃癌起到治疗作用. 细胞凋亡是电离辐射所致细胞死亡的主要形式, 为研究厄洛替尼对胃癌的放射增敏机制, 我们检测了细胞凋亡和周期. 本研究显示: 经厄洛替尼和放射线联合作用后MKN45细胞的凋亡率明显增加, 对放射线最敏感G2/M和G0/G1期细胞比率明显升高, 显示厄洛替尼通过增加细胞凋亡及增加敏感的G2/M和G0/G1期细胞比率来发挥放射增敏作用. 孙晓江等[24]综述探讨了分子靶向药物的放射增敏作用是使细胞周期阻滞在G2/M期这一放射敏感性最高的时期, 本研究结果验证了孙晓江的这一论断.
在胃癌细胞中Bcl-2家族阳性表达60%-80%[25]. 目前研究表明Bcl-2是凋亡基因调节蛋白, 可抑制细胞凋亡, 增加细胞生存和肿瘤的播散侵袭能力. Bax的功能是拮抗Bcl-2, 促进细胞凋亡. 抗凋亡的基因Bcl-2和促凋亡基因Bax之间的失衡可能是肿瘤发生的机制之一[26]. 有研究表明[27,28]胃癌的发生不仅存在Bcl-2蛋白的表达上调及Bax蛋白的表达下调, Bax与Bcl-2的异常表达通过对细胞凋亡的调控共同参与胃癌的发生发展过程, 并与胃癌的浸润深度及分化程度等密切相关. 研究发现, Bax蛋白在照射组及厄洛替尼+照射组表达明显减少; 而Bcl-2蛋白表达相反, 厄洛替尼+照射组增加最明显. 厄洛替尼可通过增强放射调解Bcl-2、Bax蛋白表达及Bcl-2/Bax比率的作用而在分子水平上抑制肿瘤生长.
总之, 厄洛替尼对胃癌的放射增敏机制与诱导细胞凋亡、干预细胞周期及调解Bcl-2、Bax蛋白表达有关, 为厄洛替尼应用于胃癌的临床治疗提供了实验依据.
胃癌是危害人类健康最常见的恶性肿瘤之一, 同步放化疗是胃癌R0切除术后的标准治疗, 同时引起的放化疗不良反应引起了临床广泛关注.
丁士刚, 教授, 北京大学第三医院消化科
近年来的很多研究证实, 分子靶向药物具有放射增敏作用, 且展示出其在放射领域的良好前景和临床应用价值.
ToGA研究改变了胃癌的治疗模式, 使根据患者的基因特性寻找肿瘤特定的生物标志进行个体化治疗成为可能.
厄洛替尼(erlotinib): 针对表皮生长因子受体(EGFR)的靶向药物, 已用于一线化疗失败的局部晚期或转移性非小细胞肺癌的治疗.
文章利用胃癌细胞系研究临床药物对放射治疗的增敏机制, 解释了一定的临床现象, 具有一定的临床研究意义.
编辑: 张姗姗 电编:鲁亚静
| 2. | Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, Haller DG, Ajani JA, Gunderson LL, Jessup JM. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-730. [PubMed] [DOI] |
| 3. | Sasako M. Surgery and adjuvant chemotherapy. Int J Clin Oncol. 2008;13:193-195. [PubMed] [DOI] |
| 4. | Ma C, Wei S, Song Y. T790M and acquired resistance of EGFR TKI: a literature review of clinical reports. J Thorac Dis. 2011;3:10-18. [PubMed] |
| 7. | Fukuda K, Saikawa Y, Takahashi M, Takahashi T, Wada N, Kawakubo H, Takeuchi H, Kitagawa Y. Antitumor effect of cetuximab in combination with S-1 in EGFR-amplified gastric cancer cells. Int J Oncol. 2012;40:975-982. [PubMed] |
| 8. | Yashiro M, Qiu H, Hasegawa T, Zhang X, Matsuzaki T, Hirakawa K. An EGFR inhibitor enhances the efficacy of SN38, an active metabolite of irinotecan, in SN38-refractory gastric carcinoma cells. Br J Cancer. 2011;105:1522-1532. [PubMed] [DOI] |
| 9. | Matsubara J, Yamada Y, Hirashima Y, Takahari D, Okita NT, Kato K, Hamaguchi T, Shirao K, Shimada Y, Shimoda T. Impact of insulin-like growth factor type 1 receptor, epidermal growth factor receptor, and HER2 expressions on outcomes of patients with gastric cancer. Clin Cancer Res. 2008;14:3022-3029. [PubMed] [DOI] |
| 10. | Kishida O, Miyazaki Y, Murayama Y, Ogasa M, Miyazaki T, Yamamoto T, Watabe K, Tsutsui S, Kiyohara T, Shimomura I. Gefitinib (Iressa, ZD1839) inhibits SN38-triggered EGF signals and IL-8 production in gastric cancer cells. Cancer Chemother Pharmacol. 2005;55:584-594. [PubMed] [DOI] |
| 12. | 谭 芬来, 王 印祥, 袁 晓玢, 丁 列明, 胡 蓓, 张 力, 周 建英, 申屠 建中, 孙 燕. EGFR-TKIs治疗非小细胞肺癌进展. 中国新药杂志. 2011;20:1594-1601. |
| 15. | Cohen EE, Halpern AB, Kasza K, Kocherginsky M, Williams R, Vokes EE. Factors associated with clinical benefit from epidermal growth factor receptor inhibitors in recurrent and metastatic squamous cell carcinoma of the head and neck. Oral Oncol. 2009;45:e155-e160. [PubMed] [DOI] |
| 16. | Conroy T, Mitry E. [Chemotherapy of metastatic pancreatic adenocarcinoma: challenges and encouraging results]. Bull Cancer. 2011;98:1439-1446. [PubMed] |
| 18. | Nakata E, Mason KA, Hunter N, Husain A, Raju U, Liao Z, Ang KK, Milas L. Potentiation of tumor response to radiation or chemoradiation by selective cyclooxygenase-2 enzyme inhibitors. Int J Radiat Oncol Biol Phys. 2004;58:369-375. [PubMed] [DOI] |
| 19. | Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697. [PubMed] [DOI] |
| 20. | Kim MA, Lee HS, Lee HE, Jeon YK, Yang HK, Kim WH. EGFR in gastric carcinomas: prognostic significance of protein overexpression and high gene copy number. Histopathology. 2008;52:738-746. [PubMed] [DOI] |
| 21. | Kahl BS. Update: gastric MALT lymphoma. Curr Opin Oncol. 2003;15:347-352. [PubMed] [DOI] |
| 22. | Han SW, Oh DY, Im SA, Park SR, Lee KW, Song HS, Lee NS, Lee KH, Choi IS, Lee MH. Phase II study and biomarker analysis of cetuximab combined with modified FOLFOX6 in advanced gastric cancer. Br J Cancer. 2009;100:298-304. [PubMed] [DOI] |
| 28. | 蔡 红星, 朱 正秋, 朱 祖安. 尼美舒利对人胃癌SGC-7901细胞凋亡影响的实验研究. 南京医科大学学报(自然科学版). 2009;29:1668-1671, 1697. |