修回日期: 2012-03-30
接受日期: 2012-04-19
在线出版日期: 2012-06-08
目的: 研究二甲双胍对胰腺癌细胞迁移的影响, 并初步探讨可能机制.
方法: 体外培养人胰腺癌细胞株Bxpc-3, 予二甲双胍进行干预作为实验组(M组), 无药物组作为对照组(C组). MTT检测二甲双胍对Bxpc-3细胞存活率的影响, 细胞划痕实验检测划痕愈合率, RT-PCR检测MMP-2、MMP-9 mRNA的表达, Elisa检测细胞培养上清液MMP-2、MMP-9蛋白的分泌量.
结果: 与对照组相比, MTT结果示二甲双胍可以抑制人胰腺癌细胞株Bxpc-3的增殖, 并呈时间-浓度依赖性(F = 8.991, 124, 114.61, P<0.01); 划痕实验示二甲双胍干预组12、24、48 h与对照组相比划痕愈合率显著下降(t = 7.683, 9.013, 10.471, P<0.01); RT-PCR示二甲双胍干预组MMP-2、MMP-9 mRNA的表达显著降低(t = 16.563, 28.494, P<0.01); Elisa示二甲双胍干预组MMP-2、MMP-9蛋白分泌明显下降(t = 9.428, 13.542, P<0.01).
结论: 二甲双胍能显著抑制人胰腺癌细胞株Bxpc-3的增殖及迁移, 其主要机制可能与抑制MMP-2、MMP-9活性有关.
引文著录: 唐曦平, 唐国都, 方春芸. 二甲双胍对人胰腺癌细胞迁移的抑制作用. 世界华人消化杂志 2012; 20(16): 1468-1472
Revised: March 30, 2012
Accepted: April 19, 2012
Published online: June 8, 2012
AIM: To investigate the effect of metformin on cell migration in human pancreatic cell line Bxpc-3, and to explore the possible mechanism involved.
METHODS: Cultured Bxpc-3 cells were treated with metformin as trial group or without metformin as control group. Survival rate of Bxpc-3 cells was determined by methyl thiazolyl tetrazolium (MTT) assay. Scratch assay was used to detect cell migration. Expression of MMP2 and MMP-9 mRNAs was determined by RT-PCR. The contents of MMP-2 and MMP-9 proteins in culture supernatants were determined by ELISA.
RESULTS: Compared to control cells, metformin decreased the proliferation of Bxpc-3 cells in a dose- and time-dependent manner (F = 8.991, 124, 114.61, all P < 0.01), reduced the rate of wound closure (t = 7.683, 9.013, 10.471, all P < 0.01), and down-regulated the protein and mRNA expression of MMP-2 and MMP-9 (mRNA: t = 16.563, 28.494, both P < 0.01; protein: t = 9.428, 13.542, both P < 0.01).
CONCLUSION: Metformin can inhibit the proliferation and migration of Bxpc-3 cells by inhibiting the activity of MMP-2 and MMP-9.
- Citation: Tang XP, Tang GD, Fang CY. Metformin inhibits cell migration in human pancreatic cancer cell line Bxpc-3. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1468-1472
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1468.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1468
胰腺癌起病隐匿, 早期诊断困难, 出现症状时多已发生转移, 这也是影响其预后的重要因素. 因此, 本实验从细胞迁移着手, 通过研究二甲双胍对人胰腺癌细胞株Bxpc-3迁移能力及相关基因转录、蛋白含量的影响, 初步探讨二甲双胍抑制胰腺癌细胞体外迁移能力的可能机制.
人胰腺癌细胞株Bxpc-3购自中国科学院上海生命科学研究院细胞资源中心; 二甲双胍粉末购自Sigma公司; RPMI 1640培养液、胎牛血清、青链霉素、胰酶购自Gibcol公司; 二甲基亚砜(DMSO)、噻唑蓝(MTT)购自Amresco公司; TRIzol、逆转录试剂盒购自Fermenta公司; RT-PCR Taq酶购自Omiga公司; DNA Marker购自天根生化科技有限公司; 人MMP-2、MMP-9 Elisa试剂盒购自武汉博士德生物工程有限公司; PCR引物由上海生工生物工程技术服务有限公司合成; 酶联免疫检测仪、PCR仪为美国Thermo公司产品; 凝胶成像系统为BIO-RAD公司产品; 细胞划痕实验结果用Image Pro软件分析.
1.2.1 细胞培养及药物干预: Bxpc-3细胞以含100 mL/L胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI l640培养液于37 ℃、50 mL/L CO2的饱和湿度无菌培养箱中培养. 每次实验前即时以PBS配制成一定浓度的二甲双胍.
1.2.2 MTT检测细胞抑制率: 消化收集对数生长期细胞后进行细胞计数, 并调整细胞浓度为2.5×104个/mL, 按每孔200 μL接种于96孔板, 周边余孔以无菌PBS封闭, 置37 ℃、50 mL/L CO2培养箱培养24 h贴壁后轻轻吸去上清液, 加入含不同浓度二甲双胍(0、5、10、15、20、25 mmol/L)的培养基, 每组设6复孔, 同时设不含药物的正常对照孔, 等体积的DMSO溶剂对照孔和空白对照空孔, 继续培养24、48、72 h, 每孔加入5 g/LMTT 20 μL, 37 ℃孵育4 h, 弃去液体, 每孔加DMSO 150 μL, 震荡混匀, 在酶联免疫检测仪上以570 nm波长测定各孔吸光度(A)值. 以实验组和对照组A值减去空白对照组A值为实际A值. 细胞相对存活率 = (实验孔A值-调零孔A值)/(对照孔A值-调零孔A值)×100%. 同样实验重复3次. 取50%抑制率的药物浓度进行以下干预实验.
1.2.3 细胞划痕实验: 取对数生长期细胞, 以每孔3×105/2 mL接种于6孔板, 分对照组及实验组, 每组设3复孔. 在培养板每孔底部水平方向画5条平行线进行显微镜下参照, 培养48 h后以200 μL移液器枪头在每孔中央纵向划一直线, PBS洗涤2次, 加入含或不含20 mmol/L二甲双胍培养基作用0、12、24、48 h后, 在显微镜下观察划痕处细胞生长状况并拍照.
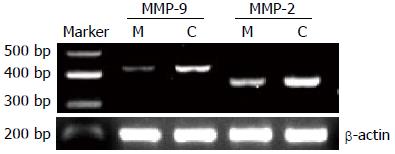
1.2.4 RT-PCR检测MMP-2、MMP-9 mRNA表达的变化: 实验组以20 mmol/L二甲双胍培养基作用48 h, 采用TRIzol抽提法提取实验组及对照组细胞总RNA, 逆转录成cDNA, 流程参照试剂盒说明进行. PCR反应条件: 94 ℃ 5 min; 94 ℃ 40 s, 60 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 7 min. 内参β-actin引物: 上游TGACGTGGACATCCGCAAAG, 下游CTGGAAGGTGGACAGCGAGG, 产物长度205 bp; 基质金属蛋白酶-2(MMP-2)引物: 上游CCGTCGCCCATCATCAAGTTCC, 下游GCACGAGCAAAGGCATCATCCA, 产物长度350 bp; 基质金属蛋白酶-9(MMP-9)引物: 上游CTTCCCTGGAGACCTGAGAAC, 下游CCAAACTGGATGACGATGTCT, 产物长度423 bp. 以凝胶成像系统分析相关基因表达.
1.2.5 ELISA检测细胞培养上清液MMP-2、MMP-9的蛋白分泌量: 以20 mmol/L二甲双胍培养基作用48 h为实验组, 收集对照组与实验组细胞的培养上清液, 离心去除细胞碎片, 按照ELISA试剂盒的操作说明对细胞培养上清液进行检测, 在酶联免疫检测仪上测490 nm波长的A值. 通过标准品的浓度及A值, 绘制标准曲线, 根据样品的A值在该曲线上查出相应MMP-2、MMP-9的含量.
统计学处理 采用SPSS18.0统计软件, 所得数据以mean±SD表示, 组间比较采用单因素方差分析、t检验, P<0.05为差异, 有统计学意义.
MTT结果示二甲双胍具有显著抑制人胰腺癌Bxpc-3细胞增殖的作用, 且呈明显浓度-时间依赖性, 差异具有统计学意义(F = 8.991、124、114.61, 均P<0.01, 表1).
二甲双胍组作用12、24、48 h后, 划痕愈合率均显著低于对照组, 对照组48 h后部分视野划痕得到完全愈合. 对照组与二甲双胍干预12、24、48 h相比划痕愈合率分别为: 20.468%±1.399% vs 14.530%±0.657%(t = 7.683, P<0.01); 48.920%±0.962% vs 32.270%±3.567%(t = 9.013, P<0.01); 91.013%±8.087% vs 45.138%±3.372%(t = 10.471, P<0.01, 图1).
与对照组相比, 二甲双胍干预后的MMP-2、MMP-9 mRNA表达均明显减少, 对照组与实验组MMP-2 mRNA相对表达量分别为0.416±0.023、0.210±0.020, 差异具有统计学意义(t = 16.563, P<0.01); 对照组与实验组MMP-9 mRNA相对含量分别为0.588±0.020、0.274±0.018, 差异具有统计学意义(t = 28.494, P<0.01, 图2).
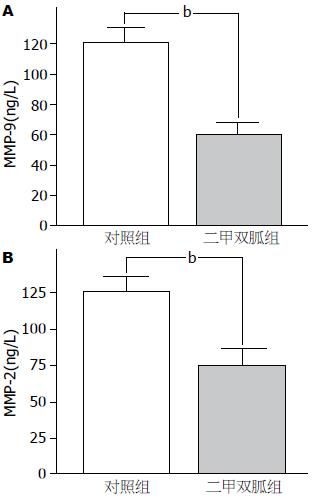
对照组与实验组MMP-9含量分别为120.135 ng/L±9.565 ng/L、60.492 ng/L±5.369 ng/L, 差异具有统计学意义(t = 13.542, P<0.01); 对照组与实验组MMP-2含量分别为125.66 ng/L±14.153 ng/L、75.337 ng/L±8.886 ng/L, 差异具有统计学意义(t = 9.428, P<0.01, 图3).
胰腺癌是一种死亡率很高的疾病, 1年生存率低于10%[1], 近年来发病率呈明显上升趋势, 在美国导致死亡的恶性肿瘤中排第4位, 具有侵袭性强、恶性程度高、发展快、预后差的特点. 其早期诊断困难, 大多数患者就诊时已属中晚期, 40%已发生远处转移[2], 因此一般手术切除率不高且目前化疗效果尚不理想, 临床治疗非常棘手. 因此, 控制胰腺癌的转移率、降低肿瘤侵袭性、提高生存率是目前胰腺癌治疗研究的目标. 而近年对于抗肿瘤作用的研究较为关注于相对安全性高的临床常用药及食品提取物[3,4]. 美国临床肿瘤学会2011年会议[5]支持了胰腺癌与糖尿病具有密切关系. 二甲双胍是治疗糖尿病的一线药物, 但新近研究[6]表明其可抑制多种肿瘤细胞的生长, 并且联合化疗药物可显著增强肿瘤细胞对化疗药物的敏感性. 近年二甲双胍与消化系肿瘤的相关研究成为热点, 体内、体外实验研究[7-9]证实二甲双胍能显著抑制胃癌、结肠癌细胞的增殖及诱导凋亡. 二甲双胍与胰腺癌的临床研究也日益受到关注, Li等[10]、Currie等[11]研究发现服用二甲双胍的糖尿病患者较不服用二甲双胍者患胰腺癌危险率明显降低. 目前体外实验研究发现二甲双胍能抑制胰腺癌细胞增殖和诱导凋亡[12], 但对于二甲双胍与胰腺癌细胞迁移的研究空白, 且其机制也不十分明确. 因此本实验应用相对安全的口服降糖药二甲双胍干预人胰腺癌细胞Bxpc-3, 探讨其对人胰腺癌细胞迁移的抑制作用. 我们的实验表明在划痕实验中, 二甲双胍干预组划痕愈合率较对照组明显下降, 这提示了二甲双胍可能有较好的抑制胰腺癌转移的作用.
细胞外基质的蜕变是肿瘤发生浸润与转移的重要环节, 其降解主要依靠蛋白水解酶, 包括丝氨酸蛋白酶、半胱氨酸蛋白酶、天门氡氨酸蛋白酶和MMPs. 其中MMPs几乎能降解细胞外基质的所有成分, 其过度表达和激化与癌症的浸润与转移密切相关. MMPs是一类锌依赖性的蛋白水解酶家族, 其中与消化系肿瘤侵袭和转移关系最密切的主要是MMP-2、MMP-9[13-16]. 因此我们测定了MMP-2、MMP-9的表达(包括mRNA和蛋白表达). 我们的实验结果表明: 二甲双胍能下调Bxpc-3细胞MMP-2、MMP-9的mRNA表达, 因为MMP-2、MMP-9属分泌型蛋白水解酶, 故我们又应用Elisa法检测细胞培养上清液MMP-2、MMP-9的含量, 结果显示二甲双胍干预组MMP-2、MMP-9含量较对照组明显减少, 这提示了二甲双胍抑制人胰腺癌细胞迁移的能力可能与下调MMP-2、MMP-9含量有关.
总之, 我们的实验结果表明: 二甲双胍能抑制人胰腺癌细胞株Bxpc-3的迁移, 作用机制可能与下调MMP-2、MMP-9含量有关. 因此, 作为一种安全性较好的药物, 很值得进一步开展二甲双胍治疗胰腺癌作用机制的相关研究, 为治疗胰腺癌及降低糖尿病患者胰腺癌发生率提供理论依据.
胰腺癌具有侵袭性强、恶性程度高、发展快、预后差的特点, 手术切除率低, 临床治疗棘手. 新近研究表明降糖药二甲双胍可抑制多种肿瘤细胞的生长, 近年二甲双胍与胰腺癌的相关研究也日益受到关注, 但对于二甲双胍与胰腺癌细胞迁移的研究存在空白.
于聪慧, 教授, 中国人民解放军北京军区总医院肝胆外科
目前体外实验研究发现二甲双胍能抑制胰腺癌细胞增殖和诱导凋亡, 但对于二甲双胍与胰腺癌细胞迁移的研究空白, 且其机制也不十分明确.
Currie等研究发现服用二甲双胍的糖尿病患者较不服用二甲双胍者胰腺癌危险率明显降低. 体外实验研究发现二甲双胍能抑制胰腺癌细胞增殖和诱导凋亡.
从细胞水平研究二甲双胍对胰腺癌迁移及侵袭的干预作用, 探讨二甲双胍抑制胰腺癌细胞迁移的可能机制, 将可能为胰腺癌提供新的治疗手段奠定理论基础, 具有较高的理论价值和应用前景.
本文对二甲双胍抑制胰腺癌细胞迁移的研究较直观, 实验方法使用较巧妙.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Goldstein D, Carroll S, Apte M, Keogh G. Modern management of pancreatic carcinoma. Intern Med J. 2004;34:475-481. [PubMed] [DOI] |
| 2. | Au E. Clinical update of gemcitabine in pancreas cancer. Gan To Kagaku Ryoho. 2000;27 Suppl 2:469-473. [PubMed] |
| 3. | Johnson JJ, Bailey HH, Mukhtar H. Green tea polyphenols for prostate cancer chemoprevention: a translational perspective. Phytomedicine. 2010;17:3-13. [PubMed] [DOI] |
| 4. | Nakamura Y, Yogosawa S, Izutani Y, Watanabe H, Otsuji E, Sakai T. A combination of indol-3-carbinol and genistein synergistically induces apoptosis in human colon cancer HT-29 cells by inhibiting Akt phosphorylation and progression of autophagy. Mol Cancer. 2009;8:100. [PubMed] [DOI] |
| 5. | Hsu C, Saif MW. Diabetes and pancreatic cancer. Highlights from the "2011 ASCO Annual Meeting". Chicago, IL, USA; June 3-7, 2011. JOP. 2011;12:330-333. [PubMed] |
| 6. | Ben Sahra I, Laurent K, Loubat A, Giorgetti-Peraldi S, Colosetti P, Auberger P, Tanti JF, Le Marchand-Brustel Y, Bost F. The antidiabetic drug metformin exerts an antitumoral effect in vitro and in vivo through a decrease of cyclin D1 level. Oncogene. 2008;27:3576-3586. [PubMed] [DOI] |
| 7. | Kato K, Gong J, Iwama H, Kitanaka A, Tani J, Miyoshi H, Nomura K, Mimura S, Kobayashi M, Aritomo Y. The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo. Mol Cancer Ther. 2012;11:549-560. [PubMed] [DOI] |
| 8. | Lee MS, Hsu CC, Wahlqvist ML, Tsai HN, Chang YH, Huang YC. Type 2 diabetes increases and metformin reduces total, colorectal, liver and pancreatic cancer incidences in Taiwanese: a representative population prospective cohort study of 800,000 individuals. BMC Cancer. 2011;11:20. [PubMed] [DOI] |
| 9. | Zakikhani M, Dowling RJ, Sonenberg N, Pollak MN. The effects of adiponectin and metformin on prostate and colon neoplasia involve activation of AMP-activated protein kinase. Cancer Prev Res (Phila). 2008;1:369-375. [PubMed] [DOI] |
| 10. | Li D, Yeung SC, Hassan MM, Konopleva M, Abbruzzese JL. Antidiabetic therapies affect risk of pancreatic cancer. Gastroenterology. 2009;137:482-488. [PubMed] [DOI] |
| 11. | Currie CJ, Poole CD, Gale EA. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia. 2009;52:1766-1777. [PubMed] [DOI] |
| 12. | Wang LW, Li ZS, Zou DW, Jin ZD, Gao J, Xu GM. Metformin induces apoptosis of pancreatic cancer cells. World J Gastroenterol. 2008;14:7192-7198. [PubMed] [DOI] |
| 13. | Yamamoto H, Vinitketkumnuen A, Adachi Y, Taniguchi H, Hirata T, Miyamoto N, Nosho K, Imsumran A, Fujita M, Hosokawa M. Association of matrilysin-2 (MMP-26) expression with tumor progression and activation of MMP-9 in esophageal squamous cell carcinoma. Carcinogenesis. 2004;25:2353-2360. [PubMed] [DOI] |
| 14. | Wang L, Zhang LH, Li YL, Li YL, Liu Z. [Expression of MMP-9 and MMP-9 mRNA in gastric carcinoma and its correlation with angiogenesis]. Zhonghua Yixue Zazhi. 2003;83:782-786. [PubMed] |
| 15. | Zhang S, Li L, Lin JY, Lin H. Imbalance between expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in invasiveness and metastasis of human gastric carcinoma. World J Gastroenterol. 2003;9:899-904. [PubMed] |
| 16. | Tutton MG, George ML, Eccles SA, Burton S, Swift RI, Abulafi AM. Use of plasma MMP-2 and MMP-9 levels as a surrogate for tumour expression in colorectal cancer patients. Int J Cancer. 2003;107:541-550. [PubMed] [DOI] |