修回日期: 2012-03-30
接受日期: 2012-04-25
在线出版日期: 2012-06-08
目的: 研究ROS、SOD、LPO、NF-κB及CTGF mRNA在酒精性肝纤维化大鼠中的表达状况及参芪扶正注射液的干预作用.
方法: SD大鼠100只, 随机分为正常对照组、模型组和参芪扶正注射液小剂量治疗组2.0 mL/(100 g•d)、中剂量治疗组2.5 mL/(100 g•d)、大剂量治疗组3.0 mL/(100 g•d). 以乙醇灌胃诱导大鼠肝纤维化模型, 治疗组造模同时给予参芪扶正注射液尾静脉注射, 共16 wk. 16 wk后处死大鼠取肝组织标本, 光镜观察肝组织的病理变化, 放射免疫法测定血清ROS、SOD、LPO含量及NF-κB活性, 逆转录-聚合酶链反应(RT-PCR)法检测肝组织结缔组织生长因子(CTGF) mRNA表达.
结果: 与正常组比较, 模型组SOD显著下降, 肝组织纤维化积分、ROS、LPO、 NF-κB活性及CTGF mRNA表达显著增加(P<0.01); 与模型组比较, 治疗组SOD显著上升, 肝组织纤维化积分、ROS、LPO、 NF-κB活性及CTGF mRNA表达显著下降(P<0.01), 肝组织纤维化积分和ROS、LPO及CTGF mRNA表达呈正相关关系(r = 0.463、0.425、0.412, 均P<0.05).
结论: 脂质过氧化、NF-κB活化、CTGF与酒精性肝纤维化的严重程度密切相关, 3者对酒精性肝纤维化发生、发展有协同作用, 参芪扶正注射液能显著抑制脂质过氧化、降低NF-κB活性及CTGF mRNA表达, 从而减轻肝组织损害严重程度.
引文著录: 孙屹峰, 郭李柯, 秦咏梅, 杨道坤, 张超贤. 参芪扶正注射液对酒精性肝纤维化大鼠ROS、SOD、LPO、NF-κB及CTGF mRNA表达的干预作用. 世界华人消化杂志 2012; 20(16): 1463-1467
Revised: March 30, 2012
Accepted: April 25, 2012
Published online: June 8, 2012
AIM: To explore the effect of Shenqi Fuzheng Injection on serum levels of ROS, SOD, LPO, NF-κB and CTGF mRNA expression in rats with alcoholic hepatic fibrosis.
METHODS: One hundred male SD rats were divided into normal group, model group, low [(2.0 mL/(100 g•d)], medium [(2.5 mL/(100 g•d)] and high-dose [(3.0 mL/(100 g•d)] Shenqi Fuzheng Injection groups. Rats were intragastrically administered with alcohol for 16 wk to induce hepatic fibrosis. Shenqi Fuzheng Injection was injected into the tail vein of rats in the three treatment groups. The rats were killed after 16 wk. The histological structure of the liver tissue was observed under an optical microscope, the levels of ROS, SOD, LPO and NF-κB in serum were determined by radioimmunoassay, and the expression of connective tissue growth factor (CTGF) mRNA was measured by reverse transcriptase-polymerase chain reaction (RT-PCR).
RESULTS: Compared to the normal group, the level of serum SOD decreased significantly and the fibrosis score and the levels of ROS, LPO, NF-κB and CTGF mRNA increased significantly in the model group (all P < 0.01). Compared to the model group, the level of serum SOD increased significantly and the fibrosis score and the levels of ROS, LPO, NF-κB and CTGF mRNA decreased significantly in the treatment groups (all P < 0.01). The levels of ROS, LPO and CTGF mRNA were positively correlated with the fibrosis score (r = 0.463, 0.425, 0.412, all P < 0.05).
CONCLUSION: Lipid peroxidation, NF-κB activation and CTGF are closely related to the severity of alcoholic hepatic fibrosis, and there may be a synergetic interaction among lipid peroxidation, NF-κB and CTGF in the pathogenesis of alcoholic hepatic fibrosis. Shenqi Fuzheng Injection can inhibit lipid peroxidation, decrease NF-κB activity and CTGF mRNA expression and thereby alleviate the severity of hepatic fibrosis in rats with alcoholic hepatic fibrosis.
- Citation: Sun YF, Guo LK, Qin YM, Yang DK, Zhang CX. Effect of Shenqi Fuzheng Injection on serum levels of ROS, SOD, LPO, NF-κB and CTGF mRNA expression in rats with alcoholic hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1463-1467
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1463.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1463
肝星状细胞(hepatic stellate cells, HSCs)的活化与增殖是肝纤维化形成的关键因素. 在肝脏损伤时, HSCs受到各种致病因子的刺激, 从静息状态转化为具有增生性、纤维原性和可收缩性的肌成纤维细胞, 后者产生大量细胞外基质(extracellular matrix, ECM)在肝脏沉积, 在肝纤维化发生、发展中起关键作用[1]. 研究表明, 过氧化脂质(lipid peroxidation, LPO)和结缔组织生长因子(connective tissue growth factor, CTGF)在促使HSCs增殖与活化, 诱导肝纤维化过程中发挥重要作用, NF-κB是一种核转录因子, 能够被脂质过氧化产物、内毒素等因素激活, 调节包括CTGF等多种基因的表达, 间接参与肝纤维化的形成. 参芪扶正注射液具有益气扶正功能, 从中医理论上应具有良好抗肝纤维化作用, 本实验通过参芪扶正注射液治疗乙醇诱导的肝纤维化大鼠, 观察大鼠活性氧自由基(reactive oxygen species, ROS)、超氧化物歧化酶(superoxide dismutase, SOD)、LPO含量、NF-κB和CTGF mRNA表达, 以期了解参芪扶正注射液抗肝纤维化部分可能的机制, 为其抗肝纤维化提供现代医学证据.
Spragne-Dawley(SD)大鼠100只, ♂, 新乡医学院实验动物中心提供. 无水乙醇(上海锐聪科技发展有限公司), 参芪扶正注射液(250 mL/瓶, 丽珠集团利民制药厂生产, 批准文号: 国药准字Z19990065), CTGF引物(上海博亚生物技术有限公司), SOD、GSH-PX、MDA检测试剂盒(南京建成生物工程研究所), NF-κB检测试剂盒(美国RD公司).
1.2.1 分组及造模: 100只3月龄SD健康大鼠随机分为: 正常组、模型组和参芪扶正注射液小剂量治疗组2.0 mL/(100 g•d)、中剂量治疗组2.5 mL/(100 g•d)、大剂量治疗组3.0 mL/(100 g•d)各20只. 造模方法如下: 给予400 mL/L 乙醇8 g/(kg•d), 分2次灌胃连续16 wk, 模型组造模同时予生理盐水尾静脉注射, 治疗组造模同时给予上述各剂量参芪扶正注射液尾静脉注射; 正常组用生理盐水灌胃, 生理盐水尾静脉注射, 共16 wk. 在造模过程中模型组和小剂量治疗组各死亡1只.
1.2.2 标本留取: 造模16 wk结束, 称取动物体质量, 氯氨酮麻醉下, 将动物取仰位固定于手术台上, 从左侧第3-4肋间逐层切开暴露胸腔, 找出下腔静脉, 用注射器从下腔静脉抽血约4 mL; 动物处死后打开腹腔, 取出肝脏并称重; 在肝右叶位置切取小块组织, 置入40 g/L甲醛缓冲液中固定. 其余肝组织分装于离心管中低温保存.
1.2.3 血清NF-κB、ROS、SOD活力及LPO含量的测定: ESILA法测定NF-κB, ROS测定采用Fenton反应显色法, LPO的测定采用硫代巴比妥酸(TBA)比色法, SOD的测定采用黄嘌呤氧化法. 以上步骤均按试剂盒要求操作.
1.2.4 肝组织病理观察: 取经中性甲醛缓冲液固定的大鼠肝组织, 石蜡包埋, 切片为5 µL厚度, 多级酒精脱水, 二甲苯透明, 作HE染色、Masson染色. 肝脏纤维化程度分级积分标准参照文献[2,3]: 0级: 无纤维化; Ⅰ级: 汇管区纤维化扩大,局限窦周及小叶内纤维化; Ⅱ级: 汇管区周围纤维化, 纤维间隔形成, 小叶结构保留; Ⅲ级: 纤维间隔伴小叶结构紊乱, 无肝硬化; Ⅳ级: 早期肝硬化. 肝纤维化积分方法为纤维化0级为0分, Ⅰ级为3分, Ⅱ级6分至Ⅳ级15分, 其中根据每一级大鼠肝纤维化程度不同依次记0、1、2、3至15分.
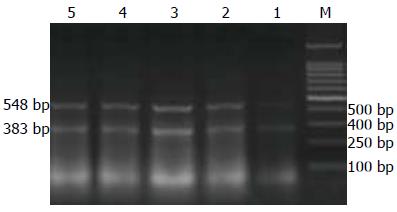
1.2.5 肝组织CTGF mRNA检测: 在16周末同组织学检查法取大鼠肝组织, 剪成1 cm×1 cm×1 cm大小, 储存于-80 ℃冰箱中. TRIzol试剂盒(美国Invitrogen公司)提取大鼠肝组织总RNA,逆转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction, RT-PCR)检测肝组织中CTGF mRNA的表达. 分别取正常组、模型组和治疗组各3个肝组织进行研究, CTGF引物由上海博亚生物技术有限公司合成, 其序列为上游引物: 5'-CTAAGACCTGTGGGATGGGC-3', 下游引物: 5'-CTAAGACCTGTGGGATGGGC-3', 扩增产物长度为383 bp. β-actin引物序列为上游引物: 5'-GTTGTCCCTGTATGCCTCTG-3', 下游引物: 5'-GGAGCCAGGGCAGTAATCT-3', 扩增产物长度为548 bp. PCR反应体系为20 μL, PCR循环参数为: 94 ℃预变性3 min; 94 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸30 s, 共30-35个循环; 最后72 ℃延伸7 min. 每次PCR反应均以无菌双蒸水代替cDNA模板作为阴性对照. 取7 μL PCR产物在15 g/L琼脂糖凝胶中进行电泳, 紫外线下观察结果, 并在凝胶电泳分析系统下拍照. 求出每条带的密度值, 以β-actin PCR产物作为内参照. 求出每条目的条带与β-actin条带的比值, 进行统计学处理.
统计学处理 采用SPSS12.0统计软件进行Shapiro Wilk检验、成组设计资料的t检验、χ2检验、Fisher's精确检验和Kruskal-Wallis非参数检验及Spearman等级相关分析的统计学处理.
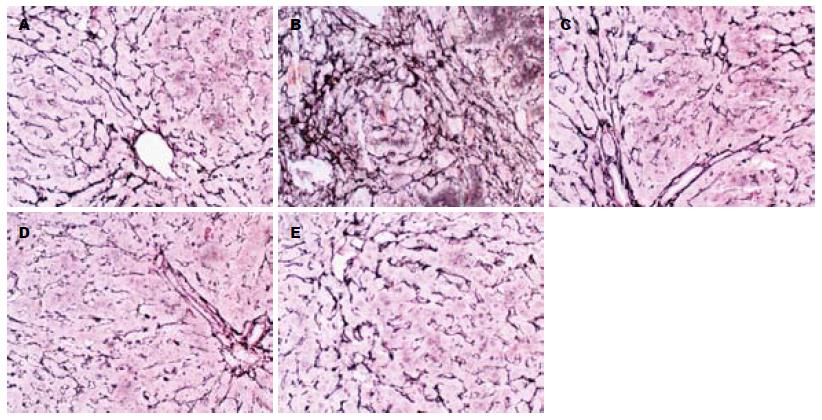
正常组肝细胞排列整齐, 胞浆均匀, 肝小叶及小叶中央静脉完整, 轮廓清楚, 肝细胞索网状纤维结构完整. 模型组肝脏广泛肝细胞脂肪变性、坏死, 多数汇管区有淋巴细胞、单核细胞至汇管区向邻近肝小叶内浸润, 同时小叶内大范围坏死塌陷形成较厚的纤维间隔, 肝小叶排列紊乱; 各治疗组可见肝组织内炎症细胞浸润、肝细胞坏死和纤维组织增生较模型组减轻, 纤维间隔较薄(图1). 各组肝组织纤维化积分比较见表1.
与正常组比较, 模型组SOD显著下降, ROS、LPO、NF-κB活性和CTGF mRNA表达显著增加; 与模型组比较, 治疗组SOD显著上升, ROS、LPO、NF-κB活性和CTGF mRNA表达显著下降, 提示参芪扶正注射液可显著提高实验性肝纤维化大鼠的SOD活性, 降低ROS、LPO、NF-κB及CTGF mRNA表达. 各组大鼠ROS、SOD、LPO、NF-κB活性及肝组织CTGF mRNA检测结果见表2, CTGF mRNA电泳图见图2.
| 分组 | n | ROS(U/μL) | SOD(NU/mL) | LPO(μmol/L) | NF-κB活性 | CTGF mRNA |
| 正常组 | 20 | 8.35±5.24 | 317.29±18.72 | 1.86±0.58 | 11.54±5.38 | 0.3182±0.1503 |
| 模型组 | 19 | 19.57±6.14e | 149.61±13.48e | 4.72±2.51e | 24.18±7.69e | 0.7673±0.0845e |
| 小剂量治疗组 | 19 | 15.61±2.96b | 226.85±27.06b | 3.26±1.92b | 18.73±6.25b | 0.4952±0.1641b |
| 中剂量治疗组 | 20 | 11.03±7.80bc | 260.59±19.25bc | 2.13±0.74bc | 14.37±5.23bc | 0.3615±0.0892bc |
| 大剂量治疗组 | 20 | 10.86±5.34bc | 264.83±35.73bc | 2.06±1.85bc | 12.53±3.04bc | 0.3592±0.1853bc |
肝组织纤维化积分和ROS、LPO及CTGF mRNA表达呈正相关(r = 0.463, 0.425, 0.412, 均P<0.05).
在生理情况下, 肝细胞内存在着自由基的清除剂即抗氧化剂可以随时清除不断生成的有害自由基, 使自由基的生成与降解处于动态平衡, 因此当肝细胞受损时, 由于活性氧生成过多或机体抗氧化能力不足, 可引发氧化应激反应. 大量研究发现酒精性肝脏中抗氧化物质明显减少, 并应用电子自旋共振技术直接测定酒精性肝病(ALD)发病过程中肝组织ROS含量明显增高[4]. ROS能攻击生物膜磷脂中的多聚不饱和脂肪酸发生脂质过氧化反应, 形成 LPO, LPO可通过诱导炎性细胞浸润, 激活Kupffers细胞和HSCs, 引发肝纤维化[5]. SOD具有特殊的生理活性, 是生物体内清除ROS的首要物质. 他具有将ROS反应的始动因子超氧阴离子歧化产生为H2O2, 并进一步再生成水和氧的能力, SOD活力的高低间接反映了机体清除ROS的能力[6]. ROS主要是由氧组成的、性质活泼、氧化性强物质的总称, 主要包括羟基自由基、超氧阴离子自由基、过氧化氢和过氧化的不稳定中间体, ROS对机体造成的最大损害是导致脂质过氧化[7], LPO在体内的含量反映了脂质过氧化的程度和速率, 联合测定ROS、SOD、LPO能了解自由基反应与脂质过氧化以及疾病的关系, 可作为疾病的诊断、预后和抗氧化治疗的一个有用指标. CTGF是一种与肝纤维化密切相关的促纤维化细胞因子, 在慢性肝病患者及实验性动物肝组织中, CTGF表达水平增高, 并与肝纤维化积分呈正相关[8]. CTGF可介导TGFβ1、血管内皮生长因子(vascular endothelial growth factor, VEGF)、脂质过氧化物等多种信号刺激的促纤维化作用, 可促进包括HSCs在内的多种纤维活性细胞合成并分泌ECM[9]. NF-κB活化是众多细胞因子作用机制的共同通道, 诸多细胞因子在基因水平上都受到NF-κB的调控. NF-κB是一种具有多向转录调节作用的蛋白. 在静止期细胞的胞质中, NF-κB处于P50、P65与抑制蛋白IκB结合的多聚体非活化状态. 当细胞受到致病微生物、活性氧、过氧化脂质等外源性刺激时, 多聚体上的IκB磷酸化降解, NF-κB活化, 进入细胞核内与特定基因启动因子区域位点结合, 启动细胞因子、炎症因子、黏附分子等靶基因的转录, 产生大量的包括TGFβ1、VECG、CTGF、TNF-α等细胞因子[10,11]. 本研究显示, 模型组较正常组大鼠ROS、LPO、NF-κB活性和CTGF mRNA表达显著增加, 且与肝组织纤维化积分相平行, 进一步印证了自由基反应、脂质过氧化、NF-κB异常活化及CTGF高表达在肝纤维化中的作用, 因此若能抑制脂质过氧化、抑制NF-κB活化, 下调CTGF表达, 则有希望减少HSCs活化、增殖和胶原的沉积达到发挥抗纤维化的作用.
祖国医学认为正虚血瘀是肝纤维化的基本病理机制, 参芪扶正注射液是采用黄芪、党参等中药为主要原料, 提取有效成分研制而成, 具有扶正固本、益气补虚、活血化瘀的功效. 从中医理论上参芪扶正注射液应具有良好的抗肝纤维化作用. 本研究显示, 参芪扶正注射液能显著提高SOD、降低肝纤维化大鼠ROS、LPO、NF-κB及CTGF mRNA的表达、降低肝纤维化积分, 表明其可通过提高机体抗氧化能力、抗脂质过氧化、抑制NF-κB活化、下调CTGF表达来发挥抗肝纤维化作用, 其作用机制可能是: (1)氧自由基和脂质过氧化物可能是NF-κB重要刺激物, 可活化NF-κB, 促进CTGF等相应基因的转录, 另外LPO不仅可活化Kupffer细胞, 分泌TGF-β1等细胞毒性因子, 继而激活HSCs, 还能直接激活HSCs, 而上述活化的HSCs是CTGF主要来源, TGF-β1也可促进CTGF的转录[12], CTGF反过来又可介导TGFβ1、脂质过氧化物等多种信号刺激的促纤维化作用, 可促进包括HSCs在内的多种纤维活性细胞合成并分泌ECM, 所以在肝纤维化发生、发展过程中, 脂质过氧化、NF-κB和CTGF是相互协同、相互促进的, 形成一种正反馈网络; (2)参芪扶正注射液主要成分为黄芪、党参, 黄芪中的总黄酮、黄芪总皂苷、黄芪总多糖及党参中的黄酮类、酚酸类物质均具有较强的抗氧化能力, 现代药理研究已证明, 黄芪总黄酮和黄芪总皂苷清除自由基的主要机制是结构中的酚羟基类基团在与氧自由基作用时, 通过提供氢原子, 发生氧化还原反应而发挥作用[13,14]. 另外褪黑素是一种作用很强的内源性抗氧化剂, 可直接清除和抑制氧自由基产生, 还能增强内源性抗氧化酶的作用, 而黄芪总皂苷则可促进机体褪黑素分泌或加强其与受体结合而增强机体的抗氧化能力[15]. 所以参芪扶正注射液以清除自由基、抗脂质过氧化为突破口, 打断了脂质过氧化-NF-κB-CTGF促肝纤维化的正反馈网络, 显示出良好的抗纤维化效果, 本研究为临床上使用参芪扶正注射液治疗肝纤维化提供了实验和理论依据.
研究表明, 脂质过氧化和结缔组织生长因子(CTGF)在促使肝星型细胞(HSCs)增殖与活化, 诱导肝纤维化过程中发挥重要作用, NF-κB是一种核转录因子, 能够被脂质过氧化产物、内毒素等因素激活, 调节包括CTGF等多种基因的表达, 间接参与肝纤维化的形成.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
自由基反应、脂质过氧化、NF-κB异常活化及CTGF高表达在肝纤维化发生、发展中发挥重要作用, 因此若能抑制脂质过氧化、抑制NF-κB活化, 下调CTGF表达, 则有希望减少HSCs活化、增殖和胶原的沉积, 进而达到发挥抗纤维化的作用.
本研究显示参芪扶正注射液以清除自由基、抗脂质过氧化为突破口, 打断了脂质过氧化-NF-κB-CTGF促肝纤维化的正反馈网络, 显示出良好的抗纤维化效果, 为临床上使用参芪扶正注射液治疗肝纤维化提供了实验和理论依据.
本文选题新颖、设计合理, 实验手段先进, 结果可信, 文笔通畅, 具有较好的可读性.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | 袁 丽萍, 陈 飞虎, 鹿 玲, 都 鹏飞, 胡 波, 吴 繁荣, 袁 凤来, 李 俊. 鬼针草总黄酮对肝纤维化大鼠肝星状细胞TGF-β1信号传导通路的影响. 中国药理学通报. 2009;25:1655-1659. |
| 4. | Zhong Z, Froh M, Wheeler MD, Smutney O, Lehmann TG, Thurman RG. Viral gene delivery of superoxide dismutase attenuates experimental cholestasis-induced liver fibrosis in the rat. Gene Ther. 2002;9:183-191. [PubMed] [DOI] |
| 5. | Meagher EA, Barry OP, Burke A, Lucey MR, Lawson JA, Rokach J, FitzGerald GA. Alcohol-induced generation of lipid peroxidation products in humans. J Clin Invest. 1999;104:805-813. [PubMed] [DOI] |
| 8. | Paradis V, Dargere D, Bonvoust F, Vidaud M, Segarini P, Bedossa P. Effects and regulation of connective tissue growth factor on hepatic stellate cells. Lab Invest. 2002;82:767-774. [PubMed] |
| 9. | Leask A, Abraham DJ. The role of connective tissue growth factor, a multifunctional matricellular protein, in fibroblast biology. Biochem Cell Biol. 2003;81:355-363. [PubMed] [DOI] |
| 10. | Inoue J, Gohda J, Akiyama T, Semba K. NF-kappaB activation in development and progression of cancer. Cancer Sci. 2007;98:268-274. [PubMed] [DOI] |
| 11. | Acharyya S, Villalta SA, Bakkar N, Bupha-Intr T, Janssen PM, Carathers M, Li ZW, Beg AA, Ghosh S, Sahenk Z. Interplay of IKK/NF-kappaB signaling in macrophages and myofibers promotes muscle degeneration in Duchenne muscular dystrophy. J Clin Invest. 2007;117:889-901. [PubMed] [DOI] |
| 12. | Dooley S, Delvoux B, Streckert M, Bonzel L, Stopa M, ten Dijke P, Gressner AM. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells. FEBS Lett. 2001;502:4-10. [PubMed] [DOI] |