修回日期: 2012-03-23
接受日期: 2012-04-25
在线出版日期: 2012-06-08
目的: 探讨胃癌患者腹膜间皮细胞中βig-h3表达与胃癌生物学行为及腹膜转移相关因素的关系.
方法: 术中收集75例胃癌和14例胃良性疾病患者下腹前壁腹膜组织, 同时收集胃癌患者腹水或腹腔冲洗液, 免疫组织化学染色方法检测腹膜间皮细胞中βig-h3含量, RT-PCR方法检测腹水或腹腔冲洗液中CEA mRNA含量, 同时进行腹腔冲洗液细胞学(peritoneal lavage cytological, PLC)和病理学检查.
结果: 29例胃癌和1例胃良性疾病患者腹膜组织βig-h3免疫组织化学染色结果呈阳性, 差异具有统计学意义(P = 0.030). 75例胃癌病例中, 13例伴有肉眼腹膜转移, 20例腹腔脱落癌细胞呈阳性; 32例CEA mRNA阳性. βig-h3阳性率在浸润较深(T4)(P = 0.016)、腱状及多彩弥漫的浆膜类型(P = 0.037)、肉眼腹膜转移阳性(P = 0.002)、腹腔脱落癌细胞阳性(P = 0.005)及CEA mRNA阳性组(P = 0.027)的患者腹膜组织中表达明显升高, 差异具有统计学意义.
结论: 腹膜间皮细胞中βig-h3表达可作为反映胃癌生物学行为的指标之一, 与胃癌腹膜转移密切相关.
引文著录: 李震, 苗志峰, 徐樱溪, 徐盟, 徐惠绵. 腹膜间皮细胞表达βig-h3与胃癌病理及腹膜转移相关因素的关系. 世界华人消化杂志 2012; 20(16): 1402-1406
Revised: March 23, 2012
Accepted: April 25, 2012
Published online: June 8, 2012
AIM: To determine the expression of βig-h3 in peritoneal mesothelial cells in gastric cancer and to explore its relation to pathological parameters and peritoneal metastasis.
METHODS: Peritoneal tissue and peritoneal washing fluid samples were collected during operation from 75 patients with gastric cancer and 14 patients with benign gastric lesions. The expression of βig-h3 in peritoneal mesothelial cells was measured immunohistochemically. The mRNA levels of CEA in ascites and peritoneal washing fluid were measured by RT-PCR. Peritoneal lavage cytological (PLC) examination and pathological examination were also performed.
RESULTS: βig-h3 was positively expressed in the peritoneal tissue in 29 patients with gastric cancer and 1 with benign gastric lesions, and the positive rate was significantly different between the two groups (P = 0.030). In the gastric cancer group, 13 patients had evident peritoneal metastasis, 20 were positive for PLC, and 32 were positive for CEA mRNA. The positive rate of βig-h3 expression was significantly positively correlated with deep invasion (P = 0.016), serious serous type (P = 0.037), peritoneal metastasis (P = 0.002), PLC (+) (P = 0.005), and CEA mRNA (+) (P = 0.027).
CONCLUSION: βig-h3 expression in peritoneal mesothelial cells in gastric cancer patients is closely related with peritoneal metastasis, representing a marker of biological behavior of gastric cancer.
- Citation: Li Z, Miao ZF, Xu YX, Xu M, Xu HM. Correlation of βig-h3 expression in peritoneal mesothelial cells with pathological parameters and peritoneal metastasis in gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1402-1406
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1402
进行期胃癌根治切除术后5年生存率仍徘徊在40%-50%, 其主要原因在于术后腹膜复发转移病例约占40%-50%. 目前认为这源于手术前已有癌细胞穿透胃浆膜或转移淋巴结被膜脱落入腹腔, 播散种植日后形成转移结节[1-5]. 针对胃癌腹膜转移的"种子-土壤"学说受到大多数学者的认可和支持, 而对于在胃癌腹膜转移过程中, 土壤-腹膜间皮细胞的形态、结构、功能的改变及其影响因素正在成为胃癌腹膜转移研究新的热点和方向[6-11]. 脱落的、有活性的癌细胞或其分泌的细胞因子可使腹膜的形态发生变化, 进而使其转化成适合肿瘤细胞种植、黏附、生长的状态[8,11-14]. 在此过程中, 转化生长因子-β1(TGF-β1)发挥着至关重要的作用[10,12,15-17]. 先期研究证实, TGF-β1可通过诱导腹膜间皮细胞发生上皮-间质转化, 诱导腹膜纤维化, 进而促进胃癌细胞与腹膜组织黏附, 最终促进胃癌腹膜转移的发生[10,14]. βig-h3, 又称TGFBI, 是由TGF-β1诱导合成的细胞外基质蛋白, 参与细胞-细胞, 细胞-基质的黏附[15-18]. 现已证实, βig-h3在人肝癌细胞、大肠癌细胞的高表达明显增强了其浸润和转移能力[16,17]. 因此, 我们有理由推测βig-h3可能在TGF-β1诱导胃癌腹膜转移进程中发挥一定作用. 我们应用免疫组织化学方法检测细胞外基质蛋白βig-h3在胃癌患者腹膜间皮细胞中的表达, 探讨其与胃癌腹膜转移相关因素的关系, 旨在为进一步研究胃癌腹膜转移机制提供线索和实验依据.
病例来源于2011-05/09中国医科大学附属第一医院肿瘤外科胃癌手术病例75例, 其中男51例, 女24例; 平均年龄61岁(32-81岁). 另收集14例同期胃良性病变标本作为对照. 所有患者术前均未经放射及化学治疗, 所有患者被告知本实验相关内容并签署知情同意书. 鼠抗人βig-h3单克隆抗体购自Protein Tech公司(美国), SP免疫组织化学试剂盒购自福州迈新生物技术开发公司.
1.2.1 标本采集及PLC检查: 手术开腹后, 于Douglas腔置20号导尿管, 注入生理盐水100 mL, 轻轻搅动后吸出, 如已有腹水者直接吸出. 腹腔冲洗液标本静置5 min后, 以2 000 r/min离心20 min, 取部分沉渣行细胞学检查; 其余冲洗液沉渣提取总RNA, 低温冰箱冻存. 腹膜组织取自前下方腹壁, 并立刻固定于10%的甲醛溶液, 石蜡包埋、切片(5 μm), 择期行免疫组织化学染色.
1.2.2 免疫组织化学: SP染色法主要步骤为: (1)石蜡切片脱蜡水化; (2)抗原修复: 采用pH 6.0的0.01 mol/L柠檬酸钠缓冲液, 微波热修复(高火3 min, 低火16 min); (3)加入过氧化物酶阻断溶液后, 室温下孵育20 min; (4)PBS缓冲液冲洗后, 加入非免疫动物血清, 室温下孵育15 min; (5)加入一抗(1:10稀释), 4 ℃过夜; (6)PBS缓冲液冲洗后加入生物素标记二抗, 室温下孵育20 min; (7)PBS缓冲液冲洗后加入生物素标记三抗, 室温下孵育20 min; (8)DAB显色, 中性树胶封片. 用PBS代替一抗作阴性对照.
1.2.3 RT-PCR: 大连TaKaRa公司合成引物序列, CEA mRNA PCR引物A: 5'-CATCATGATTGGAGTGCTGGTTG-3'; B: 5'-CACGATGTTGGCTAGGATGGTC-3', 产物199 bp; 按RT-PCR试剂盒(北京博大泰克生物基因技术有限公司)说明, 在反应系统中加入总RNA 2 μg, 置于42 ℃孵育120 min, 95 ℃热变性5 min. 将mRNA逆转录成cDNA. PCR反应条件, 按94 ℃ 50 s→55 ℃ 50 s→72 ℃ 60 s循环32次, 最后72 ℃延伸8 min.
1.2.4 结果分析: 按日本胃癌病理规约标准判定病灶的分化程度、生长方式、浆膜类型、有否肉眼腹膜转移. 浸润深度按照UICC制定的第7版TNM分期系统的T分级. 根据胃癌腹腔冲洗液PLC检查结果分组为: PLC(-)组、PLC(+)组. 在排除非特异性染色的前提下, 以腹膜间皮细胞胞质内出现黄色、棕黄色、浅褐色颗粒为阳性标记. PCR扩增后产物经含EB染色剂的2%琼脂糖凝胶电泳, 以199 bp出现阳性条带为CEA mRNA阳性.
统计学处理 应用SPSS16.0统计软件包进行分析, 各组间指标比较用χ2检验, P<0.05为差异有统计学意义.
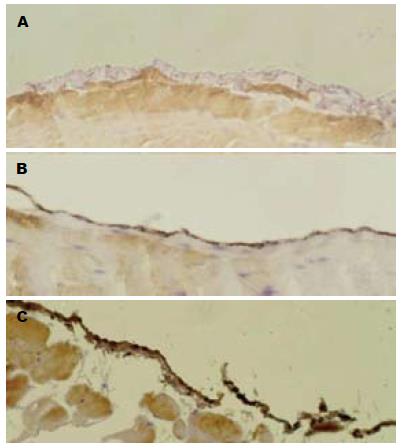
75例胃癌患者中, 29例腹膜组织βig-h3免疫组织化学染色结果呈阳性, 46例呈阴性(图1). 14例胃良性疾病患者中, 1例呈阳性. 胃癌组阳性比率明显高于良性疾病组, 差异具有统计学意义(P = 0.030).
75例胃癌病例中, 29例腹膜组织βig-h3免疫组织化学染色结果为阳性. 腹膜组织免疫组织化学阳性率在未分化、弥漫状生长、淋巴结转移阳性的胃癌中升高, 但差异不具有统计学意义; 在浸透浆膜(T4)、浆膜呈腱状及多彩弥漫型组中明显升高, 差异具有统计学意义(P<0.05, 表1).
| 病理生物学因素 | βig-h3免疫组织化学染色(n) | P值 | |
| - | + | ||
| 分化程度 | 0.555 | ||
| 分化型 | 19 | 10 | |
| 未分化型 | 27 | 19 | |
| 生长方式 | 0.362 | ||
| 团块、巢状 | 22 | 17 | |
| 弥漫状 | 24 | 12 | |
| 浸润深度 | 0.016 | ||
| T1、T2、T3 | 32 | 12 | |
| T4 | 14 | 17 | |
| 淋巴结转移 | 0.338 | ||
| 阴性 | 21 | 16 | |
| 阳性 | 25 | 12 | |
| 浆膜类型 | 0.037 | ||
| 正常及反应型 | 13 | 3 | |
| 结节型 | 19 | 9 | |
| 腱状及多彩弥漫性 | 14 | 17 | |
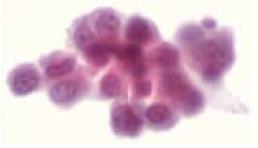
75例胃癌病例中, 13例伴有肉眼腹膜转移, 20例腹腔脱落癌细胞呈阳性(图2); 32例CEA mRNA结果阳性. βig-h3表达阳性率在肉眼腹膜转移阳性、腹腔脱落癌细胞阳性及CEA mRNA阳性组明显升高, 差异具有统计学意义(P<0.05, 表2).
| 腹膜转移相关因素 | βig-h3免疫组织化学染色(n) | P值 | |
| £ | + | ||
| 肉眼腹膜转移 | 0.002 | ||
| 阴性 | 43 | 19 | |
| 阳性 | 3 | 10 | |
| PLC | 0.005 | ||
| 阴性 | 39 | 16 | |
| 阳性 | 7 | 13 | |
| CEA mRNA | 0.027 | ||
| 阴性 | 31 | 12 | |
| 阳性 | 15 | 17 | |
βig-h3基因是由Skonier等于1992年从人肺腺癌细胞系A549中发现的细胞外基质蛋白, 参与调节细胞的生长、分化、运动、损伤修复和形态形成, 并与肿瘤的发生、肿瘤细胞黏附及增殖等密切相关[15-18]. Ma等[17]用免疫组织化学方法证实, βig-h3在结肠癌组织中的表达量明显高于正常肠黏膜组织, 且在转移灶中的表达量明显高于原发灶. 抑制βig-h3的表达, 可明显降低结肠癌细胞的侵袭、转移能力. 而针对βig-h3在胃癌转移, 特别是胃癌腹膜转移中的作用却未见报道.
临床实践已发现, 腹腔内存在脱落癌细胞不一定均引起腹膜种植; 而癌细胞能否与腹膜黏附是发生腹膜转移的先决条件[1,9,19-21]. TGF-β1在此过程中发挥重要作用. 先期研究已证实了胃癌患者腹腔液中TGF-β1的含量较胃良性疾病患者明显增加, 且随胃癌分期进展而增加; 腹膜纤维化程度也随胃癌分期进展而发生改变. TGF-β1可刺激腹膜间皮细胞表达Ⅲ型胶原及纤维粘连蛋白, 促进腹膜纤维化进程. Ⅲ型胶原与纤维粘连蛋白可通过细胞黏附分子即细胞膜上的糖蛋白, 与胃癌细胞发生选择性黏附, 从而促进腹膜转移发生[4-6]. 而同样作为一种细胞外基质蛋白, 由TGF-β1诱导合成的βig-h3, 现已被证实在动脉粥样硬化中的血管壁纤维化, 糖尿病肾病中的肾纤维化均发挥着重要作用[15,17-19]. 本课题组已通过体外实验证实, TGF-β1及胃癌细胞上清可促进腹膜间皮细胞表达βig-h3.
胃癌细胞侵犯浆膜或转移淋巴结被膜, 脱落入腹腔, 称之为腹膜亚临床转移. 文献报道, PLC(+)病例术后3年生存率远低于PLC(-)组[9,20-22]. 因此, 术前或术中发现腹腔游离癌细胞存在的证据, 进而采取有效的治疗手段, 对提高胃癌根治术后生存率具有重要意义[23-27]. 国内外学者一直将传统的PLC方法作为检测腹膜亚临床转移的金标准, 但部分PLC(-)病例术后仍发生腹膜转移[23,28-31]. 本组已发生肉眼腹膜转移阳性病例的PLC阳性率仅为54%, 说明传统的PLC方法尚缺乏敏感性, 存在一定比率的假阴性. 近来文献报道应用RT-PCR方法检测腹腔液中CEA mRNA的表达, 具有更高的灵敏度[21-23,31]. 因此, 本研究把CEA mRNA的检测作为腹膜转移的相关因素之一进行评价. 本研究中肉眼腹膜转移的13例病例中, 10例免疫组织化学结果呈阳性. 免疫组织化学阳性率与肿瘤浸润深度、浆膜类型、有否肉眼腹膜转移、PLC检查结果及CEA mRNA等腹膜转移相关因素密切相关, 证实βig-h3在胃癌腹膜间皮细胞中的表达可能与胃癌腹膜转移的发生相关, 并可作为预测胃癌腹膜转移发生的指标之一.
目前的研究仅仅通过免疫组织化学方法证实随胃癌病期进展, 腹膜间皮细胞中βig-h3的表达增加并与多种胃癌腹膜转移相关因素密切相关. 但其表达增加的机制及可否进一步诱导脱落癌细胞的黏附及增殖等诸多问题尚需进一步体外试验证实.
针对胃癌腹膜转移的"种子-土壤"学说受到大多数学者的认可和支持, 而对于在胃癌腹膜转移过程中, 土壤-腹膜间皮细胞的形态、结构、功能的改变, 及其影响因素正在成为胃癌腹膜转移研究新的热点和方向.
张小晋, 主任医师, 北京积水潭医院
βig-h3, 又称TGFBI, 是由TGF-β1诱导合成的细胞外基质蛋白, 参与细胞-细胞, 细胞-基质的黏附. 现已证实, βig-h3在人肝癌细胞、大肠癌细胞的高表达明显增强了其浸润和转移能力.
Ma等用免疫组织化学方法证实, βig-h3在结肠癌组织中的表达量明显高于正常肠黏膜组织, 且在转移灶中的表达量明显高于原发灶. 抑制βig-h3的表达, 可明显降低结肠癌细胞的侵袭、转移能力. 而针对βig-h3在胃癌转移, 特别是胃癌腹膜转移中的作用却未见报道.
目前大多数关于胃癌腹膜转移方面的基础研究都是从胃癌脱落细胞, 即种子的角度出发. 本课题组从土壤的角度出发, 试图从腹膜间皮细胞的形态及功能方面的改变解释胃癌腹膜转移发生的基础机制.
本研究选题较好, 试验设计合理, 得出的数据可信, 这是一篇基础与临床结合的科研论文, 对临床医生认识胃癌腹腔转移的相关因素有参考意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Bonenkamp JJ, Songun I, Hermans J, van de Velde CJ. Prognostic value of positive cytology findings from abdominal washings in patients with gastric cancer. Br J Surg. 1996;83:672-674. [PubMed] [DOI] |
| 3. | Kiyasu Y, Kaneshima S, Koga S. Morphogenesis of peritoneal metastasis in human gastric cancer. Cancer Res. 1981;41:1236-1239. [PubMed] |
| 4. | Kosaka K, Yashiro M, Sakate Y, Hirakawa K. A synergistic antitumor effect of interleukin-2 addition with CD80 immunogene therapy for peritoneal metastasis of gastric carcinoma. Dig Dis Sci. 2007;52:1946-1953. [PubMed] [DOI] |
| 5. | Imaizumi T, Aoyagi K, Miyagi M, Shirouzu K. Suppressive effect of bevacizumab on peritoneal dissemination from gastric cancer in a peritoneal metastasis model. Surg Today. 2010;40:851-857. [PubMed] [DOI] |
| 6. | Yagi Y, Fushida S, Harada S, Tsukada T, Kinoshita J, Oyama K, Fujita H, Ninomiya I, Fujimura T, Kayahara M. Biodistribution of humanized anti-VEGF monoclonal antibody/bevacizumab on peritoneal metastatic models with subcutaneous xenograft of gastric cancer in mice. Cancer Chemother Pharmacol. 2010;66:745-753. [PubMed] [DOI] |
| 7. | Takatsuki H, Komatsu S, Sano R, Takada Y, Tsuji T. Adhesion of gastric carcinoma cells to peritoneum mediated by alpha3beta1 integrin (VLA-3). Cancer Res. 2004;64:6065-6070. [PubMed] [DOI] |
| 8. | Mino K, Ozaki M, Nakanishi K, Haga S, Sato M, Kina M, Takahashi M, Takahashi N, Kataoka A, Yanagihara K. Inhibition of nuclear factor-kappaB suppresses peritoneal dissemination of gastric cancer by blocking cancer cell adhesion. Cancer Sci. 2011;102:1052-1058. [PubMed] [DOI] |
| 10. | Lv ZD, Na D, Liu FN, Du ZM, Sun Z, Li Z, Ma XY, Wang ZN, Xu HM. Induction of gastric cancer cell adhesion through transforming growth factor-beta1-mediated peritoneal fibrosis. J Exp Clin Cancer Res. 2010;29:139. [PubMed] [DOI] |
| 14. | Na D, Liu F, Miao Z, Du Z, Xu H. Destruction of gastric cancer cells to mesothelial cells by apoptosis in the early peritoneal metastasis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:163-168. [PubMed] [DOI] |
| 15. | Skonier J, Neubauer M, Madisen L, Bennett K, Plowman GD, Purchio AF. cDNA cloning and sequence analysis of beta ig-h3, a novel gene induced in a human adenocarcinoma cell line after treatment with transforming growth factor-beta. DNA Cell Biol. 1992;11:511-522. [PubMed] [DOI] |
| 16. | Jiang JL, Zhou Q, Yu MK, Ho LS, Chen ZN, Chan HC. The involvement of HAb18G/CD147 in regulation of store-operated calcium entry and metastasis of human hepatoma cells. J Biol Chem. 2001;276:46870-46877. [PubMed] [DOI] |
| 17. | Ma C, Rong Y, Radiloff DR, Datto MB, Centeno B, Bao S, Cheng AW, Lin F, Jiang S, Yeatman TJ. Extracellular matrix protein betaig-h3/TGFBI promotes metastasis of colon cancer by enhancing cell extravasation. Genes Dev. 2008;22:308-321. [PubMed] [DOI] |
| 18. | Thapa N, Lee BH, Kim IS. TGFBIp/betaig-h3 protein: a versatile matrix molecule induced by TGF-beta. Int J Biochem Cell Biol. 2007;39:2183-2194. [PubMed] [DOI] |
| 19. | Kurita N, Shimada M, Utsunomiya T, Iwata T, Nishioka M, Yoshikawa K, Miyatani T, Higashijima J, Nakao T. Predictive factors of peritoneal metastasis in gastric cancer. Hepatogastroenterology. 2010;57:980-983. [PubMed] |
| 20. | Deng J, Liang H, Wang D, Sun D, Pan Y, Liu Y. Investigation of the recurrence patterns of gastric cancer following a curative resection. Surg Today. 2011;41:210-215. [PubMed] [DOI] |
| 21. | Suzuki T, Ochiai T, Hayashi H, Nakajima K, Yasumoto A, Hishikawa E, Shimada H, Horiuchi F, Ohki S, Isono K. Importance of positive peritoneal lavage cytology findings in the stage grouping of gastric cancer. Surg Today. 1999;29:111-115. [PubMed] [DOI] |
| 22. | Bando E, Yonemura Y, Takeshita Y, Taniguchi K, Yasui T, Yoshimitsu Y, Fushida S, Fujimura T, Nishimura G, Miwa K. Intraoperative lavage for cytological examination in 1,297 patients with gastric carcinoma. Am J Surg. 1999;178:256-262. [PubMed] [DOI] |
| 23. | Ohashi N, Nakanishi H, Kodera Y, Ito S, Mochizuki Y, Koike M, Fujiwara M, Yamamura Y, Tatematsu M, Nakao A. Intraoperative quantitative detection of CEA mRNA in the peritoneal lavage of gastric cancer patients with transcription reverse-transcription concerted (TRC) method. A comparative study with real-time quantitative RT-PCR. Anticancer Res. 2007;27:2769-2777. [PubMed] |
| 24. | Fanelli MF, de Paiva TF, Silva MJ, Benevides CF, Guimarães AP, Gimenes DL, Pinheiro ED, Rinck JA, Nicolau UR, Sanches SM. Predictors of peritoneal carcinomatosis in patients with gastric cancer treated at a single institution in Brazil. J Surg Oncol. 2009;100:452-455. [PubMed] [DOI] |
| 25. | Glehen O, Mithieux F, Osinsky D, Beaujard AC, Freyer G, Guertsch P, Francois Y, Peyrat P, Panteix G, Vignal J. Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study. J Clin Oncol. 2003;21:799-806. [PubMed] [DOI] |
| 26. | Than SS, Kataoka K, Sakaguchi M, Murata H, Abarzua F, Taketa C, Du G, Yashiro M, Yanagihara K, Nasu Y. Intraperitoneal administration of an adenovirus vector carrying REIC/Dkk-3 suppresses peritoneal dissemination of scirrhous gastric carcinoma. Oncol Rep. 2011;25:989-995. [PubMed] |
| 27. | Kawaguchi K, Etoh T, Suzuki K, Mitui MT, Nishizono A, Shiraishi N, Kitano S. Efficacy of oncolytic reovirus against human gastric cancer with peritoneal metastasis in experimental animal model. Int J Oncol. 2010;37:1433-1438. [PubMed] [DOI] |
| 28. | González-Moreno S. Peritoneal Surface Oncology: A progress report. Eur J Surg Oncol. 2006;32:593-596. [PubMed] [DOI] |
| 29. | Glehen O, Schreiber V, Cotte E, Sayag-Beaujard AC, Osinsky D, Freyer G, François Y, Vignal J, Gilly FN. Cytoreductive surgery and intraperitoneal chemohyperthermia for peritoneal carcinomatosis arising from gastric cancer. Arch Surg. 2004;139:20-26. [PubMed] [DOI] |
| 30. | Li C, Yan M, Chen J, Xiang M, Zhu ZG, Yin HR, Lin YZ. Surgical resection with hyperthermic intraperitoneal chemotherapy for gastric cancer patients with peritoneal dissemination. J Surg Oncol. 2010;102:361-365. [PubMed] [DOI] |
| 31. | Wang JY, Lin SR, Lu CY, Chen CC, Wu DC, Chai CY, Chen FM, Hsieh JS, Huang TJ. Gastric cancer cell detection in peritoneal lavage: RT-PCR for carcinoembryonic antigen transcripts versus the combined cytology with peritoneal carcinoembryonic antigen levels. Cancer Lett. 2005;223:129-135. [PubMed] [DOI] |