修回日期: 2012-03-30
接受日期: 2012-04-19
在线出版日期: 2012-06-08
目的: 探讨抵抗素(resistin)在非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)中对胰岛素抵抗(insulin resistin, IR)及肝纤维化的作用.
方法: 应用高脂饮食喂养Wistar大鼠建立NAFLD肝纤维化模型. 健康♂, Wistar大鼠30只, 随机分成正常对照组和模型组, 各15只, 分别给予普通饲料和高脂饲料喂养. 分别于第15、18、21周末将对照组和模型组随机各处理5只. 检测空腹血糖(FBG)、空腹胰岛素(FINS)、Ⅲ型前胶原(PC Ⅲ)、透明质酸(HA)、Ⅳ型胶原(C Ⅳ)、层粘蛋白(LN)水平, 采用稳态模型评估法(HOMA)评估IR(HOMA-IR); HE、VG染色及电镜观察肝组织纤维化情况. RT-PCR法检测大鼠肝组织中resistin基因mRNA表达.
结果: 随着高脂喂养时间的延长, HE、VG染色及电镜观察肝组织病理学显示大鼠肝脏脂肪变性及肝纤维化程度逐渐加重, NAFLD模型组HOMA-IR、PC Ⅲ、LN、C Ⅳ、HA、resistin逐渐增加, 且以21 wk时升高最为明显, 分别为33.74 μg/L±10.41 μg/L、2.96 μg/L±0.76 μg/L、4.14 μg/L±1.07 μg/L、19.07 μg/L±2.78 μg/L、848.87 μg/L±204.04 μg/L、
0.99 μg/L±0.10 μg/L, 与相应时相对照组比较差异具有统计学意义(P<0.05或P<0.01). Spearman相关性分析抵抗素与HOMA-IR、PC Ⅲ、LN、C Ⅳ、HA呈显著正相关, 相关系数r分别为0.77、0.80、0.68、0.67、0.76(P<0.05或P<0.01).
结论: 在NAFLD纤维化形成过程中, 抵抗素表达升高诱导IR并促使肝纤维化的形成与进展.
引文著录: 祁明美, 管小琴, 朱良荣, 杨云鹏. 抵抗素在非酒精性脂肪肝病中对胰岛素抵抗和肝纤维化的作用. 世界华人消化杂志 2012; 20(16): 1383-1388
Revised: March 30, 2012
Accepted: April 19, 2012
Published online: June 8, 2012
AIM: To investigate the role of resistin in the development of insulin resistin (IR) and hepatic fibrosis in nonalcoholic fatty liver disease (NAFLD).
METHODS: Thirty male Wistar rats were randomly divided into control group (n = 15) and model group (n = 15). The control group was fed a normal diet, while the model group was given a high fat diet to induce NAFLD. Five rats in each group were killed at 15, 18 and 21 wk. Serum levels of FBG, FINS, type Ⅲ procollagen (PC Ⅲ), hyaluronic acid (HA), type Ⅳ collagen (C Ⅳ) and laminin (LN) were measured. Insulin resistance was calculated by homeostasis model assessment (HOMA-IR). Liver tissue samples were collected and the degree of hepatic fibrosis was graded by hematoxylin-eosin (HE) staining, VG staining and electron microscopy. RT-PCR was used to determine the expression level of resistin mRNA.
RESULTS: The degree of hepatic fibrosis increased with the time of feeding the high fat diet. Compared to the control group, the levels of HOMA-IR, PC Ⅲ, LN, C Ⅳ, HA and resistin significantly increased, which was particularly prominent at week 21 (33.74 μg/L ± 10.41 μg/L, 2.96 μg/L ± 0.76 μg/L, 4.14 μg/L ± 1.07 μg/L, 19.07 μg/L ± 2.78 μg/L, 848.87 μg/L ± 204.04 μg/L, 0.99 μg/L ± 0.10 μg/L, all P < 0.05 or 0.01). Resistin expression was positively correlated with the levels of HOMA-IR, PCIII, LN, C Ⅳ, and HA (r = 0.77, 0.80, 0.68, 0.67, 0.76, all P < 0.05 or 0.01).
CONCLUSION: Resistin may induce IR and promote the formation of hepatic fibrosis in NAFLD.
- Citation: Qi MM, Guan XQ, Zhu LR, Yang YP. Role of resistin in the development of insulin resistance and hepatic fibrosis in nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1383-1388
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1383.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1383
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是由遗传-环境-代谢等多种原因引起的一组临床病理综合征, 其病理过程包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、脂肪性肝硬化. 其中NASH是NAFLD进展的重要中间阶段, 也是隐源性肝硬化的重要病因. NASH以脂肪变性、炎症和纤维化为主要病理特征[1]. NASH患者中有20%-40%后期可进展为肝硬化[2]. 肝纤维化是一种由多种损伤因素引起肝脏反复出现损伤-愈合反应[3], 在治疗后病情可稳定或在一定程度上可逆转, 但当继续发展即可导致不可逆转的肝硬化甚至肝癌[4], 因此, 在肝纤维化形成阶段及时阻断肝脏病理进展具有十分重要的意义. 抵抗素是近年新发现的一种脂肪细胞因子[5]. 大量研究认为抵抗素主要由脂肪细胞分泌, 但Szalowska等[6]发现抵抗素在肝脏组织的表达大于脂肪组织. 目前, 抵抗素在NAFLD中与胰岛素抵抗(insulin resistin, IR)及肝纤维化的关系尚不明确. 大部分学者认为IR参与NAFLD发生发展的整个过程, 但有研究认为抵抗素和IR不存在明显的相关性[7]. 本实验就抵抗素在NAFLD发生发展中与IR及肝纤维化的作用进行探讨.
清洁级健康♂Wistar大鼠30只, 体质量为200 g±20 g(由重庆医科大学实验动物中心提供). 实验动物饲养于重庆医科大学实验动物中心. 基础饲料适应性饲养1 wk后随机分为对照组(15只)和模型组(15只), 分笼饲养. 对照组给予基础饲料, 模型组给予改良高脂饲料(基础饲料82.3%+猪油10%+蔗糖5%+胆固醇2%+胆酸钠0.5%+丙硫氧嘧啶0.2%)[8]. 根据本课题前期实验得知, 15 wk时大鼠出现纤维化征象, 故本实验选择15 wk末进行NAFLD肝纤维化的模型处理和研究.
1.2.1 血生化检测: 各组大鼠处理前禁食12 h, 称体质量后用3.5%水合氯醛按1 mL/100 g腹腔麻醉, 摘取眼球取血. 利用血糖仪测定空腹血糖(FBG). 剩余血液3 000 r/min低温离心15 min, 收集血清, -80 ℃冰箱保存备用. ELISA法测定空腹胰岛素(FINS), 采用稳态模式胰岛素抵抗指数(HOMA-IR)评价IR[HOMA-IR = (FBG×FINS)/22.5]. ELISA试剂盒检测各实验组血清中肝纤维化谱Ⅲ型前胶原(type Ⅲ procollagen, PC Ⅲ)、透明质酸(hyaluronic acid, HA)、Ⅳ型胶原(type Ⅳ collagen, C Ⅳ)、层粘蛋白(laminin, LN)水平, 按照试剂盒说明书操作.
1.2.2 肝组织病理学观察: 麻醉采血后, 迅速剖腹取出肝脏, 肉眼观察大鼠肝脏大体形态, 取出完整肝脏. 均取各只大鼠肝右叶中部肝组织(约1 cm×1 cm×0.3 cm大小), 甲醛固定, 利用HE和VG染色法, 光镜下观察大鼠肝脏纤维化情况. 另均取各只大鼠肝左叶相同部位肝组织(约0.3 cm×0.3 cm×0.3 cm大小, 3枚), 戊二醛固定, 电镜观察肝组织中胶原纤维形成情况. 剩余肝组织迅速放入-80 ℃冰箱保存备用.
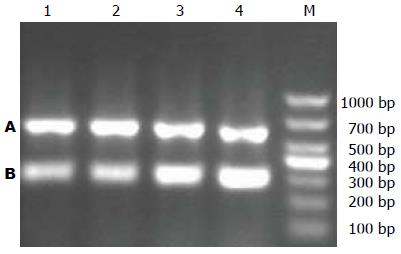
1.2.3 大鼠肝组织中resistin基因mRNA转录水平检测: 按照TRIzol一步法提取肝组织总RNA, 电泳分析RNA完整性, 分光光度计测得总RNA的A260/A280的值均在1.8-2.0之间. 定量总RNA后, 按照TaKaRa RT-PCR试剂盒说明进行逆转录. 抵抗素和内参照β-actin的引物由成都天泰生物技术有限公司设计合成. 引物序列如下resistin: 上游引物5'-AGCAGCTAGTGACGGTTGTGCC-3',下游引物5'-ATGCCCAGAACCGAGTTGTGCC-3', 扩增片段长度282 bp; β-actin上游引物: 5'-CCTGAAGTACCCCATTGAACAC-3', 下游引物5'-CTCATTGCCGATAGTGATGACC-3', 扩增片段长度562 bp. resistin基因PCR反应条件: 94 ℃预变性3 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸1 min, 共30个循环; 72 ℃再延伸5 min. β-actin基因PCR反应条件: 94 ℃预变性3 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸1 min, 共30个循环; 72 ℃再延伸5 min. 扩增产物经1.5%琼脂糖凝胶电泳(电压100 V, 20 min), 用Quantity One软件成像及定量分析, 以各目的基因与内参基因条带灰度值相比较得到其相对表达量.
统计学处理 采用SPSS18.0统计软件进行统计学分析, 数据以mean±SD表示, 用Spearman分析抵抗素与FBG、FINS、HOMA-IR、PC Ⅲ、HA、C Ⅳ及LN的相关性. P<0.05表示差异具有统计学意义.
正常对照组大鼠生活状态良好, NAFLD模型组大鼠毛发粗糙、嗜睡、精神萎靡、动作迟缓. 剖腹见正常对照组大鼠肝脏表面光滑、质软、色泽红亮(图1A). 各时间段NAFLD模型组大鼠肝脏表面光泽差、粗糙、肝脏肿大、包膜紧张, 边缘圆钝, 切面油腻感, 质地略韧, 且以21 wk NAFLD模型组表现最为严重(图1B).
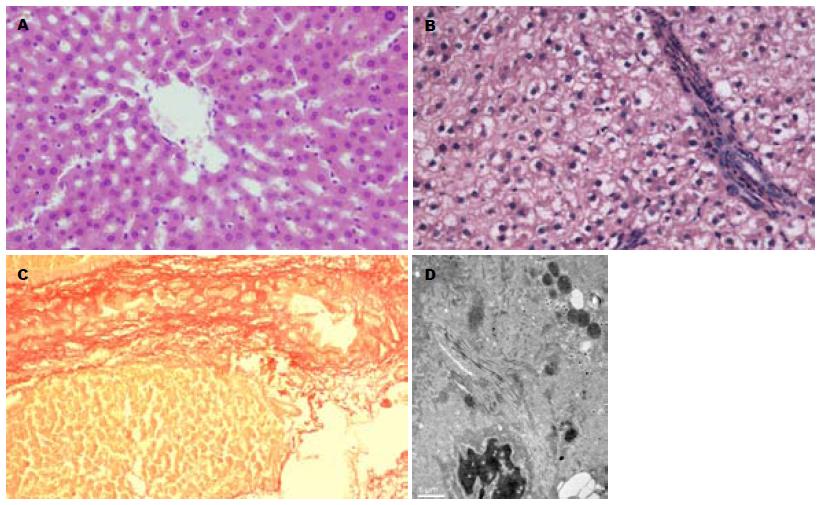
可见15-18 wk NAFLD模型组大鼠肝组织轻度到中度脂肪变性、水样变及点状坏死, 汇管区可见炎症细胞浸润. 21 wk NAFLD模型组大鼠肝细胞以大泡性脂肪变为主, 胞核被挤至细胞一侧; 纤维增生致汇管区扩张伴局部纤维条索形成(图2A-C). 电镜观察见肝细胞狄氏间隙内大量胶原纤维形成(图2D).
与对照组比较, FBG、FINS、 HOMA-IR、PC Ⅲ、HA、C Ⅳ、LN各生化指标随着高脂喂养大鼠时间的延长而逐步升高, 并且在21 wk时各指标升高最为显著. 各时相模型组与对应对照组比较差异有统计学意义(P<0.05或P<0.01, 表1, 2).
| 分组 | PC Ⅲ | LN | C IV | HA |
| 15 wk | ||||
| 对照组 | 0.54±0.23 | 0.74±0.32 | 4.00±0.99 | 99.44±10.21 |
| NAFLD模型组 | 1.01±0.21a | 2.03±0.58a | 12.02±3.32a | 237.47±50.77a |
| 18 wk | ||||
| 对照组 | 0.66±0.37 | 0.66±0.18 | 4.41±1.76 | 94.33±7.79 |
| NAFLD模型组 | 1.60±0.37a | 3.05±0.64a | 13.02±2.78a | 499.49±126.05b |
| 21 wk | ||||
| 对照组 | 0.52±0.20 | 0.79±0.25 | 4.36±1.81 | 106.53±10.20 |
| NAFLD模型组 | 2.96±0.76a | 4.14±1.07b | 19.07±2.78a | 848.87±204.04b |
RT-PCR扩增产物电泳结果显示(图3): 与对照组比较, 各时相模型组大鼠肝组织中基因resistin mRNA转录水平逐渐升高, 15 wk、18 wk、21 wk的NAFLD模型组的相对表达量依次为: 0.48±0.09、0.65±0.23、0.87±0.11、0.99±0.10. 以21 wk升高最为明显, 与对照组比较, 差异具有统计学意义(P<0.05).
NAFLD的发病机制非常复杂, 目前尚无统一的理论解释, 最为被接受的是Day等[9]提出的"二次打击"学说, 并认为IR是NAFLD发病机制的中心环节, IR不仅是NAFLD的触发因素[10,11], 而且也是NAFLD发生发展的重要危险因子, 参与NAFLD发生发展的整个过程. 2002年美国肝脏病学会NASH专题研讨会认为NAFLD是代谢综合征(metabolic syndrome, MS)在肝脏的表现[12], NAFLD病例多伴有肥胖和脂质代谢紊乱. 研究表明NAFLD患者的肝纤维化程度与腹部脂肪组织含量密切相关[13], 脂肪组织不仅参与能量代谢, 而且具有活跃的内分泌功能, 能分泌抵抗素等多种脂肪细胞因子, 通过门静脉运输到达肝脏, 在肝脏组织中发挥作用[14,15]. 目前关于抵抗素对NAFLD肝纤维化进展的影响及可能机制研究甚少[16]. 本实验就抵抗素与IR及NAFLD肝纤维化的影响进行了研究.
在发病背景、病因、发病机制等方面, 高脂饮食诱导的NAFLD的大鼠模型同人类NAFLD自然发病过程更为相似[17], 高脂喂养是目前模拟NAFLD体内模型的常用方法, 即在基础饲料的基础上添加猪油、蔗糖、胆固醇、胆酸钠和丙硫氧嘧啶, 其中胆酸钠可乳化脂肪, 促进脂肪吸收[18], 丙基硫氧嘧啶可抑制胆固醇分解, 增加脂质在肝组织中沉积[19]. 脂质在肝脏聚集, 对肝脏形成慢性损伤, 肝细胞发生炎症或者坏死, 肝脏中以胶原为主的细胞外基质(extracellular matrix, ECM)在肝内合成与分解失衡而过度沉积, 肝脏内纤维结缔组织异常增生和沉积, 形成肝纤维化.
肝组织HE染色和VG染色显示, 随着高脂喂养时间的延长, 肝细胞脂变加重肝组织内纤维条索逐渐形成, 电镜显示肝细胞狄氏间隙内胶原沉积随之加重, 以21 wk最为明显. 血清纤维化谱PC Ⅲ、HA、C Ⅳ、LN是反映ECM代谢的血清学指标, 与肝纤维化活动程度呈现正相关. 我们的实验结果显示血清学肝纤维化谱各指标亦随着喂养高脂喂养时间延长而升高, 即在NAFLD发生发展过程中出现了肝纤维化, 并且纤维化逐渐加重.
我们的研究经相关性分析提示, 抵抗素水平与空腹血糖、胰岛素及IR呈显著正相关, 即抵抗素与IR密切相关. Macías-Rodríguez等[20]认为IR与肝纤维化程度密切有关, 并且能加快纤维化转化为肝硬化的进程. 其可能机制为抵抗素可通过IRS-1/Akt的途径降低葡萄糖转运蛋白4(GLUT4)的转运功能, 继而影响糖的摄取[21]; 抵抗素还可通过调节腺苷酸活化蛋白激酶(Amp activated protein kinase, AMPK)的活性来调节糖脂代谢, 并促进肿瘤坏死因子α(tumor necrosis factor α, TNF-α)等一系列炎症因子的合成与释放, 进而阻碍胰岛素信号传导通路导致高胰岛素血症及IR的发生[22]. 另有研究发现抵抗素还可通过下丘脑调节机制参与IR的发生发展[23].
随着高脂喂养大鼠时间的延长, 肝纤维化各指标升高, 抵抗素在肝组织中的表达逐渐增加, 并且用Spearman相关分析得知抵抗素与PC Ⅲ、HA、C Ⅳ及LN呈显著正相关(相关系数r分别为0.8、0.76、0.67、0.68), 提示抵抗素的表达与NAFLD肝纤维化进展密切相关. 赵彩彦等[24]研究结果表明抵抗素在肝组织主要表达于肝窦周围细胞, 其表达区域与α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)基本一致, 而α-SMA主要表达于活化的肝星状细胞(hepatic stellate cell, HSC), 故推测HSC可能是抵抗素在肝窦周围表达的主要细胞. HSC在肝纤维化进展过程中起核心作用, HSC的激活、增殖及产生大量ECM是促使肝纤维化形成的关键[25]. 抵抗素导致肝纤维化的可能机制为抵抗素通过对HSC中细胞外信号调节激酶(extracellular signal regulated kinase, ERK)通路激活NF-κB通路, 增加炎症因子如TNF-α等的产生[26,27], 大量炎症因子产生内毒素, 诱导免疫系统激活, 促进肝脏炎症和纤维化的发生发展[28]. TNF-α是介导肝组织炎症损伤的主要因子, 也是一种作用强烈的促有丝分裂原, 可活化细胞外信号调节激酶ERK和JNK通路, 加强组织转谷氨酰胺酶(tTG)基因的表达, 其中tTG是肝纤维形成的重要级联放大因子[29], 促进HSC产生ECM. TNF-α还可刺激HSC表达基质金属蛋白酶抑制剂, 减少ECM的降解[30]. 实验证实抵抗素可促进Kupffer细胞分泌转化生长因子β1(transforming growth factor β1, TGF-β1)[31,32]. TGF-β1是目前被认为促肝纤维化最重要的细胞因子之一, 其通过旁分泌、自分泌调控方式激活HSC, 使合成ECM增加, ECM 降解减少, 导致ECM在肝脏组织内大量沉积, 最终促使肝组织纤维化发生发展.
总之, 抵抗素与IR及肝纤维化密切相关, 并且可能通过诱导IR促进NAFLD肝纤维化的发生发展. 因此, 控制抵抗素的表达上调或者中断抵抗素的作用通路可成为阻断或者治疗NAFLD肝纤维进展的新思路. 但是由于目前尚未发现抵抗素相关的作用受体, 故其信号转导通路及其在IR和肝纤维化进展中的具体作用机制尚待进一步的探明研究.
在我国, 非酒精性脂肪肝病(NAFLD)已成为仅次于病毒性肝炎的第2大肝脏疾病. 肝纤维化作为NAFLD发展过程中的重要阶段, 在治疗后病情可稳定或在一定程度上可逆转, 但继续发展即可导致不可逆转的肝硬化甚至肝癌.
徐庆, 教授, 桂林医学院药理教研室
抵抗素是近年新发现的一种脂肪源性细胞因子. 大量研究认为抵抗素主要由脂肪细胞分泌, 但存在争议, 有研究发现抵抗素在肝脏组织的表达大于脂肪组织.
Macías-Rodríguez等认为胰岛素抵抗(IR)与肝纤维化程度密切有关, 并且能加快纤维化转化为肝硬化的进程, 其可能机制为抵抗素可通过IRS-1/Akt的途径降低葡萄糖转运蛋白4(GLUT4)的转运功能, 继而影响糖的摄取.
高脂饮食诱导的NAFLD的大鼠模型在发病背景、病因、发病机制等方面同人类NAFLD自然发病过程相似. 利用血清纤维化谱、电镜和光镜观察肝组织形态学对大鼠NAFLD模型建立进行综合评价.
本研究的实验结果提示: 抵抗素与IR及肝纤维化密切相关, 因此中断抵抗素的作用通路可成为预防和治疗NAFLD肝纤维进展的新思路, 为肝纤维化的治疗提供理论依据.
本研究设计合理, 数据可靠, 结论可信, 具有一定的创新性.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Lanthier N, Horsmans Y, Leclercq IA. The metabolic syndrome: how it may influence hepatic stellate cell activation and hepatic fibrosis. Curr Opin Clin Nutr Metab Care. 2009;12:404-411. [PubMed] [DOI] |
| 2. | Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, Donnini D, Faggian D, Mussap M, Plebani M. Increased serum resistin in nonalcoholic fatty liver disease is related to liver disease severity and not to insulin resistance. J Clin Endocrinol Metab. 2006;91:1081-1086. [PubMed] [DOI] |
| 3. | Bataller R, Schwabe RF, Choi YH, Yang L, Paik YH, Lindquist J, Qian T, Schoonhoven R, Hagedorn CH, Lemasters JJ. NADPH oxidase signal transduces angiotensin II in hepatic stellate cells and is critical in hepatic fibrosis. J Clin Invest. 2003;112:1383-1394. [PubMed] |
| 4. | Castera L. Non-invasive diagnosis of steatosis and fibrosis. Diabetes Metab. 2008;34:674-679. [PubMed] [DOI] |
| 5. | Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerjee RR, Wright CM, Patel HR, Ahima RS, Lazar MA. The hormone resistin links obesity to diabetes. Nature. 2001;409:307-312. [PubMed] [DOI] |
| 6. | Szalowska E, Elferink MG, Hoek A, Groothuis GM, Vonk RJ. Resistin is more abundant in liver than adipose tissue and is not up-regulated by lipopolysaccharide. J Clin Endocrinol Metab. 2009;94:3051-3057. [PubMed] [DOI] |
| 7. | Cho YK, Lee WY, Oh SY, Park JH, Kim HJ, Park DI, Sohn CI, Jeon WK, Kim BI, Kim SW. Factors affecting the serum levels of adipokines in Korean male patients with nonalcoholic fatty liver disease. Hepatogastroenterology. 2007;54:1512-1516. [PubMed] |
| 9. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 10. | Bugianesi E, Manzini P, D'Antico S, Vanni E, Longo F, Leone N, Massarenti P, Piga A, Marchesini G, Rizzetto M. Relative contribution of iron burden, HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty liver. Hepatology. 2004;39:179-187. [PubMed] [DOI] |
| 11. | Clark JM. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin Gastroenterol. 2006;40 Suppl 1:S5-S10. [PubMed] |
| 12. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis; summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 13. | van der Poorten D, Milner KL, Hui J, Hodge A, Trenell MI, Kench JG, London R, Peduto T, Chisholm DJ, George J. Visceral fat: a key mediator of steatohepatitis in metabolic liver disease. Hepatology. 2008;48:449-457. [PubMed] [DOI] |
| 14. | Wozniak SE, Gee LL, Wachtel MS, Frezza EE. Adipose tissue: the new endocrine organ? A review article. Dig Dis Sci. 2009;54:1847-1856. [PubMed] [DOI] |
| 15. | Marra F, Bertolani C. Adipokines in liver diseases. Hepatology. 2009;50:957-969. [PubMed] [DOI] |
| 17. | 孙 林林, 石 军, 郝 菁华, 任 万华, 阎 春英, 张 捷, 林 晓燕, 崔 彬. 高脂饮食致大鼠非酒精性脂肪性肝炎肝纤维化模型的建立. 临床肝胆病杂志. 2011;27:254-257. |
| 20. | Macías-Rodríguez RU, Torre A. [Pathophysiology of non-alcoholic steatohepatitis. An insulin resistance overview]. Rev Invest Clin. 2009;61:161-172. [PubMed] |
| 21. | Song H, Shojima N, Sakoda H, Ogihara T, Fujishiro M, Katagiri H, Anai M, Onishi Y, Ono H, Inukai K. Resistin is regulated by C/EBPs, PPARs, and signal-transducing molecules. Biochem Biophys Res Commun. 2002;299:291-298. [PubMed] [DOI] |
| 22. | Zhou L, Li Y, Xia T, Feng S, Chen X, Yang Z. Resistin overexpression impaired glucose tolerance in hepatocytes. Eur Cytokine Netw. 2006;17:189-195. [PubMed] |
| 23. | Muse ED, Lam TK, Scherer PE, Rossetti L. Hypothalamic resistin induces hepatic insulin resistance. J Clin Invest. 2007;117:1670-1678. [PubMed] [DOI] |
| 25. | Shibata N, Watanabe T, Okitsu T, Sakaguchi M, Takesue M, Kunieda T, Omoto K, Yamamoto S, Tanaka N, Kobayashi N. Establishment of an immortalized human hepatic stellate cell line to develop antifibrotic therapies. Cell Transplant. 2003;12:499-507. [PubMed] |
| 26. | Silswal N, Singh AK, Aruna B, Mukhopadhyay S, Ghosh S, Ehtesham NZ. Human resistin stimulates the pro-inflammatory cytokines TNF-alpha and IL-12 in macrophages by NF-kappaB-dependent pathway. Biochem Biophys Res Commun. 2005;334:1092-1101. [PubMed] [DOI] |
| 27. | Bertolani C, Sancho-Bru P, Failli P, Bataller R, Aleffi S, DeFranco R, Mazzinghi B, Romagnani P, Milani S, Ginés P. Resistin as an intrahepatic cytokine: overexpression during chronic injury and induction of proinflammatory actions in hepatic stellate cells. Am J Pathol. 2006;169:2042-2053. [PubMed] [DOI] |
| 29. | Chen MH, Chen SH, Wang QF, Chen JC, Chang DC, Hsu SL, Chen CH, Sheue CR, Liu YW. The molecular mechanism of gypenosides-induced G1 growth arrest of rat hepatic stellate cells. J Ethnopharmacol. 2008;117:309-317. [PubMed] [DOI] |
| 30. | Iredale J. Defining therapeutic targets for liver fibrosis: exploiting the biology of inflammation and repair. Pharmacol Res. 2008;58:129-136. [PubMed] [DOI] |
| 31. | Zhao C, Chen W, Yang L, Chen L, Stimpson SA, Diehl AM. PPARgamma agonists prevent TGFbeta1/Smad3-signaling in human hepatic stellate cells. Biochem Biophys Res Commun. 2006;350:385-391. [PubMed] [DOI] |