修回日期: 2012-03-13
接受日期: 2012-04-25
在线出版日期: 2012-05-28
目的: 检测过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)在炎症性肠病(inflammatory bowel disease, IBD)患者肠黏膜的表达水平, 探讨其在IBD患者肠黏膜组织中的作用.
方法: 收集15例溃疡性结肠炎(Ulcerative colitis, UC)患者、17例克罗恩病(Crohn's disease, CD)患者炎性肠黏膜活检标本及14例正常对照者内镜肠黏膜标本, 采用免疫组织化学染色技术分析PGC-1α蛋白在肠黏膜中的原位表达, 荧光定量PCR技术检测肠黏膜内PGC-1α mRNA的表达水平.
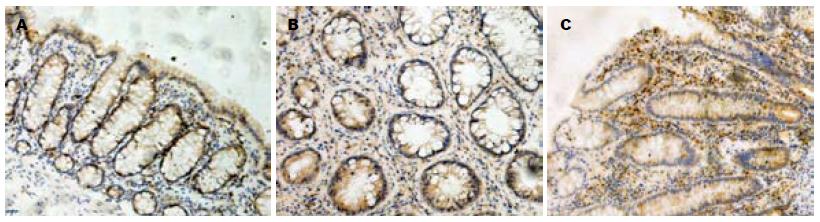
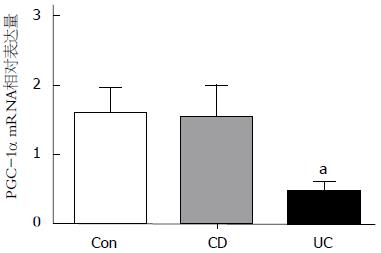
结果: 免疫组织化学分析显示: PGC-1α蛋白在正常肠黏膜上皮细胞内表达较多, 黏膜固有层细胞内表达较少. 与正常对照组相比, PGC-1α蛋白在UC患者肠黏膜上皮细胞内表达量明显减少, 而肠黏膜固有层细胞内表达增加, PGC-1α蛋白在CD患者肠黏膜组织内表达量无明显差异. 荧光定量PCR分析显示: UC患者炎症肠黏膜组织内PGC-1α mRNA表达水平显著低于正常对照组(0.48±0.15 vs 1.59±0.38, P<0.05), CD患者炎症肠黏膜组织内PGC-1α mRNA表达水平与正常对照组相比差异无统计学意义(1.55 ± 0.47 vs 1.59±0.38, P>0.05).
结论: 与正常对照组相比, PGC-1α在UC炎症肠黏膜组织内表达水平降低, 而在CD炎症肠黏膜中表达无明显差异, 提示PGC-1α可能参与了UC发生发展过程.
引文著录: 陈腾飞, 邬瑞金, 刘嫦钦, 刘占举. PGC-1α在炎症性肠病肠黏膜组织中的表达及临床意义. 世界华人消化杂志 2012; 20(15): 1366-1370
Revised: March 13, 2012
Accepted: April 25, 2012
Published online: May 28, 2012
AIM: To investigate the expression of peroxisome proliferator-activated receptor γ coactivator (PGC) 1α in the inflamed mucosa of patients with inflammatory bowel disease (IBD).
METHODS: Inflamed colonic mucosal biopsies were collected from 15 patients with ulcerative colitis (UC), 17 patients with Crohn's disease (CD) and 14 healthy subjects. Expression of PGC-1α mRNA and protein in the intestinal mucosa was detected by real-time PCR and immunohistochemistry, respectively.
RESULTS: Immunohistochemical analysis revealed that PGC-1α was mainly expressed in intestinal epithelial cells in healthy mucosa and lowly expressed in lamina propria mononuclear cells. The positive rate of PGC-1α protein expression in the intestinal mucosa of UC patients was significantly lower than that in healthy controls (P < 0.05), but no significant difference was found between CD patients and healthy controls (P > 0.05). Compared to healthy controls, the levels of PGC-1α mRNA were significantly decreased in the inflamed mucosa of UC patients (0.48 ± 0.15 vs 1.59 ± 0.38, P < 0.05), but not in CD patients.
CONCLUSION: Aberrant expression of PGC-1α may play an important role in the pathogenesis of UC. The induction of biological effect of PGC-1α may have a therapeutic role in the treatment of UC.
- Citation: Chen TF, Wu RJ, Liu CQ, Liu ZJ. Clinical significance of expression of peroxisome proliferator-activated receptor γ coactivator 1α in the inflamed mucosa of patients with inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1366-1370
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1366.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1366
炎症性肠病(inflammatory bowel disease, IBD)是一组病因不明的肠道非特异性疾病, 包括克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(Ulcerative colitis, UC). 目前大多数学者认为IBD的病因可能与遗传易感人群在持续肠道感染、肠黏膜屏障缺陷和环境改变等多因素作用下引起的肠道免疫系统异常反应有关[1,2]. 肠黏膜微生态环境作为肠黏膜屏障的重要组成部分, 在IBD的发生发展过程中起着十分重要的作用. 过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator 1α, PGC-1α)是一种核受体家族转录辅助激活因子, 其特殊的氨基酸结构序列可与过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)、核呼吸因子(nuclear respiratory factor, NRF)、线粒体转录因子(mitochondrial DNA, mtTFA)、雌激素受体(estrogen receptor α, ERα)等多种转录因子相互作用, 通过不同机制增强靶基因的转录效率, 广泛参与调节组织细胞的能量生成与利用过程[3]. 目前PGC-1α在IBD的发病机制中的作用尚不清楚. 本研究通过分析PGC-1α在IBD患者肠黏膜中的表达, 初步探讨其在IBD发病机制中的作用.
结肠黏膜标本收集2011-03/10同济大学附属第十人民医院胃肠内科行肠镜检查的29例活动期IBD患者, 其中UC 15例, 男7例, 女8例, 年龄23-63岁(平均39.27岁); CD 17例, 男7例, 女10例, 年龄19-45岁(平均35.48岁), 对照组为同期14例结肠镜检查无异常发现的健康体检者, 其中男7例, 女7例, 年龄25-59岁(平均41.2岁). UC及CD患者性别、年龄组成与健康对照组间差异无统计学意义. 所有患者及正常对照者标本留取前均签署知情同意书. 入组患者诊断标准符合2007年中华医学会消化病学分会炎症性肠病协作组"对我国炎症性肠病诊断治疗规范的共识意见"[4], 入组前1 mo均未使用水杨酸制剂、糖皮质激素、免疫抑制剂及生物制剂等.
兔抗人PGC-1α多克隆抗体购自Abcam公司; 羊抗兔IgG二抗购自武汉博士德生物工程有限公司; Real Envision二抗检测系统(广谱)购自上海基因科技有限公司; TRIzol Reagent购自美国Invitrogen公司; RT-reagent逆转录试剂盒和SYBR Premix Ex Taq荧光定量试剂购自大连TaKaRa公司; PGC-1α和内参β-actin引物为自行设计, 由上海捷瑞生物工程有限公司合成. PGC-1α上游: TCCTCACAGAGACACTAGACAG, 下游: CTGGTGCCAGTAAGAGCTTCT, 扩增长度为183 bp; 内参β-actin上游: GTGAAGGTGACAGCAGTCGGT, 下游: AGAAGTGGGGTGGCTTTTAGGA, 扩增长度为150 bp.
1.2.1 免疫组织化学染色: 根据参考文献[5,6]的方法, 每位IBD患者及对照者取内镜活检标本4块, 4%甲醛溶液固定、脱水、透明后石蜡包埋. 全部石蜡标本行5 μm连续切片, 常规脱蜡、水化, 室温下3%甲醇过氧化氢溶液孵育30 min抑制内源性过氧化物酶的活性, 0.2% Triton X-100破核, 高压热修复, 山羊血清封闭, 滴加兔抗人PGC-1α多克隆抗体(1:100)后4 ℃过夜, 同时以PBS代替一抗做空白对照, 滴加羊抗兔IgG二抗(1:200)后于37 ℃孵育30 min, DAB显色, 苏木素核复染, 中性树胶封片, 镜检, 胞质染色呈棕黄色为阳性细胞.
1.2.2 荧光定量PCR测定: 将收集的肠黏膜内镜标本放入-80 ℃冰箱保存待检, 提取总RNA时将标本置入装有液氮的研钵内充分研磨. 按照TRIzol reagent操作说明书提取总RNA, 并测定所提取RNA的浓度、纯度及完整性. 按照TaKaRa公司RT-reagent逆转录试剂盒说明书进行逆转录反应, 反应条件: 37 ℃ 15 min, 85 ℃ 5 s. 按TaKaRa公司SYBR Premix Ex Taq荧光定量试剂说明书进行荧光定量PCR反应, 取1 μL cDNA加入10 μL反应体系进行扩增, 扩增条件: 95 ℃ 1 min; 95 ℃ 15 s, 60 ℃ 30 s, 共40个循环. 数据处理采用2-∆∆Ct法进行相对定量分析, 具体步骤参照既往文献[7,8].
统计学处理 应用统计学软件SPSS17.0进行统计学分析, 计量资料采用mean±SD的形式表示, 两样本均数比较采用不配对t检验, 以P<0.05为具有统计学差异.
免疫组织化学染色显示, PGC-1α阳性细胞主要分布在正常肠黏膜上皮细胞内, 胞内见棕黄色颗粒, 黏膜固有层细胞内表达较少. 与健康对照组相比, UC患者肠黏膜上皮PGC-1α蛋白表达量明显减少, 肠黏膜固有层内表达增加, CD患者肠黏膜上皮中表达PGC-1α蛋白的细胞无明显差异(图1).
荧光定量PCR分析显示, IL-25 mRNA在UC、CD患者及对照者的结肠黏膜中均有表达, PGC-1α mRNA在UC患者炎症肠黏膜组织中的相对表达量显著低于对照组(0.48±0.15 vs 1.59±0.38, P<0.05), PGC-1α mRNA在CD患者炎症肠黏膜组织中的相对表达量与对照组相比差异无统计学意义(1.55±0.47 vs 1.59±0.38, P>0.05, 图2).
炎症性肠病的发病机制至今仍不完全清楚, 目前大多数学者认为: 在众多外在、内在因素(肠道微生态环境及肠上皮细胞代谢紊乱等)的共同作用下, 肠黏膜组织炎症因子、细胞因子、氧自由基等不断释放、堆积, 最终导致肠道免疫功能失衡(包括细胞免疫、体液免疫及其他非特异性免疫)[1,2]. 其中, 肠黏膜微生态环境的失衡, 尤其是肠黏膜组织内能量代谢失衡、抗氧化屏障减弱, 在IBD的发生发展过程中的作用不可忽视. 正常生理条件下, 肠绒毛顶端的上皮细胞比肠黏膜隐窝细胞的增殖活力和能量代谢都较弱, 因而暴露于肠腔外环境的上皮细胞更易发生凋亡[9]. IBD发病时, 大量的肠黏膜上皮细胞发生凋亡, 与凋亡细胞相邻的上皮细胞不能有效地封闭凋亡细胞所留下的空间, 导致肠黏膜通透性增高, 进而引起肠黏膜组织内免疫平衡紊乱.
PGC-1α是一种核受体家族转录辅助激活因子, 属于PGC-1家族[3], PGC-1家族包括PGC-1α、PGC-1β和PGC-1相关协同刺激因子(PRC). 人PGC-1α染色体定位于4p15.1, 全长67 Mr, 包含13个外显子和12个内含子, 编码一个具有798个氨基酸, 分子量为91 Mr的蛋白质. 其蛋白多肽的N末端为含有LXXLL基序的转录激活域及1个双向核定位信号(bipartite nuclear localization signal), LXXLL基序(L为亮氨酸, X为其他氨基酸)可与某些核受体的特定区域结合, 调控靶基因表达; C末端则为RNA加工域, 包括1个RNA识别基序(RNA-binding motif, RMM)和富含丝氨酸/精氨酸的SR结构域(serime-arginine-rich domain), 可与相关靶基因启动子结合, 加工处理新转录的mRNA. PGC-1α作为一种核辅激活因子, 以其特殊的氨基酸分子序列与DNA序列结合的转录因子或其他的辅激活因子相互作用, 通过不同的机制间接增强靶基因的转录效率, 广泛参与多种代谢通路的调节活动, 如机体适应性产热、线粒体生物合成、肌肉中葡萄糖转运、脂肪酸β氧化、骨骼肌纤维类型转换、肝糖异生代谢等生理活动[10,11].
既往研究显示高表达的PGC-1α与PPARγ-RXR(nuclear receptors retinoic X receptor, RXR)协同诱导棕色脂肪细胞标志性蛋白的表达, 如肉碱脂酰转移酶(CPT-1)、甘油激酶、细胞色素C等基因的表达, 说明PGC-1α能够促进线粒体的生成, 增强脂肪酸β氧化和细胞呼吸链作用[12]. D'Errico等[13]研究表明PGC-1α在肠上皮细胞的能量代谢中起重要作用, 而且PGC-1α通过增加活性氧促进线粒体介导的细胞凋亡, 从而抑制肿瘤的发生发展. Puigserver等[14]发现白介素(IL)-1α、IL-1β、肿瘤坏死因子(TNF)-α可通过p38分裂原活化蛋白激酶(p38 mitogen activated proteinkinase, p38 MAPK)途径激活PGC-1α, 进而调节细胞能量代谢. 最近研究[15]表明PGC-1α在肝细胞中高表达能促进IL-1受体的拮抗剂(interleukin 1 receptor antagonist, IL-1Rn)mRNA的高表达. 进一步研究显示: PGC-1α能够通过IL-1Rn与5'-磷酸腺苷激活蛋白激酶(AMPK)共同参与肝细胞能量代谢与炎症反应之间的平衡.
本研究通过免疫组织化学分析技术和荧光定量PCR技术初步探讨了IBD患者肠黏膜中PGC-1α的表达情况. 结果显示: 在正常肠黏膜组织中, PGC-1α主要在上皮细胞中表达, 在黏膜固有层中表达较少, 这与D'Errico等[13]的研究结果相符. 与正常对照组相比, PGC-1α在CD患者肠黏膜中的表达不论是空间分布还是数量上均无明显差异, 而在UC患者的肠黏膜上皮细胞中PGC-1α的表达量较少, 在炎性肠黏膜固有层细胞中表达量明显升高. 同时, 我们用荧光定量PCR分析显示, 与正常对照组相比, PGC-1α mRNA在CD患者炎症肠黏膜中的表达量无统计学差异, 而在UC患者中PGC-1α mRNA水平降低, 与对照组相比有统计学差异. D'Errico等[13]研究显示肠黏膜隐窝内的细胞和绒毛顶端上皮细胞的增殖活性与能量代谢能力均有差异, 与隐窝内的细胞相比, 绒毛顶端的上皮细胞中的抗氧化酶过氧化氢酶、超氧化物歧化酶表达较少, 因而绒毛顶端的上皮细胞易受氧自由基损伤, 易发生细胞凋亡. 在结肠癌组织中PGC-1α的高表达能够减少超氧化物歧化酶, 促进活性氧的生成, 增强线粒体氧化呼吸, 从而抑制线粒体介导的细胞凋亡, 阻止癌组织的发生发展. 那么, 在IBD炎性肠黏膜组织中, PGC-1α是否参与调节肠上皮细胞线粒体能量代谢和氧化抗氧化过程需待进一步研究.
总之, 本次研究首次探讨了PGC-1α在CD和UC患者肠黏膜组织中表达不同, 提示CD和UC发病机制的差异, 而且PGC-1α在IBD患者肠黏膜微生态失调中发挥着重要作用. 通过对PGC-1α的深入研究, 有助于我们全面了解IBD的发生发展过程, 对指导临床治疗产生积极影响.
感谢同济大学附属第十人民医院胃肠内科、消化内镜中心各位老师在研究过程中给予帮助和支持.
肠黏膜微生态环境的失衡, 尤其是肠黏膜组织内能量代谢失衡、抗氧化屏障减弱, 在炎症性肠病(IBD)的发生发展过程中的作用不可忽视.
施瑞华, 教授, 南京医科大学第一附属医院消化科
D'Errico等研究发现PGC-1α在肠上皮细胞中, 通过增加活性氧促进线粒体介导的细胞凋亡, 进而抑制肿瘤的发生发展.
PGC-1α通过多种机制广泛参与调节组织细胞的能量生成与利用过程, 本研究初步探讨PGC-1α在IBD发病机制中的作用.
本研究结果显示PGC-1α在溃疡性结肠炎(UC)中表达明显下降, 而在克罗恩病(CD)中无明显变化, 这一结论具有一定的临床研究价值.
编辑: 张姗姗 电编:鲁亚静
| 1. | Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annu Rev Immunol. 2010;28:573-621. [PubMed] [DOI] |
| 2. | Maloy KJ, Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 2011;474:298-306. [PubMed] [DOI] |
| 3. | Puigserver P, Wu Z, Park CW, Graves R, Wright M, Spiegelman BM. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell. 1998;92:829-839. [PubMed] [DOI] |
| 6. | Liu Z, Feng BS, Yang SB, Chen X, Su J, Yang PC. Interleukin (IL)-23 suppresses IL-10 in inflammatory bowel disease. J Biol Chem. 2012;287:3591-3597. [PubMed] [DOI] |
| 7. | Liu Z, Yang L, Cui Y, Wang X, Guo C, Huang Z, Kan Q, Liu Z, Liu Y. Il-21 enhances NK cell activation and cytolytic activity and induces Th17 cell differentiation in inflammatory bowel disease. Inflamm Bowel Dis. 2009;15:1133-1144. [PubMed] [DOI] |
| 8. | Liu Z, Yadav PK, Xu X, Su J, Chen C, Tang M, Lin H, Yu J, Qian J, Yang PC. The increased expression of IL-23 in inflammatory bowel disease promotes intraepithelial and lamina propria lymphocyte inflammatory responses and cytotoxicity. J Leukoc Biol. 2011;89:597-606. [PubMed] [DOI] |
| 9. | Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006;127:469-480. [PubMed] [DOI] |
| 10. | Murphy MP. How mitochondria produce reactive oxygen species. Biochem J. 2009;417:1-13. [PubMed] [DOI] |
| 11. | Luo B, Parker GJ, Cooksey RC, Soesanto Y, Evans M, Jones D, McClain DA. Chronic hexosamine flux stimulates fatty acid oxidation by activating AMP-activated protein kinase in adipocytes. J Biol Chem. 2007;282:7172-7180. [PubMed] [DOI] |
| 12. | Tiraby C, Langin D. Conversion from white to brown adipocytes: a strategy for the control of fat mass? Trends Endocrinol Metab. 2003;14:439-441. [PubMed] [DOI] |
| 13. | D'Errico I, Salvatore L, Murzilli S, Lo Sasso G, Latorre D, Martelli N, Egorova AV, Polishuck R, Madeyski-Bengtson K, Lelliott C. Peroxisome proliferator-activated receptor-gamma coactivator 1-alpha (PGC1alpha) is a metabolic regulator of intestinal epithelial cell fate. Proc Natl Acad Sci U S A. 2011;108:6603-6608. [PubMed] [DOI] |
| 14. | Puigserver P, Rhee J, Lin J, Wu Z, Yoon JC, Zhang CY, Krauss S, Mootha VK, Lowell BB, Spiegelman BM. Cytokine stimulation of energy expenditure through p38 MAP kinase activation of PPARgamma coactivator-1. Mol Cell. 2001;8:971-982. [PubMed] [DOI] |
| 15. | Buler M, Aatsinki SM, Skoumal R, Komka Z, Tóth M, Kerkelä R, Georgiadi A, Kersten S, Hakkola J. Energy-sensing factors coactivator peroxisome proliferator-activated receptor γ coactivator 1-α (PGC-1α) and AMP-activated protein kinase control expression of inflammatory mediators in liver: induction of interleukin 1 receptor antagonist. J Biol Chem. 2012;287:1847-1860. [PubMed] [DOI] |