修回日期: 2012-03-30
接受日期: 2012-04-19
在线出版日期: 2012-05-28
目的: 明确2型糖尿病患者与正常对照人群比较是否存在总乳酸杆菌及其具体菌种嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌数目的差异, 以及探索乳酸杆菌与血糖、血脂等代谢指标是否相关.
方法: 选取2型糖尿病患者50人、正常对照者30人作为研究对象, 两组性别、年龄、BMI相匹配. 检测糖尿病患者空腹血糖、餐后2 h血糖、血脂、C反应蛋白等指标, 并收集糖尿病患者及对照者粪便提取细菌总DNA, 通过实时荧光定量PCR方法测定目标细菌的拷贝数.
结果: 2型糖尿病组肠道乳酸杆菌(P<0.001)及嗜酸乳杆菌(P<0.001)、保加利亚乳杆菌(P<0.001)、干酪乳杆菌(P = 0.008)、鼠李糖乳杆菌(P<0.001)显著高于对照组, 且乳酸杆菌与低密度脂蛋白胆固醇显著负相关(P = 0.04).
结论: 2型糖尿病患者肠道总乳酸杆菌及其某些具体菌种数量增多, 乳酸杆菌数量的改变对血脂也存在影响. 通过饮食调节肠道乳酸杆菌含量可能有助于改善糖尿病、高脂血症等代谢性疾病.
引文著录: 刘婷婷, 蔡德鸿. 实时定量PCR法分析2型糖尿病患者肠道乳酸杆菌菌种数量的改变. 世界华人消化杂志 2012; 20(15): 1359-1365
Revised: March 30, 2012
Accepted: April 19, 2012
Published online: May 28, 2012
AIM: To assess the differences in Lactobacillus species between patients with type 2 diabetes mellitus (T2DM) and healthy individuals, and to determine the association between metabolic parameters and Lactobacillus species in T2DM patients.
METHODS: This study included 50 T2DM patients and 30 healthy individuals of similar age, gender and BMI. Blood samples were collected from T2DM to measure metabolic parameters. Bacterial DNA was extracted from fecal samples to assess the quantities of bacteria using real-time quantitative PCR with primers specifically targeting V3 region of the 16s rRNA.
RESULTS: The quantities of Lactobacillus (P < 0.001), L. acidophilus (P < 0.001), L. bugaricus (P < 0.001), L. cacei (P = 0.008) and L. Rahmnosumand (P < 0.001) were significantly increased in the T2DM group compared to the control group. The quantity of Lactobacillus was significantly negatively associated with LDL cholesterol levels (P = 0.04).
CONCLUSION: T2DM patients are characterized by an increase in the quantity of Lactobacillus species in the guts compared to normal controls. Lactobacillus in the guts play a role in influencing cholesterol metabolism in T2DM patients. Modification of the gut microflora by dietary means may help control metabolic diseases such as dyslipidemia and diabetes.
- Citation: Liu TT, Cai DH. Real-time quantitative PCR analysis of intestinal Lactobacillus species in type 2 diabetic patients. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1359-1365
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1359.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1359
人体消化系定植着相当复杂又相对稳定的肠道菌群, 在能量代谢、免疫防御、合成人体必需的微量元素及矿物质等方面发挥着不可替代的作用[1,2]. 近年来研究发现, 2型糖尿病的发生机制除了与基因及饮食结构、体力活动等环境因素有关之外, 还与肠道菌群关系密切[3,4]. 研究表明, 2型糖尿病患者或动物模型与正常对照者相比肠道菌群构成发生了改变, 这可能是引起胰岛素抵抗及糖尿病的因素[5,6]. 也有动物实验发现, 通过改变饮食因素来调节肠道菌群结构能够引起肥胖, 进而增加糖尿病的风险[2,7]. 肠道菌群与代谢性疾病的发生发展密切相关, 已成为国内外研究的新热点. 目前肠道菌群与代谢性疾病关系的研究主要是通过动物实验, 而关于人体肠道菌群的研究数据较少, 且现有数据主要集中在"菌属"水平, 而对其中具体"菌种"在代谢中的作用研究尚存在空白. 乳酸杆菌普遍存在于人类消化系中, 并且经常作为益生菌加入食品中[8,9]. 乳酸杆菌属包含众多菌种, 如: 嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌等, 目前鲜有人体肠道乳酸杆菌具体菌种与代谢性疾病关系的研究数据. 且目前乳酸杆菌与人类健康的相互作用仍存在分歧, 其影响人体代谢的机制仍不十分清楚. 有实验发现, 服用乳酸杆菌能减轻大鼠的肥胖及胰岛素抵抗[10-13]. 然而也有实验表明, 乳酸杆菌能引起炎症反应, 而炎症反应又与肥胖及2型糖尿病有关[14-19]. 因此本研究选取乳酸杆菌及其具体菌种(嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌), 在"菌属"及具体"菌种"水平上, 应用荧光定量PCR技术, 比较我国2型糖尿病人群与血糖正常人群肠道上述菌数量的差异, 并且分析乳酸杆菌数量与血糖、血脂等代谢性指标的相关性, 从而为2型糖尿病的发病机制提供新线索, 为2型糖尿病的防治寻求新靶点.
荧光定量PCR仪ABI7500 System(ABI公司), 紫外分光光度计SmartSpecTM3000(美国Bio-rad), 凝胶成像仪(美国Bio-rad), Mastercycler梯度PCR仪(eppendorf公司), 水平式电泳仪(上海精益玻璃仪器厂), Himac CR22G高速冷冻离心机(日本日立公司), 台式离心机(eppendor公司). rTaq DNA聚合酶、DL2000 DNA Marker、SYBR Premix Dimer Erase(Perfect Real Time)购自大连TaKaRa公司; 细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒购自北京TIANGEN公司; 0.2 mL PCR8联管购自AXYGEN公司; 其他试剂皆为国产分析纯, 所用引物均参照GenBank提供的序列, 由上海英骏生物技术有限公司合成. 选取2010-08/10在广东省某社区医院住院及门诊随诊的2型糖尿病患者50人. 纳入标准: (1)符合诊断标准的2型糖尿病患者(根据WHO糖尿病分型及诊断标准); (2)无肿瘤及肝、肾等脏器严重损害, 无甲状腺等其他内分泌疾病; (3)近1 mo内未服用抗生素及微生态制剂; (4)近4 wk内无腹泻病或其他胃肠道疾病; (5)近3 mo内未服用任何降脂药治疗, 同时选取30名健康对照者. 纳入标准: (1)无糖尿病; (2)无其他脏器严重损害, 无甲状腺等其他内分泌疾病; (3)近1 mo内未服用抗生素及微生态制剂; (4)近4 wk内无腹泻病或其他胃肠道疾病史. 研究经由南方医科大学伦理委员会书面批准.
1.2.1 人体测量、粪便样品收集及血样品化验: 对每个研究对象进行身高、体质量测量, 计算BMI. 收集每个2型糖尿病患者空腹血样品, 进行空腹血糖(FBG)、糖化血红蛋白(HbA1C)、血脂(包括TC、LDL-C、HDL-C、TG)、C反应蛋白(CRP)浓度测定. 进行OGTT试验, 收集2 h后血样品进行餐后2 h血糖(PBG)浓度测定. 收集每个研究对象当日粪便样品, -70 ℃保存.
1.2.2 粪便样品的预处理和细菌总DNA的提取: (1)粪便中菌体的收集: 称取湿重粪便样品每份2 g于无菌离心管中, 加入20 mL灭菌PBS(0.01 mol/L, pH 7.4), 充分振荡, 3 000 r/min离心5 min, 收集上清(菌体), 重复洗涤3次. 将收集的上清液12 000 r/min离心10 min, 收集沉淀(菌体). 收集的菌体用20 mL灭菌PBS(pH 7.4)悬浮, 12 000 r/min离心5 min, 重复洗涤3次, 得到的菌体沉淀保存于-20 ℃, 或者直接用于DNA提取; (2)粪便细菌总DNA的提取: 用细菌基因组DNA提取试剂盒提取细菌总DNA, 具体步骤按操作说明进行, 并进行1.0%的琼脂糖凝胶电泳分析, 得到的DNA溶液放置于-20 ℃保存.
1.2.3 实时荧光定量PCR: (1)PCR引物设计: 根据16s rRNA基因序列, 应用引物设计软件Primer Premier 5.0设计特异性PCR引物. 并在BLAST基因库内比对引物序列的相应种属特异性, 各引物序列见表1; (2)标准曲线制作: 以各标准菌株PCR产物经切胶、回收后所得的DNA片段作为荧光定量PCR的标准品, 用紫外分光光度计测定吸光度(A)值及浓度, 换算为各标准品1 mL的拷贝数, 用于制作标准曲线. 将标准品做10倍系列稀释, 各做8个10倍稀释浓度, 如表2所示. 根据系列稀释后的标准品反应时的荧光扩增信号, 采用ABI7500 System数据分析软件自动生成乳酸杆菌总属及其具体菌种的标准曲线; (3)粪便样品16s rRNA定量分析: 将待测粪便样品中提取的DNA分别进行乳酸杆菌总属及其具体菌种16s rRNA荧光定量PCR反应, 每次反应体系和反应条件均相同. 反应体系20 μL: SYBR premix(2×) 10 μL, 10 μmol/L的上下游引物各0.6 μL, ROX Reference Dye(50×)0.4 μL, ddH2O 6.4 μL, 待测DNA样品或标准品2 μL. 反应条件: 95 ℃变性30 s; 循环40次: 95 ℃变性5 s→55 ℃退火30 s→72 ℃延伸34 s; 熔解95 ℃ 15 s→60 ℃ 1 min→95 ℃ 15 s→冷却60 ℃ 15 s. 将10倍系列稀释的标准品与粪便细菌DNA样品同时进行real-time PCR反应. 每次实验同时设标准品及空白对照, 每个样品均同时做2个平行复孔. 反应完毕后根据熔解曲线分析PCR产物的特异性, 根据Ct值及标准曲线计算每克粪便样品中待测细菌基因的拷贝数, 作为定量结果.
| 目标细菌名称 | F序列 | R序列 |
| 乳酸杆菌 | AGCAGTAGGGAATCTTCCA | CACCGCTACACATGGAG |
| 嗜酸乳杆菌 | GAAAGAGCCCAAACCAAGTGATT | CTTCCCAGATAATTCAACTATCGCTTA |
| 保加利亚乳杆菌 | GGRTGATTTGTTGGACGCTAG | GCCGCCTTTCAAACTTGAATC |
| 干酪乳杆菌 | GCACCGAGATTCAACATGG | GGTTCTTGGATYTATGCGGTATTAG |
| 植物乳杆菌 | TGGATCACCTCCTTTCTAAGGAAT | TGTTCTCGGTTTCATTATGAAAAAATA |
| 鼠李糖乳杆菌 | TGCTTGCATCTTGATTTAATTTTG | GTCCATTGTGGAAGATTCCC |
| 目标细菌 | 标准品原浓度(copies/mL) | 标准品10倍系列稀释浓度(copies/mL) |
| 乳酸杆菌 | 3.21×1013 | 3.21×104-3.21×1011 |
| 嗜酸乳杆菌 | 2.87×1013 | 2.87×103-2.87×1010 |
| 保加利亚乳杆菌 | 3.76×1013 | 3.76×103-3.76×1010 |
| 干酪乳杆菌 | 1.99×1013 | 1.99×103-1.99×1010 |
| 植物乳杆菌 | 2.18×1013 | 2.18×103-2.18×1010 |
| 鼠李糖乳杆菌 | 4.00×1013 | 4.00×103-4.00×1010 |
统计学处理 样品定量数据经l g转换后导入SPSS17.0统计软件进行分析. 应用Mann-Whitney U检验比较组间差异. 用线性回归分析总乳酸杆菌拷贝数与糖尿病患者脂代谢指标、糖代谢指标、炎症指标的相关性. 以P<0.05为差异有统计学意义.
糖尿病组共50人(男:女 = 23:27), 对照组共30人(男:女 = 17:13). 两组基本信息(性别、年龄、BMI)统计结果见表3. 两组年龄范围40-76岁, 两组性别、年龄、BMI无统计学差异, 具有良好可比性. 糖尿病组脂代谢指标(TG、TC、LDL-C、HDL-C)、糖代谢指标(FBG、PBG、HbA1C)、炎症指标(CRP)统计结果见表4.
| 糖尿病组(n = 50) | 对照组(n = 30) | P值 | |
| 性别(男/女) | 23/27 | 17/13 | 0.3 |
| 年龄(岁) | 60±8 | 61±9 | 0.7 |
| BMI(kg/m2) | 24.7±3.8 | 23.9±3.0 | 0.5 |
| 指标 | FBG(mmol/L) | 餐后2 h PBG (mmol/L) | HbAIC(%) | TG(mmol/L) | TC(mmol/L) | LDL-C(mmol/L) | HDL-C(mmol/L) | CRP(mg/L) |
| 糖尿病组 | 7.9±2.2 | 13.9±4.4 | 7.9±1.8 | 2.1±1.2 | 5.3±1.4 | 2.9±0.9 | 1.4±0.2 | 2.5±2.9 |
| 标准值 | 3.6-6.1 | 3.6-7.8 | 4.0-6.0 | 0.4-1.8 | 3.4-6.0 | 2.0-4.1 | 0.7-1.9 | 0-3.0 |
采用紫外分光光度法测定, DNA标准品在A260/A280的比值均在1.6-1.8, 说明作为标准品的DNA纯度较高, 无蛋白质污染. 所提取的DNA样品进行1.0%的琼脂糖凝胶电泳可见清晰条带, 提示DNA 样品完整性良好.
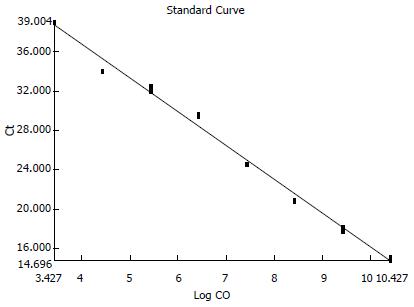
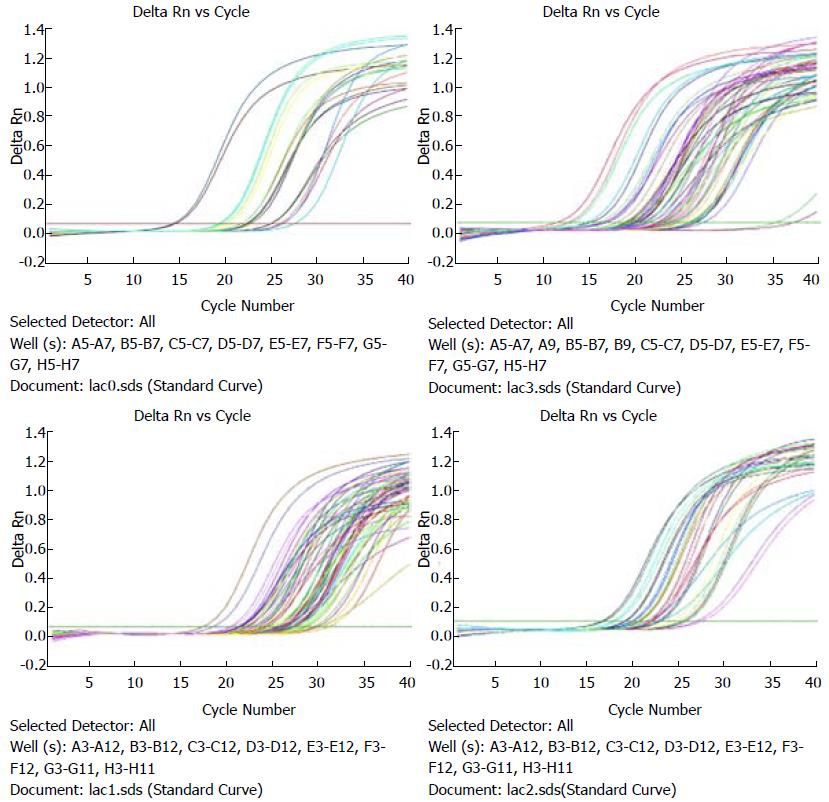
根据标准品反应时的荧光扩增信号, 采用ABI7500 System数据分析软件自动生成乳酸杆菌及其具体菌种的标准曲线及扩增曲线, 其中乳酸杆菌标准曲线如图1, 扩增曲线如图2.
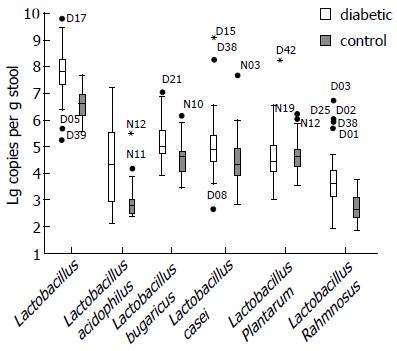
用Mann-Whitney U检验对乳酸杆菌属及具体菌种real-time qPCR结果进行统计学分析, 见表5, 糖尿病组乳酸杆菌(P<0.001)及嗜酸乳杆菌(P<0.001)、干酪乳杆菌(P = 0.008)、保加利亚乳杆菌(P<0.001)、鼠李糖乳杆菌(P<0.001)含量显著高于对照组, 糖尿病组植物乳杆菌含量低于健康对照组, 但差异不具有显著性(P = 0.786, 图3).
| 糖尿病组(n = 50) | 对照组(n = 30) | P值 | |||
| 中位数 | 平均秩次 | 中位数 | 平均秩次 | ||
| 乳酸杆菌 | 7.7850 | 51.86 | 6.5750 | 21.57 | <0.001 |
| 嗜酸乳杆菌 | 4.2650 | 48.63 | 2.7450 | 26.95 | <0.001 |
| 保加利亚乳杆菌 | 5.0026 | 48.66 | 4.5782 | 26.90 | <0.001 |
| 干酪乳杆菌 | 4.8432 | 45.78 | 4.3028 | 31.70 | 0.008 |
| 植物乳杆菌 | 4.4025 | 39.94 | 4.6255 | 41.43 | 0.786 |
| 鼠李糖乳杆菌 | 3.6017 | 50.92 | 2.6007 | 23.13 | <0.001 |
回归分析结果显示乳酸杆菌与脂代谢指标显著相关, 与糖代谢指标、炎症指标之间未发现明显相关性. 总乳酸杆菌与LDL-C显著负相关(P = 0.04), 与TC(P = 0.07)、TG(P = 0.13)、HDL-C(P = 0.14)呈负相关, 但相关性不具有统计学意义.
本研究利用16s rRNA保守区序列在所有菌种中具有高度一致性, 而可变区序列在不同菌种中差异较大的特点, 针对目标细菌16s rRNA V3区序列设计特异性引物, 应用实时荧光定量PCR技术对样本进行检测, 具有高度特异性. 通过对乳酸杆菌属及其具体菌种的定量分析比较, 可以初步认为: 乳酸杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌及鼠李糖乳杆菌在2型糖尿病人群和血糖正常人群中存在差异, 2型糖尿病人群中上述菌种增多, 并且与血脂水平呈显著负相关.
Larsen等[20]研究发现, 糖尿病患者肠道乳酸杆菌含量升高, 这与本研究结果一致. 而且本研究进一步测定了乳酸杆菌具体菌种的含量, 结果显示其中嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、鼠李糖乳杆菌在2型糖尿病人群中含量增多. 乳酸杆菌在代谢性疾病发生发展过程中的作用目前仍未被阐明. 研究发现, 饮食中添加乳酸杆菌可以改善胰岛素抵抗[10,21]. 然而也有研究指出, 乳酸杆菌具有促炎症作用[14], 可以推断, 肠道乳酸杆菌数量改变可能通过慢性低度炎症反应引起肥胖、胰岛素抵抗及糖尿病[22]. 然而, 本实验通过测定CRP浓度未发现乳酸杆菌数量与炎症反应具有显著相关性, 这可能是由于乳酸杆菌数量改变仅引起局部炎症反应, 且低于系统检测水平. 研究表明, 饮食是肠道菌群构成的主要影响因素, 高脂饮食可导致肠道菌群的改变[19]. 糖尿病患者肠道乳酸杆菌数量增多可能是长期高脂饮食引起, 而高脂饮食可引起肥胖, 进一步促进胰岛素抵抗及糖尿病的发生. 另外, 大量研究证实, 肠道菌群能够将不溶性蛋白质、糖类转化为可溶性物质, 将多糖转化为单糖, 将葡萄糖分解形成乳酸, 参与胆固醇代谢等, 为宿主提供能量[1,23,24], 也许正是因为肠道菌群构成的改变, 造成消化系物质能量吸收、代谢的紊乱, 进而引发2型糖尿病等代谢性疾病, 其机制有待于进一步研究明确.
在所有代谢指标中, 只发现LDL-C与乳酸杆菌显著负相关. 2型糖尿病常伴有血脂异常, 其特点是TC、TG、LDL-C升高和/或HDL-C降低. 血脂异常的原因除了饮食、遗传因素之外可能也与肠道菌群存在一定联系[25]. 有研究发现, 饮用含有嗜酸乳酸杆菌的酸奶能降低2型糖尿病患者血浆总TG和LDL-C浓度[26], 因此可以推测, 肠道菌群对血脂代谢具有一定的调节作用, 但其具体机制仍未明确, 能否通过调节肠道菌群来改善血脂异常有待进一步研究.
遗憾的是, 本研究并未发现乳酸杆菌数量与FBG、PBG、HbA1C、C肽的明显相关性, 这可能是由于2型糖尿病代谢紊乱是与肠道菌群的整体失衡有关, 而与单一乳酸杆菌属改变关系不明显. 因此, 需要进行更大规模的样本量以及更广范围的菌群分析来深入探索2型糖尿病代谢紊乱与肠道菌群失衡的具体相关性.
总之, 本研究证实2型糖尿病患者肠道乳酸杆菌含量在"菌属"及"菌种"水平发生了特征性改变, 这可能成为早期发现糖尿病高危人群的新途径. 本研究还发现乳酸杆菌数量的改变对血脂也存在影响. 通过饮食调节肠道乳酸杆菌含量可能有助于改善糖尿病、高脂血症等代谢性疾病.
感谢南方医科大学生物治疗实验室的大力支持和帮助.
近年来研究发现, 2型糖尿病的发生机制除了与基因及饮食结构、体力活动等环境因素有关之外, 还与肠道菌群关系密切. 肠道菌群与代谢性疾病的发生发展密切相关, 已成为国内外研究的新热点.
于珮, 主任医师, 天津医科大学代谢病医院
研究表明, 2型糖尿病患者或动物模型与正常对照者相比肠道菌群构成发生了改变, 这可能是引起胰岛素抵抗及糖尿病的因素. 也有动物实验发现, 通过改变饮食因素来调节肠道菌群结构能够引起肥胖, 进而增加糖尿病的风险.
Larsen等研究发现, 糖尿病患者肠道乳酸杆菌含量升高, 这与本研究结果一致.
本实验比较了2型糖尿病患者与正常对照人群总乳酸杆菌及其具体菌种嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌、鼠李糖乳杆菌数目的差异, 以及探索乳酸杆菌与血糖、血脂等代谢指标是否相关.
本研究证实2型糖尿病患者肠道乳酸杆菌含量在"菌属"及"菌种"水平发生了特征性改变, 这可能成为早期发现糖尿病高危人群的新途径, 有助于改善糖尿病、高脂血症等代谢性疾病.
本研究探讨肠道乳杆菌数量改变与糖代谢的相关性, 研究内容有一定新颖性, 全文语言比较流畅, 参考文献比较新颖.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | de Roos NM, Katan MB. Effects of probiotic bacteria on diarrhea, lipid metabolism, and carcinogenesis: a review of papers published between 1988 and 1998. Am J Clin Nutr. 2000;71:405-411. [PubMed] |
| 2. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718-15723. [PubMed] [DOI] |
| 3. | Musso G, Gambino R, Cassader M. Interactions between gut microbiota and host metabolism predisposing to obesity and diabetes. Annu Rev Med. 2011;62:361-380. [PubMed] [DOI] |
| 4. | Wu X, Ma C, Han L, Nawaz M, Gao F, Zhang X, Yu P, Zhao C, Li L, Zhou A. Molecular characterisation of the faecal microbiota in patients with type II diabetes. Curr Microbiol. 2010;61:69-78. [PubMed] [DOI] |
| 5. | Delzenne NM, Cani PD. Gut microbiota and the pathogenesis of insulin resistance. Curr Diab Rep. 2011;11:154-159. [PubMed] [DOI] |
| 6. | Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes. 2008;57:1470-1481. [PubMed] [DOI] |
| 7. | Tremaroli V, Kovatcheva-Datchary P, Bäckhed F. A role for the gut microbiota in energy harvesting? Gut. 2010;59:1589-1590. [PubMed] [DOI] |
| 8. | Hove H, Nørgaard H, Mortensen PB. Lactic acid bacteria and the human gastrointestinal tract. Eur J Clin Nutr. 1999;53:339-350. [PubMed] [DOI] |
| 9. | Dunne C, Murphy L, Flynn S, O'Mahony L, O'Halloran S, Feeney M, Morrissey D, Thornton G, Fitzgerald G, Daly C. Probiotics: from myth to reality. Demonstration of functionality in animal models of disease and in human clinical trials. Antonie Van Leeuwenhoek. 1999;76:279-292. [PubMed] [DOI] |
| 10. | Naito E, Yoshida Y, Makino K, Kounoshi Y, Kunihiro S, Takahashi R, Matsuzaki T, Miyazaki K, Ishikawa F. Beneficial effect of oral administration of Lactobacillus casei strain Shirota on insulin resistance in diet-induced obesity mice. J Appl Microbiol. 2011;110:650-657. [PubMed] [DOI] |
| 11. | Matsuzaki T, Yamazaki R, Hashimoto S, Yokokura T. Antidiabetic effects of an oral administration of Lactobacillus casei in a non-insulin-dependent diabetes mellitus (NIDDM) model using KK-Ay mice. Endocr J. 1997;44:357-365. [PubMed] [DOI] |
| 12. | Matsuzaki T, Nagata Y, Kado S, Uchida K, Hashimoto S, Yokokura T. Effect of oral administration of Lactobacillus casei on alloxan-induced diabetes in mice. APMIS. 1997;105:637-642. [PubMed] [DOI] |
| 13. | Tabuchi M, Ozaki M, Tamura A, Yamada N, Ishida T, Hosoda M, Hosono A. Antidiabetic effect of Lactobacillus GG in streptozotocin-induced diabetic rats. Biosci Biotechnol Biochem. 2003;67:1421-1424. [PubMed] [DOI] |
| 14. | Zeuthen LH, Christensen HR, Frøkiaer H. Lactic acid bacteria inducing a weak interleukin-12 and tumor necrosis factor alpha response in human dendritic cells inhibit strongly stimulating lactic acid bacteria but act synergistically with gram-negative bacteria. Clin Vaccine Immunol. 2006;13:365-375. [PubMed] [DOI] |
| 15. | Santacruz A, Marcos A, Wärnberg J, Martí A, Martin-Matillas M, Campoy C, Moreno LA, Veiga O, Redondo-Figuero C, Garagorri JM. Interplay between weight loss and gut microbiota composition in overweight adolescents. Obesity (Silver Spring). 2009;17:1906-1915. [PubMed] [DOI] |
| 16. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 17. | Cani PD, Delzenne NM, Amar J, Burcelin R. Role of gut microflora in the development of obesity and insulin resistance following high-fat diet feeding. Pathol Biol (Paris). 2008;56:305-309. [PubMed] [DOI] |
| 18. | Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. Curr Opin Clin Nutr Metab Care. 2007;10:729-734. [PubMed] [DOI] |
| 19. | Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, Tuohy KM, Gibson GR, Delzenne NM. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia. 2007;50:2374-2383. [PubMed] [DOI] |
| 20. | Larsen N, Vogensen FK, van den Berg FW, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One. 2010;5:e9085. [PubMed] [DOI] |
| 21. | Andreasen AS, Larsen N, Pedersen-Skovsgaard T, Berg RM, Møller K, Svendsen KD, Jakobsen M, Pedersen BK. Effects of Lactobacillus acidophilus NCFM on insulin sensitivity and the systemic inflammatory response in human subjects. Br J Nutr. 2010;104:1831-1838. [PubMed] [DOI] |
| 22. | Wellen KE, Hotamisligil GS. Inflammation, stress, and diabetes. J Clin Invest. 2005;115:1111-1119. [PubMed] |
| 23. | Stappenbeck TS, Hooper LV, Gordon JI. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells. Proc Natl Acad Sci U S A. 2002;99:15451-15455. [PubMed] [DOI] |
| 24. | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444:1027-1031. [PubMed] [DOI] |
| 25. | Pereira DI, Gibson GR. Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut. Appl. Environ Microbiol. 2002;68:4689-4693. [PubMed] [DOI] |
| 26. | Lu YC, Yin LT, Chang WT, Huang JS. Effect of Lactobacillus reuteri GMNL-263 treatment on renal fibrosis in diabetic rats. J Biosci Bioeng. 2010;110:709-715. [PubMed] [DOI] |