修回日期: 2012-03-28
接受日期: 2012-04-19
在线出版日期: 2012-05-28
目的: 探讨猪急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)回肠组织中Toll样受体4(Toll-like receptor 4, TLR4)的表达及其意义.
方法: 选择太湖梅山猪, 随机分成对照组(C, n = 4)、急性坏死性胰腺炎组(ANP, n = 4). 诱导制备ANP模型. 用分光光度法检测血清及回肠组织匀浆中二胺氧化酶(DAO)活性; 动态比浊法检测血浆内毒素水平; RT-PCR检测回肠黏膜组织TLR4、TNF-α及IL-6 mRNA表达.
结果: ANP组回肠组织DAO水平明显低于C组, 血清中DAO明显升高(P<0.05). ANP组血浆内毒素水平较C组明显升高(P<0.05); 回肠黏膜组织TLR4、TNF-α、IL-6 mRNA在C组表达非常低, ANP组表达明显增加; TLR4 mRNA表达水平与肠黏膜DAO水平呈负相关(r = -0.762, P = 0.028), 与血浆内毒素呈正相关(r = 0.778, P = 0.023).
结论: ANP时回肠组织内TLR4 mRNA表达上调, 可能与ANP肠黏膜屏障功能障碍有关; 其可能机制与TLR4介导激活核转录因子NF-κB信号转导途径有关.
引文著录: 林敏, 陈卫昌, 薛乐宁, 徐克群, 王晓勇, 谭勇. Toll样受体4在猪急性坏死性胰腺炎肠道组织中的建立及功能评价. 世界华人消化杂志 2012; 20(15): 1338-1341
Revised: March 28, 2012
Accepted: April 19, 2012
Published online: May 28, 2012
AIM: To detect the expression of Toll-like receptor 4 gene (TLR4) in the ileum of pigs with acute necrotizing pancreatitis (ANP).
METHODS: Eight pigs were randomized into ANP group and control group. ANP was induced by retrograde injection of sodium taurocholate. Blood levels of DAO were measured at various time points. Endotoxin concentration was determined using a commercial kit. The expression of tumor necrosis factor alpha (TNF-α), interleukin (IL)-6 and Toll-like receptor (TLR) 4 mRNAs in the ileum was assayed by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared to the control group, plasma endotoxin concentrations and serum DAO levels increased significantly (both P < 0.05), DAO levels in the ileal tissue homogenate decreased (P < 0.05), and expression of TLR4, TNF-α, and IL-6 mRNAs was significantly up-regulated (all P < 0.05) in the ANP group. The expression levels of TLR4 mRNA were correlated with DAO levels in ideal tissue (r = -0.762, P = 0.028) and plasma endotoxin concentrations (r = 0.778, P = 0.023).
CONCLUSION: Expression of TLR4 mRNA increased in the ileum of ANP pigs, and TLR4 mRNA overexpression may correlate with intestinal mucosa injury and development of enterogenic infection.
- Citation: Lin M, Chen WC, Xue LN, Xu KQ, Wang XY, Tan Y. Significance of expression of Toll-like receptor 4 in the intestinal tract of pigs with acute necrotizing pancreatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1338-1341
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1338
急性胰腺炎(acute pancreatitis, AP)是临床常见的急腹症之一, 近年来研究认为细菌易位(bacterial translocation, BT)感染, 是诱发和加重"二次打击"并引起全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及多器官功能衰竭综合征(multiple organ dysfunction syndrome, MODS)等的重要因素[1]. 在AP早期, 肠道是SIRS的一个靶器官, 而肠屏障功能损害所致的肠道细菌或毒素易位是AP时细菌入侵的主要途径[2]. Toll样受体4(Toll-like receptor 4, TLR4)是天然免疫系统识别病原微生物的主要受体, 在天然免疫反应中具有重要的作用. TLR4可特异性识别细菌脂多糖(lipopolysaccharide, LPS), 在诱导细胞反应中具有关键作用[3]. TLR4的组织分布较广泛, 血管内皮细胞、单核细胞、中性粒细胞、树突状细胞、小肠上皮细胞[4]都有其表达. 本实验通过观察猪ANP时回肠组织TLR4的表达情况, 旨在探讨TLR4在ANP肠屏障损害中的作用.
成年健康♂太湖梅山猪(苏州大学实验动物中心提供), 采用随机排列表法将猪分为急性坏死性胰腺炎组(ANP, n = 4)和对照组(C, n = 4), 体质量12 kg±1.6 kg. 使用许可证号: SYXK苏2007-0035. 采用逆行胰管穿刺注射5%牛黄胆酸钠溶液1 mL/kg体质量(压力100 mmHg), 诱导制备ANP模型[5]. 对照组仅行胰管插管, 不注射药物. 术中静脉补液, 维持正常血容量. 电热毯维持动物体温.
1.2.1 标本取材: 各组于模型诱导前30 min(Tn)、制模后0 h(T0)、6 h(T1)、24 h(T2)、48 h(T3)、72 h(T4)时间点采集静脉血2 mL加入无热源肝素抗凝管, 离心(4 ℃, 3 500 r/min)10 min分离血浆, -70 ℃保存, 待测内毒素浓度; 采集静脉血2 mL加入桔红色BD真空采血管中(内附纤维蛋白酶促凝剂), 置于37 ℃恒温水浴箱中, 水浴30 min后离心(3 500 r/min)10 min分离血清后分装, -70 ℃保存, 待测DAO活性. 术后72 h处死猪, 立即提取回肠组织, 回肠选取距回盲部5 cm处回肠肠段5 cm, 纵行剖开, 生理盐水清洗肠内容物, 滤纸吸干, 组织修剪成2 cm×1 cm×0.5 cm大小, 液氮(-196 ℃)冻存.
1.2.2 血浆内毒素定量检测: 采用鲎试剂酶反应显色法(MB-80微生物快速动态检测系统)检测. 取血用试管经严格的去热源处理. 操作过程按检测系统的操作流程进行.
1.2.3 分光光度法检测血清和回肠组织DAO活性: 分别取血清、回肠组织匀浆80 μL, 加入试剂800 μL, 混匀, 倒入0.5 cm光径的石英比色皿中, 20 s时读取340 nm A1值, 立即放入37 ℃水浴锅水浴10 min, 20 s后读取340 nm A2值, 按照说明书计算DAO活力(U/mL).
1.2.4 RT-PCR检测回肠黏膜组织TLR4、TNF-α、IL-6 mRNA水平: 从液氮中取出冻存的肠组织, 以TRIzol法提取总RNA, 以GAPDH作为内参照, 用半定量RT-PCR进行扩增. 扩增产物经琼脂糖凝胶电泳, 在254 nm紫外光透视下对结果进行观察、扫描, 并对凝胶图像使用UVISOFT软件进行数据处理, 用目的条带的平均灰度与内参条带的平均灰度之比来表示目的基因表达的相对含量. GAPDH引物设计基于(GenBank accession No. DQ845173): 正向引物5'-TTGTGATGGGCGTGAACC-3'(nt169-186), 反向引物5'-TCCTCGCGTGCTCTTGCTG-3'(nt808-825); TLR4引物设计基于(GenBank accession No. NM001113039): 正向引物5'-GAT ACA CCA TCG GCT CTG-3'(nt1379-1396), 反向引物5'-ACATCCACGTTGTCTTCC-3'(nt2236-2253); TNF-α引物设计基于(GenBank accession No. X57321): 正向引物5'-TGCCCAGATTCAGCAAAGTCCA-3'(nt273-294), 反向引物5'-GCCACCACGCTCTTCTGCCTAC-3'(nt793-814); IL-6引物设计基于(GenBank accession No. NM214022): 正向引物5'-GCCACCACGCTCTTCTGCCTAC-3'(nt313-334), 反向引物5'-TGCCCAGATTCAGCAAAGTCCA-3'(nt833-854).
统计学处理 数据结果用mean±SD. 采用SASV8.0软件进行统计处理, 数值变量比较采用t检验, 组织学评分采用Wilcoxon检验, 相关性分析用Spearman相关性分析法. P<0.05为差异有统计学意义.
与C组相比, ANP组血浆内毒素水平明显升高(P<0.05, 表1).
| 分组 | 术前 | 术后0 h | 术后6 h | 术后24 h | 术后48 h | 术后72 h |
| C组 | <2.236 | <2.236 | <2.236 | <2.236 | 3.271±2.6 | 6.083±4.80 |
| ANP组 | <2.236 | 23.68±18.4 | 33.09±22.2 | 67.99±10.2 | 160.4±46.6 | 69.40±12.0 |
ANP组回肠组织DAO水平(37 U/L±2.7 U/L)明显低于C组(108 U/L±6.2 U/L, P<0.05). ANP动物模型诱导成功后血清中DAO逐渐升高(P<0.05), 造模后各时间点与C组比较均有显著差异(P<0.05, 表2).
| 分组 | 术前 | 术后 | 术后6 h | 术后24 h | 术后48 h | 术后72 h |
| C组 | 15.37±0.08 | 13.97±1.05 | 14.49±3.07 | 20.25±2.02 | 21.83±0.37 | 24.62±1.13 |
| ANP组 | 27.59±1.23 | 32.65±3.67 | 42.6±3.14 | 54.48±2.09 | 69.67±2.55 | 85.21±3.32 |
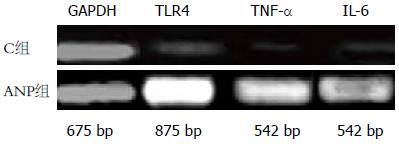
RT-PCR结果显示, C组回肠黏膜组织低表达TNF-α、IL-6及TLR4-mRNA(图1), ANP组TNF-α、IL-6及TLR4-mRNA的表达量明显增加, 同C组相比差异有统计学意义(P<0.05, 表3).
将所检测的TLR4 mRNA表达量分别与血浆内毒素及DAO水平进行相关性分析, TLR4的表达水平与肠黏膜DAO水平明显相关(r = -0.762, P = 0.028), 也与血浆内毒素相关(r = 0.778, P = 0.023).
近年来研究认为, 肠道是感染细菌的来源[6]. SAP时肠道BT和肠源性内毒素血症构成机体第二次打击, 导致胰腺组织继发感染和白细胞过度激活, 多种细胞因子释放, 导致炎症递质级联反应, 进一步诱发和加重SIRS及MODS等并发症[1]. 因此研究SAP时肠屏障损伤的因素及防治措施尤为重要.
DAO存在于哺乳动物类动物的黏膜或绒毛上层, 其中大部分存在于回肠黏膜绒毛, 且主要位于肠绒毛顶端细胞内. 坏死肠黏膜细胞脱落入肠腔, 使肠黏膜DAO活性降低; 当肠腔DAO进入肠细胞间隙淋巴管和血流, 血DAO水平则升高, 肠黏膜和血中DAO活性可反映肠上皮细胞完整性, 因此本实验通过检测肠黏膜和血中DAO变化反映肠道屏障功能状态[7].
远端小肠和结肠有大量细菌, 而内毒素是存在于革兰氏阴性细菌细胞壁内, 在细菌死后细胞壁崩解时释出, 活菌亦可以出胞形式释出内毒素[8]. 当肠屏障功能障碍时, 对病原微生物的阻止作用下降, 导致门静脉中内毒素大量增加, 循环血中出现可检出的内毒素, 称之为"内毒素血症(endotoxemia)"[9]. 因此, 血浆内毒素水平可作为评估肠黏膜通透性及肠屏障功能的客观指标. 本实验采用鲎试剂酶反应显色法检测血浆内毒素浓度, 结果发现, ANP组血浆内毒素水平明显高于C组.
肠道免疫屏障主要由肠道黏膜上皮的免疫相关组织(如Peyer结、MLN)、细胞(如树突状细胞、巨噬细胞、T细胞及B细胞等)和分子(抗原肽、免疫球蛋白、溶酶等)共同构成. 免疫系统的激活受到肠道上皮细胞屏障功能的调节, 以及由细胞因子所介导的肠道上皮细胞之间相互作用的调节[10]. SAP时肠上皮细胞屏障被破坏, 需要一个快速的宿主反应, 限制细菌及其产物到达黏膜, 这主要依靠肠道天然免疫系统[11]. 微生物引发一个宿主保护反应, 是通过激活一个进化上高度保守、原始的模式识别系统. 其中一类模式识别受体是病原体相关分子模式(pathogen-associated molecular pattern, PAMP), 该结构只有微生物中的病原体所产生, 非宿主所具有, 如革兰氏阴性菌种的LPS分子[12].
TLR属病原相关分子模式跨膜受体, 中性粒细胞、单核-巨噬细胞、肝脏枯否氏细胞、肠上皮细胞等均有该受体的表达, 他对病原体的识别、信号的传导、免疫反应激活中起重要作用[13]. 在TLR诸多成员中, TLR4是介导内毒素信号跨膜传导主要受体. 内毒素/TLR4/NF-κB信号传导途径是介导炎症反应重要的信号传导通路. 内毒素与TLR4结合后在辅助分子CD14和MD-2等的介导下激活NF-κB, 从而启动其下游细胞因子(如TNF-α, IL-6等)基因的转录表达, 介导炎症反应[14]. 本实验通过检测下游细胞因子TNF-α、IL-6-mRNA的转录表达, 从而间接探讨TLR4可能通过内毒素/TLR4/NF-κB信号传导途径致肠黏膜损伤.
TLR4介导信号转导途径致肠黏膜损伤是一个复杂过程, 牵涉多种信号分子和信号转导途径, 而且不同种类的内毒素, 不同的效应细胞机制都不尽相同, 同样体内和离体实验的结果都会有差异. 多种信号转导途径并不是孤立的, 很可能存在许多未被发现的分子, 使他们相互作用、相互影响, 而构成一个复杂的信号传递网络. 因此, TLR4参与SAP肠屏障功能障碍的具体机制有待于进一步研究.
Toll样受体4(TLR4)是天然免疫系统识别病原微生物的主要受体, 在天然免疫反应中具有重要的作用. TLR4可特异性识别细菌脂多糖(LPS), 在诱导细胞反应中具有关键作用.
郝建宇, 教授, 首都医科大学附属北京朝阳医院消化内科; 白雪巍, 副主任医师, 哈尔滨医科大学
SAP时肠道细胞易位(BT)和肠源性内毒素血症构成机体第二次打击, 导致胰腺组织继发感染和白细胞过度激活, 多种细胞因子释放, 导致炎症递质级联反应, 进一步诱发和加重SIRS及MODS等并发症. 因此研究SAP时肠屏障损伤的因素及防治措施尤为重要.
本实验通过检测下游细胞因子TNF-α、IL-6 mRNA的转录表达, 从而间接探讨TLR4可能通过内毒素/TLR4/NF-κB信号传导途径致肠黏膜损伤.
本研究采用大动物进行相关研究, 具有一定的创新性, 但例数较少, 可能对结果产生影响, 望继续增加例数进一步研究.
编辑: 李军亮 电编:鲁亚静
| 1. | Rotstein OD. Pathogenesis of multiple organ dysfunction syndrome: gut origin, protection, and decontamination. Surg Infect (Larchmt). 2000;1:217-223; discussion 223-225. [PubMed] [DOI] |
| 2. | Fritz S, Hackert T, Hartwig W, Rossmanith F, Strobel O, Schneider L, Will-Schweiger K, Kommerell M, Büchler MW, Werner J. Bacterial translocation and infected pancreatic necrosis in acute necrotizing pancreatitis derives from small bowel rather than from colon. Am J Surg. 2010;200:111-117. [PubMed] [DOI] |
| 3. | Buchholz BM, Bauer AJ. Membrane TLR signaling mechanisms in the gastrointestinal tract during sepsis. Neurogastroenterol Motil. 2010;22:232-245. [PubMed] [DOI] |
| 4. | Moue M, Tohno M, Shimazu T, Kido T, Aso H, Saito T, Kitazawa H. Toll-like receptor 4 and cytokine expression involved in functional immune response in an originally established porcine intestinal epitheliocyte cell line. Biochim Biophys Acta. 2008;1780:134-144. [PubMed] |
| 5. | Chan YC, Leung PS. Acute pancreatitis: animal models and recent advances in basic research. Pancreas. 2007;34:1-14. [PubMed] [DOI] |
| 6. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 7. | Goto T, Matsubara T, Yoshizawa Y, Sasaya S, Nemoto H, Sanada Y, Moriyama K, Kouchi Y. [Diamine oxidase as blood biomarker in rats and humans to GI tract toxicity of fluorouracil anti-cancer drugs]. Gan To Kagaku Ryoho. 2011;38:765-769. [PubMed] |
| 9. | Sharma B, Srivastava S, Singh N, Sachdev V, Kapur S, Saraya A. Role of probiotics on gut permeability and endotoxemia in patients with acute pancreatitis: a double-blind randomized controlled trial. J Clin Gastroenterol. 2011;45:442-448. [PubMed] [DOI] |
| 10. | Yuan Q, Walker WA. Innate immunity of the gut: mucosal defense in health and disease. J Pediatr Gastroenterol Nutr. 2004;38:463-473. [PubMed] [DOI] |
| 11. | Bailey M, Haverson K, Inman C, Harris C, Jones P, Corfield G, Miller B, Stokes C. The development of the mucosal immune system pre- and post-weaning: balancing regulatory and effector function. Proc Nutr Soc. 2005;64:451-457. [PubMed] [DOI] |
| 12. | Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell. 2006;124:783-801. [PubMed] [DOI] |
| 13. | Alvarez B, Revilla C, Chamorro S, López-Fraga M, Alonso F, Domínguez J, Ezquerra A. Molecular cloning, characterization and tissue expression of porcine Toll-like receptor 4. Dev Comp Immunol. 2006;30:345-355. [PubMed] [DOI] |