修回日期: 2012-03-13
接受日期: 2012-04-19
在线出版日期: 2012-05-28
目的: 探讨miR-451对食管癌EC9706细胞增殖、凋亡及侵袭能力的影响.
方法: 化学合成miR-451 mimics, 脂质体包裹转染EC9706细胞为miR-451组, 同时设立无关序列(Scramble-miR)对照组、脂质体对照组和空白对照组. 转染后48 h, 荧光定量RT-PCR检测miR-451表达量的变化, Western blot检测Bcl-2、AKT和磷酸化AKT蛋白表达水平, 流式细胞仪检测细胞凋亡情况, Transwell侵袭实验检测细胞侵袭能力的改变; MTT法检测转染后l、2、3、4、5、6 d各组细胞增殖率.
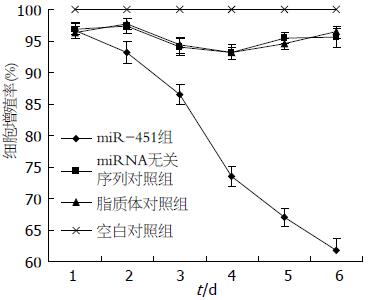
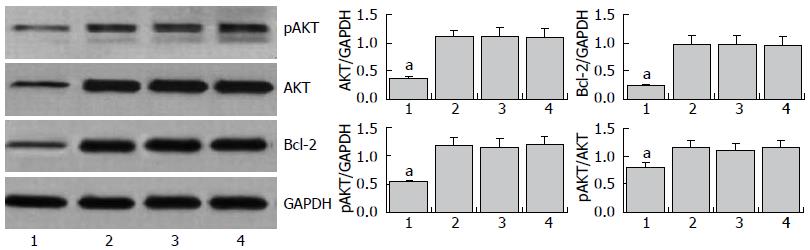
结果: miR-451组的miR-451表达水平显著上调(P<0.01, F = 69.26), 为空白对照组的15.84倍; miR-451组细胞Bcl-2、AKT和磷酸化AKT蛋白表达均显著下调(P<0.05, F = 5.83); miR-451组细胞凋亡率为12.07%±1.12%, 与3个对照组比较显著升高(P<0.01, F = 26.72); miR-451组平均侵袭细胞数为47.4±7.4, 与3个对照组比较显著降低(P<0.01, F = 34.55). miR-451组细胞的生长在转染后2 d出现显著抑制(P<0.05, F = 5.95), 并且随时间的延长而日益显著.
结论: 上调miR-451表达可抑制食管癌EC9706细胞增殖和侵袭, 促进细胞凋亡.
引文著录: 冷弘, 臧文巧, 王涛, 王媛媛, 马晶, 赵国强. miR-451对食管癌EC9706细胞增殖、凋亡及侵袭能力的影响. 世界华人消化杂志 2012; 20(15): 1323-1327
Revised: March 13, 2012
Accepted: April 19, 2012
Published online: May 28, 2012
AIM: To explore the effect of overexpression of miR-451 on cell proliferation, apoptosis and invasion in human esophageal carcinoma cell line EC9706.
METHODS: MiR-451 mimics were constructed and transfected into EC9706 cells using LipofectamineTM2000. EC9706 cells transfected with Scramble-miR, empty liposomes or negative miR-451 were used as controls. Forty-eight hours after transfection, the expression of miR-451 was detected by RT-PCR, and the expression of Bcl-2, AKT and phosphorylated AKT proteins were detected by Western blot. Cell apoptosis, invasion and proliferation were assessed by flow cytometry, transwell assay and MTT assay, respectively.
RESULTS: Compared to control cells, the expression of miR-451 was significantly up-regulated (P < 0.01, F = 69.26); the expression of Bcl-2, AKT and phosphorylated AKT proteins was significantly down-regulated (P < 0.05, F = 5.83); cell apoptosis rate significantly increased (P < 0.01, F = 26.72); the average number of cells penetrating Matrigel membrane significantly decreased (P < 0.01, F = 34.55); and cell proliferation was significantly suppressed in a time-dependent manner (P < 0.05, F = 5.95) in EC9706 cells transfected with miR-451 mimics.
CONCLUSION: Over-expression of miR-451 induces apoptosis and suppresses cell proliferation and invasion in human esophageal carcinoma cell line EC9706.
- Citation: Leng H, Zang WQ, Wang T, Wang YY, Ma J, Zhao GQ. Overexpression of miR-451 inhibits cell proliferation and invasion and promotes apoptosis in human esophageal carcinoma cell line EC9706. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1323-1327
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1323.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1323
肿瘤是目前对人类生命和健康危害最严重的疾病之一, 但其发生发展的确切机制仍未完全阐明. 非蛋白质编码微小RNA(microRNA, miRNA)的发现为肿瘤研究提供了新的思路. miRNA是真核细胞内源性非编码的单链小分子、由约22个核苷酸组成、参与转录后基因调控, 可特异性识别靶mRNA的3'UTR并与之结合, 引起靶mRNA的降解或翻译抑制, 从而对基因进行转录后表达调控, 参与调节细胞活动, 具有重要的生理及病理意义[1,2]. 近期有研究显示, miR-451在食管癌中表达下调[3], 但miR-451在食管癌中的具体作用仍然不明确. 为此, 本研究利用合成的miR-451转染食管癌EC9706细胞, 探讨和分析miR-451对食管癌细胞增殖、凋亡、侵袭能力的影响.
人食管癌细胞株EC9706由郑州大学基础医学院保存; RPMI 1640培养基、胎牛血清购自Gibco BRL公司; LipofectamineTM2000、TRIzol购自Invitrogen公司; MIT购自Sigma公司; Annexi V细胞凋亡检测试剂盒购自Abcam公司; Matrigel购自BD公司; Transwell板购自Corning公司; miR-451 qPCR Quantitation Kit购自上海吉玛制药技术有限公司; miR-451 mimics(5'-AAACCGUUACCAUUACUGAGUU-3', 3'-CUCAGUAAUGGUAACGGUUUUU-5'), miRNA无关序列对照(5'-UUCUCCGAACGUGUCACGUTT-3', 3'-TTAAGAGGCUUGCACAGUGCA -5'), 购自上海生工生物有限公司; Aktl、p27和GAPDH抗体购自Santa Cruz公司.
1.2.1 实验分组和miR-451转染: 将食管癌EC9706细胞用含100 mL/L胎牛血清的RPMI 1640培养基, 37 ℃、50 mL/L CO2、饱和湿度条件培养. 选用对数生长期细胞按照实验分组分别进行脂质体转染. (1)miR-451组, 加入miR-451 mimics 100 nmol/L和脂质体; (2)miRNA无关序列对照组, 加入miR scramble 100 nmol/L和脂质体; (3)脂质体对照组, 仅加入脂质体; (4)空白对照组, 无任何转染. 转染后培养6 h, 换含100 mL/L胎牛血清的RPMI 1640完全培养基, 37 ℃、50 mL/L CO2、饱和湿度条件培养48 h, 收集细胞进行各项检测.
1.2.2 荧光定量RT-PCR检测: 采用TRIzol试剂提取各组细胞总RNA, 使用miR-451 qPCR Quantitation Kit进行逆转录和PCR扩增, 该试剂盒内有茎环结构样的miR-451特异逆转录引物, 他能与miRNA的3'端结合并使逆转录, 避免miRNA前体的干扰, 反转录反应体系为: 5×RT buffer 4 μL, 4×dNTP 1 μL, miR-RT primer 1 μL, M-MLV 0.5 μL, 总RNA 1 μL, RNaseFree H2O补足20 μL. 逆转录反应程序: 37 ℃ 60 min, 85 ℃ 10 min. PCR扩增体系为: 2×Real-time PCR buffer 20 μL, miR specific primer set 1 μL, miRNA逆转录产物1 μL, Taq酶0.2 μL, ddH2O补足40 μL. 定量PCR反应程序: 95 ℃ 3 min预变性; 95 ℃ 15 s, 65 ℃ 45 s, 40个循环. 所有反应均设3个复孔, 以U6作为内参, 记录Ct值, 各组间miR-451相对定量的倍数(relative fold, RF)用2-△△Ct值表示.
1.2.3 MTT检测细胞增殖: 胰酶消化对数生长期的EC9706细胞, 按104个细胞/孔接种于96孔培养板(200 μL/孔), 接种12 h后, 常规转染; 分别于接种后l、2、3、4、5、6 d, 每孔中加入MTT溶液20 μL(5 g/L), 37 ℃条件下再培养4 h, 弃上清, 每孔加DMSO 200 μL, 振摇20 min; 570 nm波长下, 用紫外分光光度计测定各孔吸光度(A)值, 每组设6个复孔; 计算各组细胞增殖率(细胞增殖率 = 转染细胞A值/空白对照细胞A值×100%)
1.2.4 细胞凋亡检测: 将转染后48 h的各组细胞用胰酶充分消化成单细胞悬液, 4 ℃ 1 000 r/min离心5 min, 弃上清, PBS洗涤, 调整细胞密度为1×106/mL. 按照Annexin V/PI试剂盒说明书进行染色, 使用流式细胞仪检测细胞凋亡情况, 每组细胞重复检测3次.
1.2.5 Transwell实验: 按照Corning公司Transwell小室说明书操作, 制备细胞悬液, 加于Transwell小室(每孔200 µL培养液, 1×105细胞). 24孔板下室加入500 µL含FBS或趋化因子的培养基. 常规培养48 h, 结晶紫染色, 显微镜观察和拍照, 随机选5个视野, 计数取平均值.
1.2.6 Western blot检测蛋白表达: 收集各组细胞, 制备细胞总蛋白, SDS-PAGE凝胶电泳. 电转移的方法将蛋白质转移到硝酸纤维素膜上, 以AKT蛋白抗体为一抗, 辣根过氧化物酶标记的山羊抗鼠IgG抗体为二抗检测AKT蛋白、磷酸化AKT、Bcl-2蛋白的表达, 以GAPDH为内参照.
统计学处理 实验数据使用SPSS17.0统计软件包, 多项指标间单采用因素方差分析, 两指标间进一步比较采用LSD-t检验; 按照P<0.05作为检验水准.
各实验组实时定量荧光PCR检测数值见表1, 其中miR-451组的miR-451表达水平显著上调(P<0.01), 为空白对照组的15.84倍; 而miRNA无关序列对照组和脂质体对照组的miR-451表达水平无显著改变(P>0.05).
与空白对照组比较, 转染后l、2、3、4、5、6 d, 脂质体对照组和miRNA无关序列对照组细胞的生长未受到显著抑制(P>0.05), 而miR-451组细胞的生长在转染后2 d后出现显著抑制(P<0.05), 并且随时间的延长而日益显著(图1).
AnnexinV/Pl染色方法检测空白对照组、脂质体对照组和miRNA无关序列对照组细胞的凋亡率分别为4.81%±1.20%、4.33%±2.89%、4.60%±2.63%; miR-451组细胞凋亡率为12.07%±1.12%, 与空白对照组、脂质体对照组和miRNA无关序列对照组细胞的凋亡率比较显著升高, 差异均有显著性(P<0.05).
空白对照组、脂质体对照组和miRNA无关序列对照组视野平均侵袭细胞数分别为106.2±15.7、105.6±13.7和108.8±10.1; miR-451组视野平均侵袭细胞数为47.4±7.4, 与3个对照组比较显著降低, 差异有显著性(P<0.01).
空白对照组、脂质体对照组和miRNA无关序列对照组细胞Bcl-2、AKT和磷酸化AKT蛋白表达一致, 差异无显著性(P<0.05); 而miR-451组与3个对照组比较均显著下调, 差异有显著性(P<0.05, 图2).
miR-451是Altuvia等[4]在2005年利用生物信息学方法发现和命名, miR-451位于染色体17qll.2, 与miR-144相邻. 目前认为miR-451的主要功能是参与造血系统分化、胚胎成熟、上皮细胞极性的形成和神经系统发育. 新近研究发现, miR-451与多种肿瘤密切相关, 不仅在肿瘤组织中表达异常, 而且还显示其参与某些肿瘤的生物学行为和药耐基因的调控.
2009年, Bandres等[5]采用实时定量PCR方法检测21例胃癌组织中miRNAs表达, 并分析其与临床病理的关系, 结果显示胃癌和结肠癌上皮细胞的miR-451表达降低; 分析发现miR-451与预后不良相关; 胃癌细胞AGS和结肠癌上皮细胞DLD1转染miR-451能降低细胞扩增及增加放射敏感性. Hui等[6]采用实时定量PCR方法对51例头部和颈部鳞状细胞癌标本和3个头颈部鳞癌细胞株进行miRNA表达谱检测, 并分析临床病理相关性, 发现miR-451是唯一显著高表达的miRNA, 复发患者比未复发患者高4.7倍. Wang等[7]用miRNA芯片检测非小细胞肺癌(non-small cell lung cancer, NSCLC)组织miRNAs表达谱, 发现miR-451下调最显著, 在NSCLC中miR-451表达与肿瘤分化、病理分期及淋巴结转移相关; 高表达miR-451可显著抑制NSCLC体外增殖、集落形成和裸鼠移植瘤生长. Heinzelmann等[8]研究证实肾透明细胞癌中miR-451表达显著降低. 刘辉等[3]采用AgilentTM高通量的microRNA微阵列芯片对食管癌组织及其癌旁组织的miRNA表达的差异进行分析, 结果显示包括miR-451在内的8个miRNA表达显著下调. Zhu等[9]研究显示, 在多药耐药卵巢癌细胞系A2780DX5中miR-27a和miR-451表达上调. 用miR-27a和miR-451的抑制剂antagomirs处理A2780DX5细胞后, 可有效增加细胞对毒药物的敏感性. Bian等[10]研究发现NSCLC中miR-451过表达能显著抑制A549细胞的增长并诱导凋亡, 此外, miR-451能增加A549细胞对顺铂化疗的敏感性, 提出顺铂联合miR-451可能是NSCLC治疗的潜在策略.
目前发表的文献资料显示, miR-451在胃癌、非小细胞肺癌、结肠癌、胶质瘤、肾透明细胞癌、食管癌中表达下调, 而在头部和颈部鳞状细胞癌、多药耐药卵巢癌中表达上调. 由于1个miRNA可以调控多个基因, 不同的miRNA分子也可以协同调控同1个基因; 在机体内, miRNA与其靶标基因之间实际上是一个复杂的调控网络, 控制细胞及个体的重要生命活动. 因此, 在不同类型肿瘤中miR-451的表达水平和作用也可能是不同的. 本实验结果显示上调食管癌EC9706细胞中miR-451表达, 可有效抑制食管癌EC9706细胞的增殖和侵袭能力, 并且促进细胞的凋亡. 该结果与Tian等[11]在恶性胶质瘤细胞系和吴春蓉等[12]在肠癌细胞系的实验结果一致.
PI3K/AKT是与细胞增殖和细胞凋亡关系最密切的信号传导通路之一[13,14]. 生理状态下, AKT以低活性或失活状态存在于细胞浆; 当暴露于各刺激因素时, AKT在PI3K调节作用下发生磷酸化而激活, 激活的AKT与相应部位的底物蛋白作用, 使底物蛋白磷酸化, 导致细胞存活/增殖, 并保护细胞逃避凋亡[15-18]. 本实验Western blot证实在上调miR-451表达的食管癌EC9706细胞中, Bcl-2、AKT和磷酸化AKT蛋白表达均降低, 并且磷酸化AKT蛋白在总AKT蛋白中所占的比例亦降低. 提示上调miR-451表达可抑制食管癌EC9706细胞增殖和侵袭、促进细胞凋亡, 该作用可能是通过PI3K/Akt信号传导通路实现的, 有待进一步研究证明.
miRNA对细胞的增殖、分化和凋亡有重要的调节作用, 他们在正常组织和肿瘤组织中的表达显著不同. 近期的研究发现, 一些miRNA在肿瘤细胞中表达明显减少, 提示着这些分子可能作为抑癌分子.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
本研究利用合成的miR-451转染入食管癌EC9706细胞, 发现上调miR-451表达可抑制食管癌EC9706细胞增殖和侵袭、促进细胞凋亡.
选题有一定的创新性, 为食管癌以及其他肿瘤的临床诊治提供了一定的参考.
编辑: 张姗姗 电编:闫晋利
| 1. | Esteller M. Non-coding RNAs in human disease. Nat Rev Genet. 2011;12:861-874. [PubMed] [DOI] |
| 2. | Tie J, Fan D. Big roles of microRNAs in tumorigenesis and tumor development. Histol Histopathol. 2011;26:1353-1361. [PubMed] |
| 3. | 刘 辉, 刘 冉, 苏 耀耀, 杨 淼, 浦 跃朴, 尹 立红, 王 仪, 潘 恩春, 郭 伟, 尤 振兵. 淮安食管鳞癌与癌旁组织中差异表达microRNAs的初步分析. 癌变畸变突变. 2011;22:418-422. |
| 4. | Altuvia Y, Landgraf P, Lithwick G, Elefant N, Pfeffer S, Aravin A, Brownstein MJ, Tuschl T, Margalit H. Clustering and conservation patterns of human microRNAs. Nucleic Acids Res. 2005;33:2697-2706. [PubMed] [DOI] |
| 5. | Bandres E, Bitarte N, Arias F, Agorreta J, Fortes P, Agirre X, Zarate R, Diaz-Gonzalez JA, Ramirez N, Sola JJ. microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells. Clin Cancer Res. 2009;15:2281-2290. [PubMed] [DOI] |
| 6. | Hui AB, Lenarduzzi M, Krushel T, Waldron L, Pintilie M, Shi W, Perez-Ordonez B, Jurisica I, O'Sullivan B, Waldron J. Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas. Clin Cancer Res. 2010;16:1129-1139. [PubMed] [DOI] |
| 7. | Wang R, Wang ZX, Yang JS, Pan X, De W, Chen LB. MicroRNA-451 functions as a tumor suppressor in human non-small cell lung cancer by targeting ras-related protein 14 (RAB14). Oncogene. 2011;30:2644-2658. [PubMed] [DOI] |
| 8. | Heinzelmann J, Henning B, Sanjmyatav J, Posorski N, Steiner T, Wunderlich H, Gajda MR, Junker K. Specific miRNA signatures are associated with metastasis and poor prognosis in clear cell renal cell carcinoma. World J Urol. 2011;29:367-373. [PubMed] [DOI] |
| 9. | Zhu H, Wu H, Liu X, Evans BR, Medina DJ, Liu CG, Yang JM. Role of MicroRNA miR-27a and miR-451 in the regulation of MDR1/P-glycoprotein expression in human cancer cells. Biochem Pharmacol. 2008;76:582-588. [PubMed] [DOI] |
| 10. | Bian HB, Pan X, Yang JS, Wang ZX, De W. Upregulation of microRNA-451 increases cisplatin sensitivity of non-small cell lung cancer cell line (A549). J Exp Clin Cancer Res. 2011;30:20. [PubMed] [DOI] |
| 11. | Tian Y, Nan Y, Han L, Zhang A, Wang G, Jia Z, Hao J, Pu P, Zhong Y, Kang C. MicroRNA miR-451 downregulates the PI3K/AKT pathway through CAB39 in human glioma. Int J Oncol. 2012;40:1105-1112. [PubMed] |
| 13. | Zhang G, He B, Weber GF. Growth factor signaling induces metastasis genes in transformed cells: molecular connection between Akt kinase and osteopontin in breast cancer. Mol Cell Biol. 2003;23:6507-6519. [PubMed] [DOI] |
| 14. | Skurk C, Maatz H, Rocnik E, Bialik A, Force T, Walsh K. Glycogen-Synthase Kinase3beta/beta-catenin axis promotes angiogenesis through activation of vascular endothelial growth factor signaling in endothelial cells. Circ Res. 2005;96:308-318. [PubMed] [DOI] |
| 15. | Tokunaga E, Oki E, Egashira A, Sadanaga N, Morita M, Kakeji Y, Maehara Y. Deregulation of the Akt pathway in human cancer. Curr Cancer Drug Targets. 2008;8:27-36. [PubMed] [DOI] |
| 16. | Duronio V. The life of a cell: apoptosis regulation by the PI3K/PKB pathway. Biochem J. 2008;415:333-344. [PubMed] [DOI] |
| 17. | Ni L, Feng Y, Wan H, Ma Q, Fan L, Qian Y, Li Q, Xiang Y, Gao B. Angiotensin-(1-7) inhibits the migration and invasion of A549 human lung adenocarcinoma cells through inactivation of the PI3K/Akt and MAPK signaling pathways. Oncol Rep. 2012;27:783-790. [PubMed] |
| 18. | Engelman JA. Targeting PI3K signalling in cancer: opportunities, challenges and limitations. Nat Rev Cancer. 2009;9:550-562. [PubMed] [DOI] |