修回日期: 2012-03-13
接受日期: 2012-04-19
在线出版日期: 2012-05-28
目的: 探讨凋亡抑制蛋白Livin和细胞周期蛋白D1(CyclinD1)在慢性萎缩性胃炎(chronic atrophic gastritis, CAG)伴肠化癌变过程中的表达及其相关性.
方法: 应用免疫组织化学染色S-P法检测Livin和CyclinD1在30例慢性浅表性胃炎(chronic superficial gastritis, CSG)、35例CAG非肠化、35例CAG伴肠化、30例胃癌组织中的表达, 并同时研究2者在CAG伴肠化癌变中表达的相关性.
结果: 在CSG、CAG非肠化、CAG伴肠化、胃癌中Livin、CyclinD1的阳性表达率分别为: 0%、10%; 28.57%、14.29%; 45.71%、37.14%; 66.67%、53.33%, 2者在CAG(非肠化)和CSG对比均有统计学意义(P<0.05); CAG(伴肠化)与CAG(非肠化)相比, CyclinD1的阳性表达率有统计学意义(P<0.05); Livin和CyclinD1在CAG伴肠化、胃癌组织中表达呈正相关.
结论: Livin、CyclinD1蛋白在CAG(伴肠化)和胃癌组织中表达呈上调状态, 且CAG(伴肠化)和胃癌组织间无显著差异, 2者表达一致, 提示CAG(伴肠化)已具有癌变的分子生物学特征. 2者在胃癌的发生、发展中起协同作用, 对其进行联合检测将有助于胃癌的早期诊断.
引文著录: 陈吉, 崔宏, 高美丽, 崔琴. Livin和CyclinD1在慢性萎缩性胃炎伴肠化黏膜中的表达及意义. 世界华人消化杂志 2012; 20(15): 1301-1306
Revised: March 13, 2012
Accepted: April 19, 2012
Published online: May 28, 2012
AIM: To investigate the expression of livin and cyclinD1 in chronic atrophic gastritis with intestinal metaplasia.
METHODS: Immunohistochemistry was used to examine the expression of livin and cyclin D1 in 30 cases of chronic superficial gastritis, 35 cases of atrophic gastritis without intestinal metaplasia, 35 cases of atrophic gastritis with intestinal metaplasia, and 30 cases of gastric carcinoma. We also explored the correlation between livin and cyclin D1 expression in chronic atrophic gastritis and gastric carcinoma.
RESULTS: The positive rates of livin expression in the specimens of chronic superficial gastritis, atrophic gastritis without intestinal metaplasia, atrophic gastritis with intestinal metaplasia, and gastric carcinoma were 0%, 28.57%, 45.71% and 66.67%, respectively, and the corresponding rates for cyclin D1 expression were 10%, 14.29%, 37.14% and 53.33%. The positive rates of livin and cyclinD1 expression were significantly higher in atrophic gastritis with intestinal metaplasia than in chronic superficial gastritis (both P < 0.05). The expression of cyclin D1 differed significantly between atrophic gastritis with and without intestinal metaplasia (P < 0.05). The expression of livin has a positive correlation with that of cyclin D1 in atrophic gastritis with intestinal metaplasia and gastric carcinoma.
CONCLUSION: The positive rates of livin and cyclin D1 expression increase in atrophic gastritis with intestinal metaplasia and gastric carcinoma. No significant difference was observed for the expression of livin and cyclin D1 between atrophic gastritis with intestinal metaplasia and gastric carcinoma. Livin and cyclin D1 may play a very important role in the development of gastric carcinoma and be used as markers for early diagnosis of gastric carcinoma.
- Citation: Chen J, Cui H, Gao ML, Cui Q. Clinical significance of expression of livin and cyclin D1 in chronic atrophic gastritis with intestinal metaplasia. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1301-1306
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1301.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1301
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是消化系统常见病, 在此基础上伴有的不完全型肠上皮化生和/或中重度不典型增生被视为癌前病变, 1978年WHO将其列为胃癌癌前状态[1]. 其中CAG(伴肠化)在人群中十分普遍, 65岁以上老年患者肠化率达90%以上[2], 其癌变过程中往往涉及到细胞凋亡受抑制及多种癌基因的激活. Livin是凋亡抑制蛋白家族新成员[3], 因其抗凋亡活性最强, 故己成为当今研究的热点[4,5]. 细胞周期蛋白D1(CyclinD1)是细胞周期G1/S期转化的正向调节因子, 其过度表达导致细胞增殖失控, 从而形成癌变. 大量研究表明, Livin、CyclinD1表达上调能促进肿瘤发生, 但在癌前病变中同时检测这2个因子的表达及其相关性国内未见报道. 本课题研究为了探讨Livin、CyclinD1二者在CAG伴肠化癌变过程中的作用及其相互关系, 并为CAG伴肠化早期癌变的发病过程提供临床诊断依据.
石蜡切片机(LEICA RM2025, 德国), 三用恒温水浴箱(HHW21 Cu60, 上海), 电热恒温干燥箱(Limon公司, 上海), 光学显微镜(Olympus, 日本), 组织包埋机(BMJ-Ⅲ, 常州), 北航图像中心Cmais真彩色病理图像分析系统.
1.2.1 免疫组织化学染色: 所有标本石蜡切片均经二甲苯脱蜡, 梯度乙醇水化, 抗原修复, 滴加过氧化物酶阻断液, 室温下孵育10 min, PBS冲洗, 滴加一抗, 室温下孵育60 min, PBS冲洗, 滴加聚合物增强剂, 室温下孵育10 min, 滴加酶标抗鼠/兔聚合物, 室温下孵育10 min, 二氨基联苯胺(DAB)显色, 苏木素复染, 脱水, 透明, 封片, 光镜下组织学观察并摄片. 以PBS代替一抗作为阴性对照, 阳性对照片以福州迈新生物技术开发有限公司所赠样片为准.
1.2.2 Livin、CyclinD1蛋白判定标准[6]: Livin免疫组织化学阳性产物呈棕黄色颗粒, 定位于细胞浆内. CyclinD1蛋白免疫组织化学阳性产物呈棕黄色颗粒, 定位于细胞核. 采用半定量积分法判定结果, 每张切片随机选5个高倍视野观察, 计数100个细胞, 阳性细胞数≤5%, 0分; 6%-25%, 1分; 26%-50%, 2分; 51%-75%, 3分; >75%, 4分. 根据免疫阳性细胞染色程度, 黄色为1分, 棕黄色为2分, 棕褐色为3分. 综合评分由两类积分相乘, 0-1分为阴性(-), 2-6分为阳性(+), 8-12分为强阳性(++).
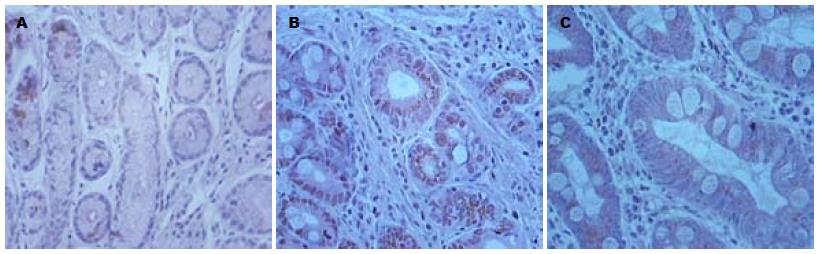
Livin定位于CAG(非肠化、伴肠化)、胃癌组织的细胞浆中, 其免疫阳性产物为棕黄色. CAG伴肠化组织中Livin表达较慢性浅表性胃炎组织明显增加, 差别有统计学意义(χ2 = 20.741, P = 0.000), 与CAG非肠化组比较无统计学意义(χ2 =2.203, P = 0.138), 与胃癌组比较无统计学意义(χ2 = 2.870, P = 0.090); CAG非肠化组织中Livin表达与慢性浅表性胃炎比较有统计学意义(χ2 = 10.130, P = 0.001), 与胃癌比较有统计学意义(χ2 = 9.433, P = 0.002, 表1, 图1).
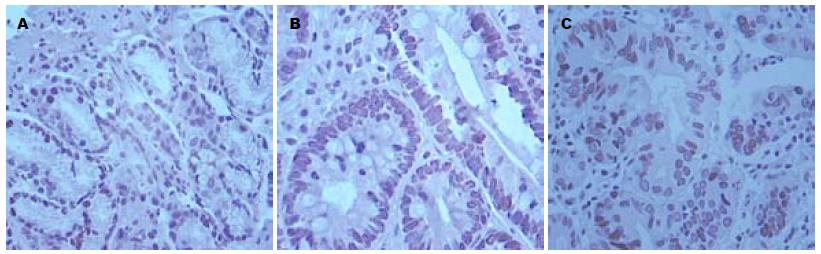
CyclinD1定位于CAG(非肠化、伴肠化)、胃癌组织的细胞核中, 其免疫阳性产物为棕黄色. CAG伴肠化组织中CyclinD1表达与慢性浅表性胃炎组相比有统计学意义(χ2 = 6.414, P = 0.011), 与CAG非肠化组比较有统计学意义(χ2 = 4.786, P = 0.029), 与胃癌组比较无统计学意义(χ2 = 1.714, P = 0.191); CAG非肠化组织中CyclinD1表达与慢性浅表性胃炎组比较无统计学意义(χ2 = 0.275, P = 0.600), 与胃癌组比较有统计学意义(χ2 = 11.262, P = 0.001, 表2, 图2).
16例Livin阳性CAG伴肠化组织中, CyclinD1阳性者11例(68.75%), 19例Livin阴性CAG伴肠化组织中, CyclinD1阳性者2例(10.53%), 两者之间有统计学意义, 并且呈正相关(rs = 0.60, P = 0.001). 在20例Livin阳性胃癌组织中, CyclinD1阳性者14例(70%), 10例Livin阴性胃癌组织中, CyclinD1阳性者2例(20%), 两者之间有统计学意义, 并且呈正相关(rs = 0.47, P = 0.019, 表3).
| 分组 | n | Livin表达强度 | CyclinD1表达强度 | |||
| + | - | + | - | |||
| CAG | ||||||
| 伴肠化 | 35 | 16 | 19 | 22 | 13 | rs = 0.60, P<0.05 |
| 胃癌 | 30 | 20 | 10 | 14 | 16 | rs = 0.47, P<0.05 |
CAG是我国常见的慢性胃黏膜病变, 其组织学特点表现为胃黏膜的慢性炎症和胃腺体细胞的丢失. 目前普遍认为萎缩性胃炎与肠型胃癌关系密切, 越来越受到医疗界的重视, 为目前研究的热点[7]. WHO已将其定义为胃癌前疾病[1], 特别是伴有肠上皮化生和不典型增生患者癌变的危险性更大[8]. 在CAG伴肠化癌变过程中, 涉及多种癌基因异常表达、抑癌基因的缺失、凋亡抑制蛋白的过度表达[9,10]. 胃癌仍然是目前世界上最常见的恶性肿瘤之一, 占据肿瘤死亡率的第2位[11]. 国内外均有学者提出[12],Ⅰ级预防胃癌的发生, 可在胃癌癌前阶段就予以干预逆转治疗. 因此深入了解胃癌癌前病变, 有可能为胃癌的Ⅰ级预防提供科学依据.
近年的研究证实, 肿瘤不仅是增殖异常的疾病, 同时也是凋亡异常的疾病, 肿瘤的发生和失控性生长是肿瘤细胞增殖和细胞凋亡2个过程共同作用的结果, 细胞凋亡与肿瘤的关系已受到普遍关注[13].
细胞凋亡参与肿瘤的起始过程, 并对肿瘤发生起负调控作用. 凋亡障碍是肿瘤发生的一个重要基础[14], Livin是新近发现的人类凋亡抑制蛋白(inhibitor of apoptosis proteins, IAP)家族的新成员. 有研究结果显示, Livin蛋白在除胎盘外的正常成年人组织中低表达或不表达, 而在结肠癌、膀胱癌、非小细胞肺癌、胃癌、食管癌等恶性肿瘤中高表达[15-20]. 提示该基因可能在肿瘤的发生、发展中起重要的作用. 本研究发现Livin在不同的胃黏膜病变中表达不同, 随着胃黏膜病变加重, 其表达增加, 在CAG、胃癌中Livin阳性表达率依次递增, 但Livin在慢性浅表性胃炎组织中无表达, 与李梅的研究结果一致, 这表明在CSG逐渐演变到癌前病变, 最后到癌的这一过程中, 细胞凋亡受到抑制, 从而促进肿瘤细胞的增殖. 本研究结果提示CAG伴肠化中Livin蛋白表达增加, 如能在此阶段控制Livin蛋白的表达, 可阻止其向癌变方向发展. Livin蛋白在CAG(伴肠化)和胃癌组织中表达呈上调状态, 且CAG(伴肠化)和胃癌组织间无显著差异, 二者表达一致, 提示CAG(伴肠化)已具有癌变的分子生物学特征.
细胞周期失控是细胞异常增殖而导致癌变的重要原因, 细胞周期的不同时期有不同的细胞蛋白控制, 原癌基因CyclinD1合成于G1早期, 是细胞增殖G1-S期的重要控件[21]. 其调控机制主要是通过对RB蛋白的灭活而释放E2F, 以启动S期相关基因的转录, 使其渡过G1-S调控点进入S期[22].
有研究者认为[23,24], CyclinD1与正常组织细胞的增殖密切相关, 还有资料表明, CyclinD1的扩增、过表达与人体多种肿瘤有关[25]. 1994年Hinds等[26]证实了CyclinD1有致癌作用. 国内外相继报道[27-29], 在肺癌、乳腺癌、食管癌、肝癌、胃癌等多种恶性肿瘤中发现存在CyclinD1基因扩增、重排及过表达. 本实验结果提示, 各组样本中均有不同程度的CyclinD1蛋白表达, 在CAG伴肠化、胃癌组织中过度表达, 且在2组间表达一致, 与高绍芳[30]的报道一致, 并且CAG伴肠化组与非肠化组之间有显著性差异(P<0.05). 随着病变从CSG-CAG-肠化-癌的进展, CyclinD1阳性表达率逐渐升高, 与文献报道一致, 提示CyclinD1基因的扩增可能发生在胃黏膜上皮癌变的早期阶段, 是重要的胃癌促发因素, 这也意味着该基因可能作为一个潜在的胃癌早期诊断分子标志. 因此, CyclinD1可能是肿瘤形成的早期分子事件, 是促进肿瘤生长的关键性控件之一. CyclinD1蛋白的检测可能对于CAG伴肠化及早期胃癌的诊断有参考价值.
总之, Livin和CyclinD1蛋白的高表达可能与胃癌的发生、发展密切相关, 2者的异常表达在胃癌的演进中可能发挥着不同的作用. 如果对Livin和CyclinD1蛋白在胃癌癌前病变中进行监测, 将有助于筛选出胃癌高危患者. 如能通过检测早期分子事件, 可提高胃癌的早期检出率, 同时还可为胃癌的预防、预后评价以及治疗提供潜在的分子标志, 为将来胃癌在分子靶向治疗的应用提供了重要的理论依据. 对CAG伴肠化患者进行常规检测, 对其阳性的病例应密切随访, 必要时进行积极治疗, 有效预防胃癌发生.
大量研究表明, Livin、CyclinD1表达上调能促进肿瘤的发生, 但在癌前病变中同时检测这2个因子的表达及其相关性国内未见报道.
高泽立, 副教授, 上海交大医学院九院周浦分院
大量研究报道, Livin、CyclinD1在食管癌、胃癌、肝癌等多种恶性肿瘤中高表达, 但在胃癌癌前病变中的研究甚少, 且二者在胃癌癌前病变中的表达存在争议, 需进一步探讨、研究.
本研究发现, Livin和CyclinD1在胃癌的发生、发展中起协同作用, 对其进行联合检测将有助于胃癌的早期诊断, 有可能为胃癌的Ⅰ级预防提供科学依据.
凋亡抑制因子(IAP): 是一类高度保守的内源性抗凋亡基因家族表达产物, 含特有的BIR结构域和RING结构域.
本文选题确切, 统计方法得当, 结合当前常见病和多发病, 提出检测Livin、CyclinD1蛋白可能成为胃癌早期诊断的客观指标, 具有较好的临床参考价值.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Genta RM. Atrophy and atrophic gastritis: one step beyond the Sydney system. Ital J Gastroenterol Hepatol. 1998;30 Suppl 3:S273-S275. [PubMed] |
| 4. | Yagihashi A, Asanuma K, Kobayashi D, Tsuji N, Shijubo Y, Abe S, Hirohashi Y, Torigoe T, Sato N, Watanabe N. Detection of autoantibodies to livin and survivin in Sera from lung cancer patients. Lung Cancer. 2005;48:217-221. [PubMed] [DOI] |
| 5. | Gazzaniga P, Gradilone A, Giuliani L, Gandini O, Silvestri I, Nofroni I, Saccani G, Frati L, Aglianò AM. Expression and prognostic significance of LIVIN, SURVIVIN and other apoptosis-related genes in the progression of superficial bladder cancer. Ann Oncol. 2003;14:85-90. [PubMed] [DOI] |
| 6. | Yagihashi A, Asanuma K, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of anti-livin antibody in gastrointestinal cancer patients. Clin Chem. 2003;49:1206-1208. [PubMed] [DOI] |
| 8. | 葛 振华, 周 凡, 谢 冰颖, 王 若愚, 陈 娟, 李 生强. 慢性胃炎肠化生CD44、CD44V6及Cyclin D1、CyclinE表达和意义. 中国组织化学与细胞化学杂志. 2007;16:649-653. |
| 9. | Fang DC, Luo YH, Yang SM, Li XA, Ling XL, Fang L. Mutation analysis of APC gene in gastric cancer with microsatellite instability. World J Gastroenterol. 2002;8:787-791. [PubMed] |
| 10. | Fang DC, Yang SM, Zhou XD, Wang DX, Luo YH. Telomere erosion is independent of microsatellite instability but related to loss of heterozygosity in gastric cancer. World J Gastroenterol. 2001;7:522-526. [PubMed] |
| 11. | Shah MA, Schwartz GK. Treatment of metastatic esophagus and gastric cancer. Semin Oncol. 2004;31:574-587. [PubMed] [DOI] |
| 12. | Wenger NK, Lewis SJ, Welty FK, Herrington DM, Bittner V. Beneficial effects of aggressive low-density lipoprotein cholesterol lowering in women with stable coronary heart disease in the Treating to New Targets (TNT) study. Heart. 2008;94:434-439. [PubMed] [DOI] |
| 15. | Chen YS, Li HR, Lin M, Chen G, Xie BS, Xu NL, Lin LF. Livin abrogates apoptosis of SPC-A1 cell by regulating JNKI signaling pathway. Mol Biol Rep. 2010;37:2241-2247. [PubMed] [DOI] |
| 16. | Kasof GM, Gomes BC. Livin, a novel inhibitor of apoptosis protein family member. J Biol Chem. 2001;276:3238-3246. [PubMed] [DOI] |
| 17. | Crook NE, Clem RJ, Miller LK. An apoptosis-inhibiting baculovirus gene with a zinc finger-like motif. J Virol. 1993;67:2168-2174. [PubMed] |
| 18. | Wang TS, Ding QQ, Guo RH, Shen H, Sun J, Lu KH, You SH, Ge HM, Shu YQ, Liu P. Expression of livin in gastric cancer and induction of apoptosis in SGC-7901 cells by shRNA-mediated silencing of livin gene. Biomed Pharmacother. 2010;64:333-338. [PubMed] [DOI] |
| 19. | Lin JH, Deng G, Huang Q, Morser J. KIAP, a novel member of the inhibitor of apoptosis protein family. Biochem Biophys Res Commun. 2000;279:820-831. [PubMed] [DOI] |
| 20. | Hariu H, Hirohashi Y, Torigoe T, Asanuma H, Hariu M, Tamura Y, Aketa K, Nabeta C, Nakanishi K, Kamiguchi K. Aberrant expression and potency as a cancer immunotherapy target of inhibitor of apoptosis protein family, Livin/ML-IAP in lung cancer. Clin Cancer Res. 2005;11:1000-1009. [PubMed] |
| 21. | 顾 凤华. 细胞周期蛋白cyclinD1和p16在胃癌中的表达及其意义. 苏州大学学报(医学版). 2005;25:471-473. |
| 22. | Sugimoto M, Martin N, Wilks DP, Tamai K, Huot TJ, Pantoja C, Okumura K, Serrano M, Hara E. Activation of cyclin D1-kinase in murine fibroblasts lacking both p21(Cip1) and p27(Kip1). Oncogene. 2002;21:8067-8074. [PubMed] [DOI] |
| 23. | Dong JS, Ni CR. Expression of survivin, PTEN, cyclinD1and p53 gene in gastric carcinoma and their relationship. J Clin Erp Pathol. 2003;19:396-400. |
| 24. | Moghaddam SJ, Haghighi EN, Samiee S, Shahid N, Keramati AR, Dadgar S, Zali MR. Immunohistochemical analysis of p53, cyclinD1, RB1, c-fos and N-ras gene expression in hepatocellular carcinoma in Iran. World J Gastroenterol. 2007;13:588-593. [PubMed] |
| 25. | Fountzilas G, Pectasides D, Kalogera-Fountzila A, Skarlos D, Kalofonos HP, Papadimitriou C, Bafaloukos D, Lambropoulos S, Papadopoulos S, Kourea H. Paclitaxel and carboplatin as first-line chemotherapy combined with gefitinib (IRESSA) in patients with advanced breast cancer: a phase I/II study conducted by the Hellenic Cooperative Oncology Group. Breast Cancer Res Treat. 2005;92:1-9. [PubMed] [DOI] |
| 26. | Hinds PW, Dowdy SF, Eaton EN, Arnold A, Weinberg RA. Function of a human cyclin gene as an oncogene. Proc Natl Acad Sci U S A. 1994;91:709-713. [PubMed] [DOI] |
| 27. | Motokura T, Bloom T, Kim HG, Jüppner H, Ruderman JV, Kronenberg HM, Arnold A. A novel cyclin encoded by a bcl1-linked candidate oncogene. Nature. 1991;350:512-515. [PubMed] [DOI] |