修回日期: 2012-03-27
接受日期: 2012-04-25
在线出版日期: 2012-05-28
目的: 寻找与新疆哈萨克族食管癌发生、发展密切相关的基因, 为早期诊断和治疗提供依据.
方法: 利用二维凝胶电泳(2-DE)和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)技术联用检测出新疆哈萨克族食管癌癌组织与远端正常组织的差异表达蛋白. 对其中的HspB1基因进行RT-PCR验证.
结果: 2-DE结果显示新疆哈萨克族食管癌患者癌组织和远端正常组织在蛋白质水平有显著增高, 而其mRNA表达在癌组织中为2.18±3.98, 正常组织为3.06±4.69, 并无显著升高(P>0.05), 且与浸润深度、临床分期、分化程度无关(P>0.05), 但HspB1的表达量在浸润深度组, T1-T2期T>N为7/11(63.6%), 而T3-T4期T>N仅为14/37(37.8%); 在分化程度组, 低分化期T>N为5/9(55.6%), 中高分化期T>N仅为16/39(41%). 随着浸润深度和分化程度的逐步加深, 由T>N向T<N变化.
结论: 本研究提示HspB1的表达在哈萨克族食管癌的浸润、分化中可能受多种因素的调控, 也由此说明哈萨克族食管癌的发生发展有着特殊的机制.
引文著录: 张景萍, 李卉, 李秀梅, 姜孝芳, 李艳, 张秦忠, 陈艳, 王洪江, 庞作良, 谌宏鸣, 李惠武. HspB1在新疆哈萨克族食管癌组织中的表达. 世界华人消化杂志 2012; 20(15): 1296-1300
Revised: March 27, 2012
Accepted: April 25, 2012
Published online: May 28, 2012
AIM: To obtain differentially expressed proteins in esophageal cancer in Xinjiang Kazakh patients by using a comparative proteomic method to provide clues to early diagnosis and therapy of this malignancy.
METHODS: Two-dimensional gel electrophoresis (2-DE) and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS) were utilized for the identification of proteins differentially expressed between cancer and adjacent non-cancerous tissue. The differential expression of HspB1 was further verified by RT-PCR.
RESULTS: Overexpression of HspB1 protein was noted in esophageal cancer; however, its mRNA expression showed no significant difference between cancer tissue and normal tissue (2.18 ± 3.98 vs 3.06 ± 4.69, P > 0.05). HspB1 mRNA expression had no correlation with depth of invasion, clinical stage, or degree of differentiation (all P > 0.05). The percentage of samples showing higher HspB1 expression in esophageal cancer than in normal tissue, in patients with T3 to T4 cancer than in those with T1 to T2 cancer, and in those with high-differentiation cancer than in those with low-differentiation cancer.
CONCLUSION: Our finding suggests that HspB1 expression may be regulated by several different mechanisms during the infiltration and differentiation of esophageal cancer.
- Citation: Zhang JP, Li H, Li XM, Jiang XF, Li Y, Zhang QZ, Chen Y, Wang HJ, Pang ZL, Shen HM, Li HW. Expression of HspB1 in esophageal cancer in Xinjiang Kazakh patients. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1296-1300
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1296.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1296
食管癌是人类最常见的消化系恶性肿瘤之一, 我国是食管癌高发地区, 5年生存率不到15%[1]. 新疆是我国食管癌高发区之一, 尤其是哈萨克族居民的发病率最高, 是新疆的民族特高发疾病, 其发病率高达155.9/10万, 远高于同地区其他民族(22.3/10万)[2]. 蛋白质组学被认为是基因组时代一种高通量同时可研究疾病发生发展全过程中整体蛋白质变化的重要技术[3-7]. 本研究目的是使用二维凝胶电泳(2-dimensionelectrophoresis, 2-DE)和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)技术联用检测新疆哈萨克族食管癌患者癌组织和远端正常组织, 获得差异表达基因, 扩大样本量进一步验证差异基因的表达水平, 为新疆哈萨克族食管癌的早期诊断和预防提供可用的分子标记.
48对匹配的哈萨克族食管癌患者癌组织及相距6 cm以上的远端无癌正常组织, 取自新疆医科大学附属肿瘤医院2008-01/06收治的病例, 均为鳞癌, 其中男34例, 女14例, 年龄在35-67岁之间. 提取的组织经冷PBS洗涤后放入液氮中保存备用. 标本组织学分级: 组织高中分化39例, 低分化9例; 浸润深度T1+T2共11例, T3+T4共37例; TNM分期Ⅰ-Ⅱa期14例, Ⅱb-Ⅲ期34例.
1.2.1 2-DE: 按文献[8]的方法进行操作.
1.2.2 MALDI-TOF鉴定单个蛋白质: (1)胶内酶解及Ziptip脱盐: 每个胶粒切碎后放入Eppendorf管中, 每管加入200-400 μL 100 mmol/L NH4HCO3/30%ACN脱色, 冻干后, 加入5 μL 2.5-10 μg/L测序级Trypsin(Promega)溶液(酶与被分析蛋白质质量比一般为1:20-1:100), 37 ℃反应过夜(20 h左右); 吸出酶解液, 转移至新EP管中, 原管加入100 μL 60% ACN/0.1%TFA, 超声15 min, 合并前次溶液, 冻干; 若有盐, 则用Ziptip(millipore)进行脱盐; (2)质谱分析: 样品与5 g/L HCCA基质1:1混合后, 用4800串联飞行时间质谱仪(4800 Plus MALDI TOF/TOFTM Analyzer, Applied Biosystems, USA)进行质谱分析, 激光源为355 nm波长的Nd:YAG激光器, 加速电压为2 kV, 采用正离子模式和自动获取数据的模式采集数据, PMF质量扫描范围为800-4 000 Da, 选择信噪比>50的母离子进行二级质谱(MS/MS)分析, 每个样品点上选择8个母离子, 二级MS/MS激光激发2 500次, 碰撞能量2 kV, CID关闭; (3)数据库检索: 将肽质量指纹数据通过因特网在蛋白质序列库中进行搜索, 搜索软件为Mascot, 数据库选择为NCBI, 物种为人类(human), 以Mowse分值为基础的概率(P)评价数据库搜寻结果的质量, 分值大小表示鉴定蛋白属于随机匹配的可能性, >63表明具有显著性意义.
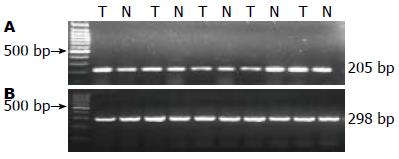
1.2.3 RT-PCR: 选取48对匹配的哈萨克族食管癌患者癌组织及正常组织. 采用TRIzol试剂一步提取细胞总RNA, RNA提取物1 μg, 逆转录为cDNA, 取以上样品cDNA 2 μL, 加入2×Buffer 10 μL, 引物各1 μL, 加去离子水至20 μL, 以20 μL 体系进行PCR扩增. PCR扩增条件及引物序列及扩增条件见表1. GAPDH用于作内对照. 取扩增产物进行琼脂糖凝胶电泳, 溴化乙锭染色, 紫外灯下观察结果. 用凝胶成像系统进行半定量分析, 取目的基因条带和GAPDH条带强度的比值作为目的基因的相对值.
| 基因 | 序列 | 长度(bp) | PCR反应条件 |
| HspB1 | F5'-AGGATGGCGTGGTGGAGA-3' | 205 | 94 ℃, 5 min; 94 ℃, 30 s, 56 ℃, 30 s, 72 ℃, 30 s, 35个循环; 72 ℃, 7 min |
| R5'-GAAGGTGACTGGGATGGTGA-3' | |||
| GAPDH | F5'-CGCGGGCTCTCCAGAACATCAT-3' | 298 | 95 ℃, 5 min, 94 ℃, 30 s, 58 ℃, 30 s, 72 ℃, 60 s, 35个循环; 72 ℃, 20 min |
| R5'-CCAGCCCCAGCGTCAAAGGTG-3' |
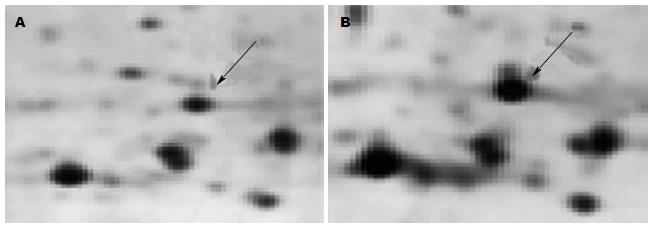
通过2-DE技术, 得到新疆哈萨克族食管癌癌组织和远端无癌组织的差异表达蛋白谱[9]. 用IMAGE MASTERTM(GE)进行两组之间的t-test分析, 得到合乎统计学标准的蛋白质差异点. 蛋白表达强度差异在1.5倍以上者被认为差异蛋白, 做进一步质谱分析. 本研究选择在癌组织中表达上调的HspB1进行下一步研究, 2-DE图谱中HspB1的局部放大如图1.
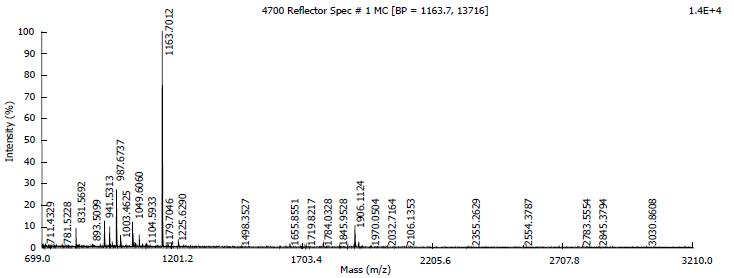
选取图像分析得到的差异蛋白点, 切碎后放入Eppendorf管中, 做胶内酶解, 37 ℃反应过夜, 20 h左右. 进行质谱分析, 获得蛋白点的相应肽质量指纹图谱, 将肽质量指纹数据通过因特网在蛋白质序列库中进行搜索, HspB1的质谱检测结果如图2.
在48对样品中, T>N的病例占21例(43.75%). 癌组织中HspB1的相对表达量为2.18±3.98, 正常组织为3.06±4.69(P>0.05, 图3). 说明HspB1 mRNA在癌组织与相应的正常组织表达量无增加.
将患者按照浸润深度、临床分期分组、分化程度的不同, 在每组内对癌组织及其对应的远端无癌正常组织HspB1基因的表达量进行t检验, 结果显示其表达量与浸润深度、临床分期、分化程度无关(P>0.05). 进一步分析发现, 随着浸润深度和分化程度的逐步加深, HspB1的表达量发生变化, 在浸润深度组, T1至T2期T>N为7/11(63.6%), 而T3至T4期T>N仅为14/37(37.8%); 在分化程度组, 低分化期T>N为5/9(55.6%), 中高分化期T>N仅为16/39(41%, 表2).
| 临床特征 | n | t值 | P值 | T>N | T<N |
| 浸润深度 | |||||
| T1+T2 | 11 | -1.294 | 0.218 | 7 | 4 |
| T3+T4 | 37 | -0.645 | 0.521 | 14 | 23 |
| TNM分期 | |||||
| Ⅰ+Ⅱa | 14 | -0.630 | 0.534 | 6 | 8 |
| Ⅱb+Ⅲ | 34 | -0.752 | 0.455 | 15 | 19 |
| 分化程度 | |||||
| 低分化 | 9 | -1.245 | 0.231 | 5 | 4 |
| 中-高分化 | 39 | -0.512 | 0.610 | 16 | 23 |
| 合计 | 48 | 21 | 27 |
食管癌是消化系统常见的肿瘤, 其发病率和死亡率近年呈上升趋势, 新疆哈萨克族是食管癌的高发民族, 而食管癌的早期诊断及复发的早期检测是其有效治疗的关键[10]. 对于肿瘤和正常组织, 比较蛋白组学能检测出候选差异蛋白分子, 有助于肿瘤的诊断、治疗等. 本研究的目的旨在找寻这些分子, 为未来哈萨克族食管癌的发病机制、诊断及治疗奠定基础. 本研究中, 通过蛋白组学技术, 我们建立了食管癌及远端无癌正常组织之间的差异表达蛋白谱, 发现多个差异表达蛋白, 进一步鉴定发现这些蛋白参与多种生物学过程, 包括细胞增殖、转化、凋亡、能量代谢、蛋白折叠、构建细胞骨架等功能.
HspB1(heat shock 27 kDa protein 1)是热休克蛋白家族中重要一员, 也称为Hsp25(小鼠)和Hsp27(人类), 是分布最广和研究最多的小热休克蛋白(small heat shock proteins, sHsp)[11,12], 在各种正常和肿瘤组织中均有表达. HspB1的主要生物学功能涉及蛋白与蛋白的相互作用, 如蛋白的折叠、移位和阻止蛋白质的不正确聚合, 维持蛋白质的正常结构, 同时也可以保护细胞免受各种应激因素的损伤, 是重要的分子伴侣.
研究证实HspB1在多种肿瘤中出现异常表达[13], 如大肠癌[14-16]、神经母细胞瘤[17]、肝癌[18-20]、胃癌[21-23]、乳腺癌[24,25]、前列腺癌[26]. HspB1在食管癌的致癌过程中所起的作用仍然不清, 研究证实HspB1在食管腺癌中表达增
加[27-29], 且认为HspB1的过量表达与食管鳞癌细胞的分化有关[30]. Kawanishi等[31]研究却表明HspB1在食管癌中低表达, 并且认为这种变化可以作为食管癌患者预后的一个重要标志物. 而我们的研究结果显示通过2-DE方法检测HspB1在蛋白水平表达上调, 通过RT-PCR方法验证48例患者匹配的癌组织和远端无癌正常组织中表达没有显著的差异, 且与浸润深度、临床分期、分化程度无关. 进一步分析后发现, HspB1的表达量随着浸润深度和分化程度的逐步加深, 由T>N向T<N变化. 提示HspB1的表达在哈萨克族食管癌的浸润、分化中可能受多种因素的调控, 也说明哈萨克族食管癌的发生发展有着特殊的机制.
食管癌是人类最常见的消化系恶性肿瘤之一, 我国是食管癌高发地区, 5年生存率不到15%. 新疆是我国食管癌高发区之一, 尤其是哈萨克族居民的发病率最高, 是新疆的民族特高发疾病, 其发病率高达155.9/10万, 远高于同地区其他民族(22.3/10万).
黄缘, 教授, 南昌大学第二附属医院消化内科, 江西省分子医学重点实验室
蛋白质组学被认为是基因组时代一种高通量同时可研究疾病发生发展全过程中整体蛋白质的变化的重要技术. 随着蛋白组学的发展, 从蛋白水平研究肿瘤的发病机制成为热点, 为寻找肿瘤分子标志物及新的治疗靶点提供了良好的技术平台.
Langer等人研究证实HspB1在食管腺癌中表达增加, 且认为HspB1的过量表达与食管鳞癌细胞的分化有关. Kawanishi研究却表明HspB1在食管癌中低表达, 并认为这种变化可以作为食管癌患者预后的一个重要标志物.
本研究使用二维凝胶电泳(2-DE)和基质辅助激光解吸电离飞行时间质谱技术联用检测新疆哈萨克族食管癌患者癌组织和远端正常组织, 获得差异表达基因, 扩大样本量进一步验证差异基因的表达水平, 为新疆哈萨克族食管癌的早期诊断和预防提供可用的分子标记.
该文选题好, 立意新颖, 与临床密切联系, 有区域的代表性.
编辑: 张姗姗 电编:鲁亚静
| 1. | 赵 凤娟, 云 妙英, 张 严, 徐 羽. 新疆哈萨克族食管癌研究进展. 中央民族大学学报(自然科学版). 2009;18:85-90. |
| 3. | Kavallaris M, Marshall GM. Proteomics and disease: opportunities and challenges. Med J Aust. 2005;182:575-579. [PubMed] |
| 4. | Chambers G, Lawrie L, Cash P, Murray GI. Proteomics: a new approach to the study of disease. J Pathol. 2000;192:280-288. [PubMed] [DOI] |
| 5. | Müllner S, Neumann T, Lottspeich F. Proteomics--a new way for drug target discovery. Arzneimittelforschung. 1998;48:93-95. [PubMed] |
| 8. | Rabilloud T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2002;2:3-10. [PubMed] [DOI] |
| 11. | Ferns G, Shams S, Shafi S. Heat shock protein 27: its potential role in vascular disease. Int J Exp Pathol. 2006;87:253-274. [PubMed] [DOI] |
| 12. | Mymrikov EV, Seit-Nebi AS, Gusev NB. Large potentials of small heat shock proteins. Physiol Rev. 2011;91:1123-1159. [PubMed] [DOI] |
| 13. | Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones. 2005;10:86-103. [PubMed] [DOI] |
| 14. | Liu W, Ma Y, Huang L, Peng J, Zhang P, Zhang H, Chen J, Qin H. Identification of HSP27 as a potential tumor marker for colorectal cancer by the two-dimensional polyacrylamide gel electrophoresis. Mol Biol Rep. 2010;37:3207-3216. [PubMed] [DOI] |
| 15. | Strzelczyk JK, Krakowczyk Ł, Kasperczyk J, Strzelczyk J, Zalewska-Ziob M, Wiczkowski A. [The concentration of HSP 27 in tumour and adjacent distal mucosa in colorectal adenocarcinoma]. Przegl Lek. 2011;68:263-268. [PubMed] |
| 16. | Oya-Ito T, Naito Y, Takagi T, Handa O, Matsui H, Yamada M, Shima K, Yoshikawa T. Heat-shock protein 27 (Hsp27) as a target of methylglyoxal in gastrointestinal cancer. Biochim Biophys Acta. 2011;1812:769-781. [PubMed] |
| 17. | Zanini C, Pulerà F, Carta F, Giribaldi G, Mandili G, Maule MM, Forni M, Turrini F. Proteomic identification of heat shock protein 27 as a differentiation and prognostic marker in neuroblastoma but not in Ewing's sarcoma. Virchows Arch. 2008;452:157-167. [PubMed] [DOI] |
| 18. | Luk JM, Lam CT, Siu AF, Lam BY, Ng IO, Hu MY, Che CM, Fan ST. Proteomic profiling of hepatocellular carcinoma in Chinese cohort reveals heat-shock proteins (Hsp27, Hsp70, GRP78) up-regulation and their associated prognostic values. Proteomics. 2006;6:1049-1057. [PubMed] [DOI] |
| 19. | Chen XL, Zhou L, Yang J, Shen FK, Zhao SP, Wang YL. Hepatocellular carcinoma-associated protein markers investigated by MALDI-TOF MS. Mol Med Report. 2010;3:589-596. [PubMed] [DOI] |
| 20. | Guo K, Kang NX, Li Y, Sun L, Gan L, Cui FJ, Gao MD, Liu KY. Regulation of HSP27 on NF-kappaB pathway activation may be involved in metastatic hepatocellular carcinoma cells apoptosis. BMC Cancer. 2009;9:100. [PubMed] [DOI] |
| 21. | Yang YX, Sun XF, Cheng AL, Zhang GY, Yi H, Sun Y, Hu HD, Hu P, Ye F, Chen ZC. Increased expression of HSP27 linked to vincristine resistance in human gastric cancer cell line. J Cancer Res Clin Oncol. 2009;135:181-189. [PubMed] [DOI] |
| 22. | Carrasco V, Canfrán S, Rodríguez-Franco F, Benito A, Sáinz A, Rodríguez-Bertos A. Canine gastric carcinoma: immunohistochemical expression of cell cycle proteins (p53, p21, and p16) and heat shock proteins (Hsp27 and Hsp70). Vet Pathol. 2011;48:322-329. [PubMed] [DOI] |
| 23. | Huang Q, Ye J, Huang Q, Chen W, Wang L, Lin W, Lin J, Lin X. Heat shock protein 27 is over-expressed in tumor tissues and increased in sera of patients with gastric adenocarcinoma. Clin Chem Lab Med. 2010;48:263-269. [PubMed] [DOI] |
| 24. | Liebhardt S, Ditsch N, Nieuwland R, Rank A, Jeschke U, Von Koch F, Friese K, Toth B. CEA-, Her2/neu-, BCRP- and Hsp27-positive microparticles in breast cancer patients. Anticancer Res. 2010;30:1707-1712. [PubMed] |
| 25. | Kim LS, Kim JH. Heat shock protein as molecular targets for breast cancer therapeutics. J Breast Cancer. 2011;14:167-174. [PubMed] [DOI] |
| 26. | Larkin SE, Holmes S, Cree IA, Walker T, Basketter V, Bickers B, Harris S, Garbis SD, Townsend PA, Aukim-Hastie C. Identification of markers of prostate cancer progression using candidate gene expression. Br J Cancer. 2012;106:157-165. [PubMed] [DOI] |
| 27. | Langer R, Ott K, Specht K, Becker K, Lordick F, Burian M, Herrmann K, Schrattenholz A, Cahill MA, Schwaiger M. Protein expression profiling in esophageal adenocarcinoma patients indicates association of heat-shock protein27 expression and chemotherapy response. Clin Cancer Res. 2008;14:8279-8287. [PubMed] [DOI] |
| 29. | Lambot MA, Peny MO, Fayt I, Haot J, Noël JC. Overexpression of 27-kDa heat shock protein relates to poor histological differentiation in human oesophageal squamous cell carcinoma. Histopathology. 2000;36:326-330. [PubMed] [DOI] |
| 30. | Chen JH, Chen LM, Xu LY, Wu MY, Shen ZY. [Expression and significance of heat shock proteins in esophageal squamous cell carcinoma]. Zhonghua Zhongliu Zazhi. 2006;28:758-761. [PubMed] |