修回日期: 2012-03-28
接受日期: 2012-04-25
在线出版日期: 2012-05-28
目的: 探讨茯苓多糖及其衍生物的结构与抗胃腺癌活性之间的构效关系.
方法: 对从茯苓菌核中提取的(1→3)-β-D-葡聚糖PCS3-Ⅱ及其硫酸酯、羧甲基、羟乙基、羟丙基和甲基化衍生物, 用粘度法、激光光散射(LLS)及尺寸排除色谱和光散射仪联用(SEC-LLS)表征了他们在磷酸缓冲液(PBS)中37 ℃下的[η]、Mw及<s2>z1/2等分子参数. 然后用MTT法研究了PCS3-Ⅱ和几种衍生物对不同分化程度的胃腺癌细胞株MKN-45、SGC-7901和MKN-28生长的抑制作用.
结果: S-PCS3-Ⅱ、C-PCS3-Ⅱ、M-PCS3-Ⅱ、HE-PCS3-Ⅱ和HP-PCS3-Ⅱ衍生物在PBS溶液中Mw值分别为3.8×104、18.9×104、16.0×104、76.8×104和224.3×104, 未改性β-葡聚糖PCS3-Ⅱ几乎无抗胃腺癌活性, 而他的硫酸酯和羧甲基衍生物对细胞株MKN-45、SGC-7901和MKN-28却显示较高的抑制率.
结论: 天然茯苓菌核多糖体外没有抗胃腺癌活性; 水不溶性多糖PCS3-Ⅱ链上引入羧甲基和硫酸酯基后, 其衍生物溶于水, 且链刚性增大, 同时其抗胃腺癌活性增强; 良好的水溶性、较高的链刚性和适当大的分子量有利于茯苓多糖抗胃腺癌活性的提高.
引文著录: 李云桥, 侯晓华, 王艺峰, 张俐娜. 化学修饰的茯苓β-D-葡聚糖结构与抗胃腺癌活性的关系. 世界华人消化杂志 2012; 20(15): 1277-1283
Revised: March 28, 2012
Accepted: April 25, 2012
Published online: May 28, 2012
AIM: To study the correlation between structure and anti-gastric adenocarcinoma activities of polysaccharides isolated from the sclerotiuma of Poria cocos and their derivatives.
METHODS: A water insoluble (1→3)-b-D-glucan PCS3-Ⅱ isolated from fresh sclerotium of Poria cocos was sulfated, carboxymethylated, methylated, hydroxyethylated or hydroxypropylated to prepare five water-soluble derivatives, coded as S-PCS3-Ⅱ, C-PCS3-Ⅱ, M-PCS3-Ⅱ, HE-PCS3-Ⅱ and HP-PCS3-Ⅱ. Their weight-average molecular mass (Mw), intrinsic viscosity ([η]) and <s2>z1/2 were characterized by size exclusion chromatography (SEC) combined with laser light scattering (LLS), LLS, and viscometry. The antitumor activities of PCS3-Ⅱ and its derivatives were tested in vitro by MTT assay using gastric adenocarcinoma cell lines MKN-45, SGC-7901 and MKN-28.
RESULTS: The Mw values of the derivatives S-PCS3-Ⅱ, C-PCS3-Ⅱ, M-PCS3-Ⅱ, HE-PCS3-Ⅱand HP-PCS3-Ⅱ in PBS were determined to be 3.8×104, 18.9×104, 16.0×104, 76.8×104, and 224.3×104, respectively. The native b-glucan did not show any anti-gastric adenocarcinoma activity, while the sulfated and carboxymethylated derivatives exhibited significant anti-gastric adenocarcinoma activity in MKN-45, SGC-7901 and MKN-28 cell lines.
CONCLUSION: The polysaccharides from fresh sclerotium of Poria cocos showed no anti-gastric adenocarcinoma activity in vitro. The introduction of carboxymethylated and sulfated groups to water insoluble polysaccharide PCS3-Ⅱ increased their water-solubility, chain stiffness and anti-gastric adenocarcinoma activity. The sulfated derivatives showed obvious inhibitory effects on gastric adenocarcinoma cells.
- Citation: Li YQ, Hou XH, Wang YF, Zhang LN. Correlation between structure and anti-gastric adenocarcinoma activity of b-D-glucan isolated from Poria cocos sclerotium. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1277-1283
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1277.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1277
多糖类物质所具有的生物活性, 使其在功能性保健食品和天然新药等领域表现出极为重要的商业价值, 近年来日益引起了人们的广泛关注[1-3]. 大量药理研究表明, 一些天然多糖具有显著抗肿瘤[4-6]及增强机体免疫活性[7-9], 而有些天然多糖几乎不具有生物活性[10], 特别是水不溶性的多糖, 他们的基本活性或活性很低. 此外, 一些经硫酸酯化、羧甲基化改性的α-D-葡聚糖和β-D-葡聚糖除具有了良好水溶性, 且抗Sarcoma 180实体瘤活性也显著提高[11-14]. 因此, 化学改性已成为提高天然多糖生物活性的有效手段[15]. 研究表明, 引入合适的离子基团能够显著改善水溶性, 同时通过改变多糖在水溶液中的链构象提高其活性[16,17]. 而不同的取代基团、取代位置和取代度对多糖衍生物的活性有重要影响[18,19]. 茯苓(Poria cocos)一直是最重要的传统中药之一, 他所具有的保健功能和生理活性已引起医学界和化学界的广泛兴趣[20,21]. 但是, 从茯苓菌核中提取主要成分是一种(1→3)-β-D-葡聚糖PCS3-Ⅱ, 他不溶于水且基本上无抗胃腺癌活性, 因此通过化学改性方法对其进行结构修饰而提高水溶性和活性的工作具有重要意义[22-24].
为了改善PCS3-Ⅱ水溶性和生物活性, 我们分别试用硫酸酯化(Sulfation)、羧甲基化(Carboxymethylation)、羟乙基化(Hydroxyethylation)、羟丙基化(Hydroxypropylation)及甲基化(Methylation)5种衍生化方法对其进行化学改性来探讨其衍生物和抗胃腺癌活性之间的关系. 探讨不同的取代基团、取代度、水溶性、分子量和链构象与抗胃腺癌活性的关系. 此外, 尽管有关于多糖抗消化系肿瘤(胃癌、肝癌、食管癌)患者的报道[25-28], 但对于茯苓多糖尚未进行过此类研究, 因此本研究还对茯苓多糖抗胃腺癌细胞株活性进行了探讨.
样品由武汉大学化学系张俐娜院士课题组提供, 样品的制备方法见文献[29,30]. 本研究样品包括从新鲜茯苓菌核的0.5 mol/L NaOH提取物(1→3)-β-D-葡聚糖PCS3-Ⅱ以及以PCS3-Ⅱ为原料制备的硫酸酯化S-PCS3-Ⅱ、羧甲基化C-PCS3-Ⅱ、羟乙基化HE-PCS3-Ⅱ、羟丙基化HP-PCS3-Ⅱ及甲基化M-PCS3-Ⅱ5种多糖衍生物. 成分组成用红外光谱谱图测定; 分子量由激光光散射法、粘度法、尺寸排除色谱和光散射仪联用法测定. MTT购自Sigma公司, RPMI l640培养基购自武汉亚法生物公司; 小牛血清购自北京中山生物技术有限公司; 低分化胃腺癌细胞株MKN-45、中分化胃腺癌细胞株SGC7901、高分化胃腺癌细胞株MKN-28由协和医院中心实验室提供.
1.2.1 粘度测量: 多糖衍生物的特性粘数[η]用乌氏粘度计于37 ℃±0.1 ℃测量. 样品溶剂为磷酸缓冲液PBS或无水Me2SO. 用Huggins和Kraemer方程来计算特性粘数[η].
ηsp/c = [η]+k'[η]2c
(lnηr)/c = [η]-k'[η]2c
1.2.2 激光光散射(size exclusion chromatography, SEC): 5种多糖衍生物在PBS溶液或无水Me2SO的光散射强度测试, 采用配备有He-Ne激光源(激光波长λ = 633 nm)的多角度激光光散射仪(DAWN®DSP, Wyatt Technology Co., USA), 在37 ℃下检测不同角度的散射光信号. 所有的溶液和溶剂在测量前经光学纯化后直接注入散射池中进行测量. Astra软件用于数据采集和分析, 重均分子量Mw通过Zimm拟合法得到.
1.2.3 尺寸排除色谱和光散射仪联用(size exclusion chromatography combined with laser light scattering, SEC-LLS): 尺寸排除色谱和光散射仪联用装置的光散射仪为上述DAWN®DSP多角度激光光散射仪, 尺寸排除色谱装置使用P100型泵和RI-150示差折光检测器. 色谱柱类型: 水体系为TSK-GEL PWXL G5000和G3000联用色谱柱, Me2SO体系为G4000-H6色谱柱. 测试温度为37 ℃, 流动相为PBS溶液或无水Me2SO, 在测量前经光学纯化处理, 进样量200 μL, 流速1.0 cm3/min. Astra软件用于数据采集和分析.
1.2.4 细胞培养和抗肿瘤活性试验方法: (1)细胞复苏: 在液氮罐中取出冻存的不同分化程度的胃腺癌细胞株(MKN-45、SGC7901、MKN-28), 37 ℃水浴融化, 离心, 2 500 g×5 min. 去上清, RPMI 1640培养液洗1次, 接种于25 mL的培养瓶中, 加8 mL含100 mL/L胎牛血清的RPMI 1640培养液, 37 ℃, 50 mL/L CO2培养, 次日换培养液1次; (2)细胞传代: 在显微镜下观察细胞生长情况, 如生长正常(细胞清亮、椭圆形、上清不浑浊)且基本长满瓶底时即可传代, 2-3 d传1次; (3)抗肿瘤活性试验: 体外抑瘤实验: 采用MTT法, 取对数生长期细胞, 用胰蛋白酶消化制成单细胞悬液, 调整细胞浓度为1×105 cells/mL, 以每孔200 µL(5×103)接种于96孔培养板上培养24 h. 之后弃去原培养液, 再分别每孔加入新鲜培养液和多糖试样使其浓度分别为0.005、0.05、0.5、5 g/L 4组处理胃腺癌细胞和正常的胃腺细胞; 实验同时设空白(溶媒)对照组和阳性对照组(5-Fu), 每组处理设5个复孔. 放在37 ℃、50 mL/L CO2培养箱培养72 h, 收集各组细胞, 每孔加入终浓度为5 g/L的MTT液20 µL, 继续培养4 h; 终止培养, 吸去上清液, 加二甲基亚砜150 µL/孔, 充分震荡10 min后, 用酶标仪(Bio-Tek EX-800, USA)在570 nm波长比色测定每孔吸光度(A)值. 按以下公式计算细胞抑制率: 细胞抑制率(%) = (1-实验组A值/对照组A值)×100%, 每组实验数据重复3次.
统计学处理 数据用mean±SD表示, 采用SPSS19.0统计软件分析. 多组之间用方差(one-way ANOVA)分析, 两组之间用t检验. 若P<0.05, 则差异有显著性意义; 若P<0.01, 则差异有极显著性意义; 若P>0.05, 则差异无显著性意义..
样品S-PCS3-Ⅱ、C-PCS3-Ⅱ和M-PCS3-Ⅱ的取代主要发生在C-6位羟基, 其次在C-4和C-2位; 而HE-PCS3-Ⅱ的取代发生在C-6和C-4位, HP-PCS3-Ⅱ几乎全部在C-6位, 他们都属于非选择性取代. 5种衍生多糖取代度大小和取代难易程度的顺序为C-PCS3-Ⅱ>S-PCS3-Ⅱ>M-PCS3-Ⅱ>HE-PCS3-Ⅱ>HP-PCS3-Ⅱ. 由13C NMR得到他们的取代度在0.23-1.27之间. 5种衍生物在水或二甲亚砜中的溶解情况显示, 所有衍生物都具有比原多糖PCS3-Ⅱ更好的水溶性, 其水溶性大小顺序依次为S-PCS3-Ⅱ>C-PCS3-Ⅱ>M-PCS3-Ⅱ>HE-PCS3-Ⅱ>HP-PCS3-Ⅱ, 与取代度顺序相似(表1). PCS3-Ⅱ不溶于水, 是因为他存在强的分子间氢键而导致分子在水溶液中形成聚集. 无水Me2SO被证明是该β-葡聚糖的良溶剂, 他能打断分子间和分子内氢键, 将聚集体解离为单股链. 因此本实验中, 对水溶液中易聚集样品的分子量和粘度测量可用无水Me2SO作溶剂.
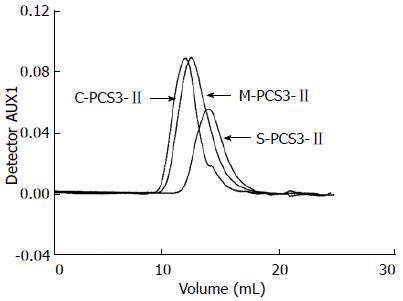
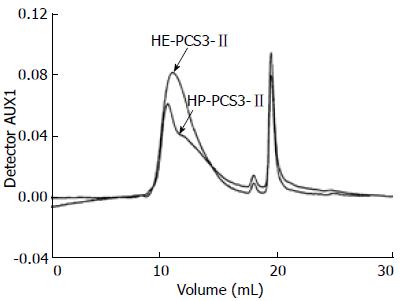
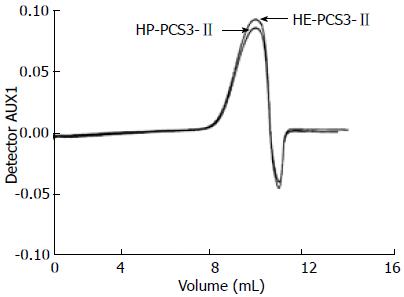
3样品在PBS溶液中37 ℃下的SEC-LLS谱图示于图1, 这3种衍生物的示差和光散射检测都只显示出单峰, 表明他们在水溶液中无聚集体形成[31]. 图2及图3显示出了样品HE-PCS3-Ⅱ和HP-PCS3-Ⅱ分别在PBS溶液及无水Me2SO中37 ℃下的SEC-LLS谱图, 这2种衍生物样品在PBS溶液则显示出2个以上的峰, 而在Me2SO中只显示单峰, 说明他们在水溶液中存在聚集, 而在Me2SO解离为单股链. 通过粘度法、LLS和SEC-LLS测得的各样品在PBS溶液或Me2SO中的特性粘数[η]、Mw、<s2>1/2和多分散系数(Mw/Mn)见表2. 结果发现S-PCS3-Ⅱ、C-PCS3-Ⅱ和M-PCS3-Ⅱ 3样品由LLS测得的Mw值与SEC-LLS测得的结果基本一致, 与PCS3-Ⅱ的Mw值(12.3×104)相比, 硫酸酯衍生物S-PCS3-Ⅱ的Mw较低, 这是因为剧烈的反应条件导致了原多糖的降解. 然而, C-PCS3-Ⅱ和M-PCS3-Ⅱ 2样品的Mw值却比PCS3-Ⅱ的更高, 这是因为在PCS3-Ⅱ糖环羟基上引入了羧甲基和甲基基团, 且他们的降解较弱. 有趣的是, HE-PCS3-Ⅱ和HP-PCS3-Ⅱ 2样品在PBS溶液中的Mw值比其他样品高很多, 这是由于他们的取代度较低(0.2-0.5), 大量的-OH基团仍保留在衍生物糖环上, 导致在水溶液中分子间的聚集效应, 多糖在水溶液中的聚集行为也常给他们的分子量测量带来了不确定性, 因而2样品在无水Me2SO中测得的Mw值被认为是他们的真实分子量.
| 样品 | 溶媒 | [η] (cm3/g) | <s2>1/2 (nm) | LLS | SEC-LLS | |
| Mw×10-4 (g/mol) | Mw×10-4 (g/mol) | Mw/Mn | ||||
| PCS3-Ⅱ | Me2SO | 76.3 | 56.41 | 12.3 | 14.0 | 1.7 |
| S-PCS3-Ⅱ | PBS | 20.2 | 44.22 | 3.8 | 3.5 | 1.6 |
| C-PCS3-Ⅱ | PBS | 167.1 | 45.01 | 18.9 | 25.1 | 1.7 |
| M-PCS3-Ⅱ | PBS | 132.2 | 42.41 | 16.0 | 21.1 | 2.0 |
| HE-PCS3-Ⅱ | PBS | 122.5 | 39.92 | 76.8 | 62.8 | 18.0 |
| Me2SO | 146.2 | 23.92 | - | 20.1 | 1.7 | |
| HP-PCS3-Ⅱ | PBS | 156.5 | 48.32 | 224.3 | 297.0 | 2.3 |
| Me2SO | 162.3 | 29.92 | - | 19.1 | 1.6 | |
聚合物的[η]和<s2>1/2值通常反映出聚合物链刚性的情况, 相对高的[η]和<s2>1/2值反映出聚合物具有相对伸展的链构象. 从表2中的数据可以看出, 样品C-PCS3-Ⅱ在PBS溶液中具有比HE-PCS3-Ⅱ和HP-PCS3-Ⅱ更伸展的链构象. S-PCS3-Ⅱ的Mw值在5种衍生物样品中是最低的, 但是他的<s2>1/2值却几乎与M-PCS3-Ⅱ和C-PCS3-Ⅱ 2样品的相等, 这说明S-PCS3-Ⅱ在水溶液中表现为比其他样品更为伸展的链构象, 即具有更高的链刚性.
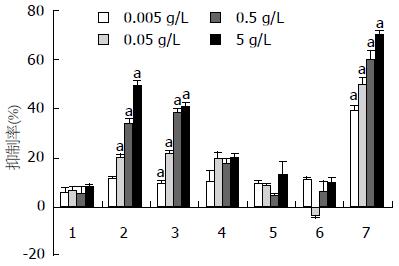
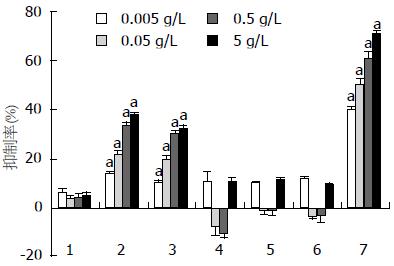
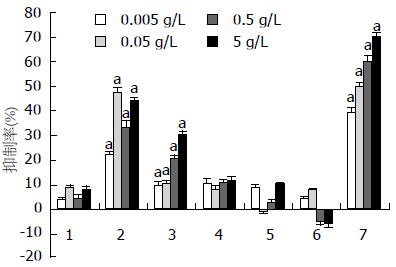
5-氟尿嘧啶(5-Fu)、PCS3-Ⅱ和5种衍生物样品抗胃腺癌肿瘤细胞株MKN-45、SGC-7901、MKN-28的活性结果见图4-6. PCS3-Ⅱ和5种衍生物样品对正常胃腺细胞无抑制作用. 多糖PCS3-Ⅱ几乎未观察到抗肿瘤活性, 说明他对胃腺癌细胞株增殖无抑制作用. 然而5种样品均显示出比PCS3-Ⅱ更高的抑制率, 而S-PCS3-Ⅱ和C-PCS3-Ⅱ 2样品在所有实验浓度都具有显著增强的抑制率, 特别是S-PCS3-Ⅱ在5 g/L浓度时显示出所有样品中最高的抑制率(对MKN-45的抑制率为48.9%, 对SGC-7901抑制率为36.7%, MKN-28的抑制率为43.7%). 此外, S-PCS3-Ⅱ和C-PCS3-Ⅱ在所有实验浓度范围内都观察到抑制率的剂量依赖关系, 这说明他们对人体胃癌细胞株具有十分稳定的药效.
肝从以上体外抗胃腺癌实验结果可发现, 化学改性能显著提高茯苓菌核水不溶性β-D-葡聚糖的抗胃腺癌活性, 并且对正常胃腺细胞没有抑制作用. 总的来说, 硫酸酯和羧甲基衍生化改性具有比其他几种衍生化更高的抗胃腺癌活性. 5种衍生物样品的抗胃腺癌活性高低顺序与其水溶性大小顺序基本一致; 而原始β-D-葡聚糖不溶于水, 他也几乎不具抗胃腺癌活性; 因此, 提高多糖样品水溶性是提高其抗胃腺癌活性的关键因素. 此外, 具有相对较高取代度的衍生物, 因为其水溶性较好, 因而抗胃腺癌活性也更高.
值得一提的是, S-PCS3-Ⅱ和C-PCS3-Ⅱ2样品在水溶液中的链刚性相对较高, 而他们的体外抗胃腺癌抑制率也比M-PCS3-Ⅱ、HE-PCS3-Ⅱ和HP-PCS3-Ⅱ更高; 虽然S-PCS3-Ⅱ和C-PCS3-Ⅱ的水溶性相差不大, 但S-PCS3-Ⅱ的抗胃腺癌抑制率总体上又比C-PCS3-Ⅱ高, 这与S-PCS3-Ⅱ样品在水溶液中具有比C-PCS3-Ⅱ更大的链刚性有关. Unursaikhan等[14]报道硫酸酯化香菇(lentinus edodes)多糖在水溶液中的链刚性对其抗艾氏腹水瘤(ehrlich ascites carcinoma)抑制率的影响具有不可忽视的作用. 因此, S-PCS3-Ⅱ样品所具有的相对高的链刚性有助于提高他的抗胃腺癌活性. 此外, HE-PCS3-Ⅱ和HP-PCS3-Ⅱ 2样品在水溶液中的Mw值比其他样品高, 而他们的抗胃腺癌活性却较低, 这也显示了分子量对这些样品抗胃腺癌活性的影响, 在水溶液中具有适中的分子量(≤3×105)的衍生物能够明显提高原始多糖抗胃腺癌活性.
总之, 根据实验结果我们可以知道茯苓菌核中提取的(1→3)-β-D-葡聚糖样品PCS3-Ⅱ的硫酸酯、羧甲基、羟乙基、羟丙基及甲基化衍生物在PBS溶液中的Mw值分别为3.8×104、18.9×104、16.0×104、76.8×104和224.3×104. 几种衍生化样品证明引入取代基团后样品的结构发生了变化, 有序程度有所提高. 未经过化学改性的β-葡聚糖几乎无任何体外抗胃腺癌活性, 然而他的衍生物却具有较好的水溶性, 在水溶液中具有相对伸展的柔顺链构象和明显的抗胃腺癌活性. 此外, 他的硫酸酯和羧甲基衍生物十分显著地改善了原多糖对人体胃癌细胞株的体外抗胃腺癌活性. 从分子参数和抗胃腺癌活性的实验数据可以发现, 具有良好水溶性, 在水溶液中具有相对较高链刚性和适中分子量(≤3×105)的衍生物能够明显地提高原始多糖的抗胃腺癌活性. 而且其活性的高低与引入的不同取代离子基团、取代度、取代位、水溶性、分子量和链的构象有关.
茯苓(Poria cocos)是具有抗肿瘤作用的传统中药, 但是从茯苓菌核中提取的主要成分是一种(1→3)-β-D-葡聚糖PCS3-Ⅱ, 他不溶于水且基本上无抗胃腺癌活性, 因此通过化学改性方法对其进行结构修饰而提高水溶性和活性的工作具有重要意义.
李康, 副教授, 广东药学院药科学院药物分析教研室
临床已经应用多糖辅助治疗肿瘤患者, 但通过化学修饰提高茯苓多糖抗肿瘤活性研究报道不多.
本文用硫酸酯化、羧甲基化、羟乙基化、羟丙基化及甲基化5种衍生化方法对茯苓多糖进行化学改性来探讨其衍生物和抗不同分化程度的胃腺癌细胞株活性之间的关系.
天然茯苓菌核多糖体外没有抗胃腺癌活性, 水不溶性. 茯苓多糖链上引入羧甲基和硫酸酯基后, 其衍生物溶于水, 且链刚性增大, 同时其抗胃腺癌活性增强..
化学修饰: 保持药物的基本结构, 仅在某些功能基上作一定的化学结构改变, 接上一些自己需要的功能基团.
本文探讨了茯苓多糖及其衍生物的结构与抗胃腺癌活性之间的构效关系, 具有一定的开发意义.
编辑: 张姗姗 电编:鲁亚静
| 1. | Li XT, Zhang YK, Kuang HX, Jin FX, Liu DW, Gao MB, Liu Z, Xin XJ. Mitochondrial Protection and Anti-aging Activity of Astragalus Polysaccharides and Their Potential Mechanism. Int J Mol Sci. 2012;13:1747-1761. [PubMed] [DOI] |
| 2. | Joseph MM, Aravind SR, Varghese S, Mini S, Sreelekha TT. Evaluation of antioxidant, antitumor and immunomodulatory properties of polysaccharide isolated from fruit rind of Punica granatum. Mol Med Report. 2012;5:489-496. [PubMed] |
| 3. | Melo-Silveira RF, Fidelis GP, Costa MS, Telles CB, Dantas-Santos N, de Oliveira Elias S, Ribeiro VB, Barth AL, Macedo AJ, Leite EL. In vitro antioxidant, anticoagulant and antimicrobial activity and in inhibition of cancer cell proliferation by xylan extracted from corn cobs. Int J Mol Sci. 2012;13:409-426. [PubMed] [DOI] |
| 4. | Tang YL, Luo Q, Ding W, Ding X, Yang ZR. [Antitumor activity of polysaccharides extracted from two wild amanitas]. Sichuan Daxue Xuebao Yixueban. 2011;42:792-796. [PubMed] |
| 5. | Liu Y, Li Y, Yang W, Zhang L, Cao G. Anti-hepatoma activity in mice of a polysaccharide from the rhizome of Anemone raddeana. Int J Biol Macromol. 2012;50:632-636. [PubMed] [DOI] |
| 6. | Jeong SC, Koyyalamudi SR, Jeong YT, Song CH, Pang G. Macrophage immunomodulating and antitumor activities of polysaccharides isolated from Agaricus bisporus white button mushrooms. J Med Food. 2012;15:58-65. [PubMed] [DOI] |
| 7. | Skyberg JA, Rollins MF, Holderness JS, Marlenee NL, Schepetkin IA, Goodyear A, Dow SW, Jutila MA, Pascual DW. Nasal Acai polysaccharides potentiate innate immunity to protect against pulmonary Francisella tularensis and Burkholderia pseudomallei Infections. PLoS Pathog. 2012;8:e1002587. [PubMed] [DOI] |
| 8. | Fontaine T, Delangle A, Simenel C, Coddeville B, van Vliet SJ, van Kooyk Y, Bozza S, Moretti S, Schwarz F, Trichot C. Galactosaminogalactan, a new immunosuppressive polysaccharide of Aspergillus fumigatus. PLoS Pathog. 2011;7:e1002372. [PubMed] [DOI] |
| 9. | Xu X, Pan C, Zhang L, Ashida H. Immunomodulatory beta-glucan from Lentinus edodes activates mitogen-activated protein kinases and nuclear factor-kappaB in murine RAW 264.7 macrophages. J Biol Chem. 2011;286:31194-31198. [PubMed] [DOI] |
| 10. | Kulkarni RV, Mutalik S, Mangond BS, Nayak UY. Novel interpenetrated polymer network microbeads of natural polysaccharides for modified release of water soluble drug: in-vitro and in-vivo evaluation. J Pharm Pharmacol. 2012;64:530-540. [PubMed] [DOI] |
| 11. | Chen X, Zhang L, Cheung PC. Immunopotentiation and anti-tumor activity of carboxymethylated-sulfated beta-(1→3)-d-glucan from Poria cocos. Int Immunopharmacol. 2010;10:398-405. [PubMed] [DOI] |
| 12. | Wang J, Zhang L, Yu Y, Cheung PC. Enhancement of antitumor activities in sulfated and carboxymethylated polysaccharides of Ganoderma lucidum. J Agric Food Chem. 2009;57:10565-10572. [PubMed] [DOI] |
| 13. | Wang X, Zhang L. Physicochemical properties and antitumor activities for sulfated derivatives of lentinan. Carbohydr Res. 2009;344:2209-2216. [PubMed] [DOI] |
| 14. | Unursaikhan S, Xu X, Zeng F, Zhang L. Antitumor activities of O-sulfonated derivatives of (1→3)-alpha-D-glucan from different Lentinus edodes. Biosci Biotechnol Biochem. 2006;70:38-46. [PubMed] [DOI] |
| 15. | Tao Y, Zhang Y, Zhang L. Chemical modification and antitumor activities of two polysaccharide-protein complexes from Pleurotus tuber-regium. Int J Biol Macromol. 2009;45:109-115. [PubMed] [DOI] |
| 16. | Kawashima T, Murakami K, Nishimura I, Nakano T, Obata A. A sulfated polysaccharide, fucoidan, enhances the immunomodulatory effects of lactic acid bacteria. Int J Mol Med. 2012;29:447-453. [PubMed] |
| 17. | Vishchuk OS, Ermakova SP, Zvyagintseva TN. Sulfated polysaccharides from brown seaweeds Saccharina japonica and Undaria pinnatifida: isolation, structural characteristics, and antitumor activity. Carbohydr Res. 2011;346:2769-2776. [PubMed] [DOI] |
| 18. | You R, Wang K, Liu J, Liu M, Luo L, Zhang Y. A comparison study between different molecular weight polysaccharides derived from Lentinus edodes and their antioxidant activities in vivo. Pharm Biol. 2011;49:1298-1305. [PubMed] [DOI] |
| 19. | Gao Y, Li C, Yin J, Shen J, Wang H, Wu Y, Jin H. Fucoidan, a sulfated polysaccharide from brown algae, improves cognitive impairment induced by infusion of Aβ peptide in rats. Environ Toxicol Pharmacol. 2012;33:304-311. [PubMed] [DOI] |
| 20. | Jang TR, Kao MF, Chen CH, Hsieh KC, Lai WY, Chen YY. Alleviating effects of dehydration under no hyperthermia on the immunomodulatory response to the polysaccharide fraction from fu-ling (Poria cocos) in male collegiate wrestlers. Chin Med J (Engl). 2011;124:530-536. [PubMed] |
| 21. | Ríos JL. Chemical constituents and pharmacological properties of Poria cocos. Planta Med. 2011;77:681-691. [PubMed] [DOI] |
| 22. | Wang Y, Xu W, Chen Y. Surface modification on polyurethanes by using bioactive carboxymethylated fungal glucan from Poria cocos. Colloids Surf B Biointerfaces. 2010;81:629-633. [PubMed] [DOI] |
| 23. | Huang Q, Zhang L. Solution properties of (1→3)-alpha-D-glucan and its sulfated derivative from Poria cocos mycelia via fermentation tank. Biopolymers. 2005;79:28-38. [PubMed] [DOI] |
| 24. | Wang Y, Yu Y, Mao J. Carboxymethylated beta-glucan derived from Poria cocos with biological activities. J Agric Food Chem. 2009;57:10913-10915. [PubMed] [DOI] |
| 26. | Ina K, Furuta R, Kataoka T, Kayukawa S, Yoshida T, Miwa T, Yamamura Y, Takeuchi Y. Lentinan prolonged survival in patients with gastric cancer receiving S-1-based chemotherapy. World J Clin Oncol. 2011;2:339-343. [PubMed] [DOI] |
| 28. | Wang JL, Bi Z, Zou JW, Gu XM. Combination therapy with lentinan improves outcomes in patients with esophageal carcinoma. Mol Med Report. 2012;5:745-748. [PubMed] |
| 29. | 张 俐娜, 王 艺峰, 侯 晓华, 李 云桥. 抗肿瘤活性茯苓菌核葡聚糖硫酸酯及其制备方法和用途. 中国专利 1583800, 2005-02-23. |
| 30. | Wang Y, Zhang M, Ruan D, Shashkov AS, Kilcoyne M, Savage AV, Zhang L. Chemical components and molecular mass of six polysaccharides isolated from the sclerotium of Poria cocos. Carbohydr Res. 2004;339:327-334. [PubMed] [DOI] |
| 31. | Huang Z, Ren H, Duan X, Zhang L. Chain conformation and bioactivity of water-soluble polysaccharide extracted from Rhizoma Panacis Japonici. Biopolymers. 2010;93:383-390. [PubMed] |