修回日期: 2012-03-19
接受日期: 2012-04-19
在线出版日期: 2012-05-18
目的: 检测TGF-β1和Smad2信号在胃癌中的表达, 探讨TGF-β1和Smad2在胃癌发生、发展中的作用.
方法: 采用免疫蛋白印迹(Western blot)和实时定量PCR检测45例胃癌组织及相应正常组织TGF-β1、Smad2蛋白及mRNA的表达, 比较正常对照、癌组织中上述二者表达的差异, 并进行统计学分析.
结果: TGF-β1在胃癌组织中阳性表达率为77.8%(35/45), 在正常组织中为33.3%(15/45), 二者比较差异显著(P<0.05); Smd2蛋白在胃癌组织中阳性表达率为73.3%(33/45), 在正常组织中为26.7%(12/45), 二者比较有显著差异(P<0.05); TGF-β1、Smad2 mRNA在胃组织中阳性表达率分别为88.9%(40/45)、84.4%(38/45), 均显著高于正常组织(P<0.05). 胃癌组织中TGF-β1、Smad2蛋白的表达与病理分级、浸润深度、淋巴结转移、脉管侵犯相关(P<0.05).
结论: TGF-β1和Smad2可能在胃癌的发生、发展中发挥作用, 并与胃癌的侵袭、转移相关.
引文著录: 沈卫东, 刘鹏飞, 刘兵团, 项斌, 张伟. TGF-β1和Smad2在胃癌中的表达及意义. 世界华人消化杂志 2012; 20(14): 1238-1241
Revised: March 19, 2012
Accepted: April 19, 2012
Published online: May 18, 2012
AIM: To investigate the correlation of the expression of transforming growth factor-β1 (TGF-β1) and mothers against decapentaplegic homolog 2 (Smad2) with the carcinogenesis and tumor progression of human gastric cancer.
METHODS: Western blot and real-time PCR were used to detect the expression of TGF-β1 and Smad2 protein and mRNA in 45 cases of gastric cancer and matched normal gastric mucosal tissues.
RESULTS: The positive rates of TGF-β1 and Smad2 protein expression were significantly higher in gastric cancer than in normal gastric mucosa (77.8% vs 33.3%, 73.3% vs 26.7%, both P < 0.05). The positive rates of TGF-β1 and Smad2 mRNA expression were also significantly higher in gastric cancer than in normal tissue (88.9% vs 35.6%, 84.4% vs 31.1%, both P < 0.05). The protein expression of TGF-β1 and Smad2 was correlated with pathological grade, lesion depth, lymph node metastasis and vessel invasion.
CONCLUSION: Overexpression of TGF-β1 and Smad2 may play an important role in the development and progression of gastric cancer.
- Citation: Shen WD, Liu PF, Liu BT, Xiang B, Zhang W. Expression of TGF-β1 and Smad2 in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1238-1241
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1238.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1238
Smad蛋白家族是转化生长因子β1(transforming growth factor-β1, TGF-β1)超家族细胞内信号转导过程中极其重要的介导分子, 主要介导TGF-β1的生物学信号通路. Smad蛋白家族分为3个不同的亚族: 受体调节型Smad蛋白(R-Smads, 包括Smad2和Smad3)、共调节型Smad蛋白(Co-Smads, 包括Smad4)和抑制性蛋白(I-Smads, 包括Smad6和Smad7). Smad2、3磷酸化与Smad4形成异聚复合体, 将信号从胞浆转移到细胞核中, 与其他转录协同因子和抑制因子共同调节下游靶基因的转录[1]. TGF-β1/Smad通路参与胚胎发育、间质纤维化、肿瘤发生发展和炎症修复反应等诸多生物学过程, 有研究表明, 该通路的异常激活与横纹肌肉瘤、结肠癌等发生有关, 但在胃癌中的表达情况尚未见相关报道[2]. 因此, 探讨TGF-β1和Smad2在胃癌组织中的表达, 有助于阐明其病理生理机制, 并为临床上寻找新的治疗靶标提供坚实的理论依据.
45例胃癌组织及相应的正常组织取自东南大学医学院附属江阴医院2011-01/06期间行手术切除的胃癌患者, 其中男31例, 女14例, 年龄32-77岁(平均62.5岁±10.3岁). 肿瘤组织取自肿块中心未发生坏死的组织, 正常组织取自距肿块5 cm以外区域, 病理检测未见癌细胞浸润, 所有患者术前均未行放、化疗, 所有癌组织标本术后均经病理学专家确诊为胃癌.
根据1997年国际抗癌联盟TNM分期标准将45例胃癌分为Ⅰ/Ⅱ期17例, Ⅲ/Ⅳ期33例. 肿瘤浸润深度: T1/T2期22例, T3/T4期28例(T1: 肿瘤浸润至黏膜或黏膜下层; T2: 肿瘤浸润至肌层或浆膜层; T3: 肿瘤已穿透浆膜层, 但未侵及邻近组织; T4: 肿瘤侵及邻近组织或器官). 按术后病理分为高/中分化10例, 低分化35例. 34例患者手术病理证实存在淋巴结转移, 占60%, 9例有脉管侵犯.
1.2.1 蛋白质印迹法检测TGF-β1/Smad蛋白表达: 将组织匀浆后提取蛋白, BCA法测定总蛋白含量, 取各组总蛋白, 加入5×上样缓冲液6 μL/管. 加去离子水调整每组上样体积为30 μL, 恒压80 V(浓缩胶)、120 V(分离胶). 8%分离胶行SDS-PAGE 80 min, 恒流200 mA, 冰上转膜3 h, 5%脱脂奶粉封闭l h, 分别加入单抗(稀释度1:750)和β-actin单抗(稀释度l:3 000), 室温混悬仪转动2-3 h, 4 ℃孵育过夜; TBST漂洗20 min×3次, 加入二抗(稀释度1:1 000), 室温混悬仪转动2 h, TBST漂洗20 min×3次. ECL显影, 暗室胶片曝光, 洗片. 凝胶定量软件Quantity One分析各条带灰度值, 以β-actin为内参照计算各组蛋白相对表达量.
1.2.2 Real-time PCR检测TGF-β1/Smad2基因表达: TRIzol法提取组织总RNA, 并逆转录为cDNA, 并配制反应体系, 将反应液加入384-Well Clear Optical Reaction Plate内, 每列16个孔均加入同一基因、不同样品的反应体系. 每个反应均设重复孔; 将加完样的384-Well Clear Optical Reaction Plate置入7900HT荧光定量PCR仪中, 按如下的反应条件进行PCR扩增和荧光定量(扩增条件: 95 ℃ 1 min; 95 ℃ 15 s, 60 ℃ 60 s, 40个循环; 60 ℃ 15 s, 最后95 ℃ 15 s). 荧光定量数据分析采用参照基因的△Ct法计算每个样本目的基因的表达值, 其中△Ct值表示基因反应产物的荧光值达到设定的域值时的反应循环数.
统计学处理 应用SPSS16.0进行统计分析, P<0.05具有统计学差异. 计量资料用mean±SD表示, 计数资料用整数表示.
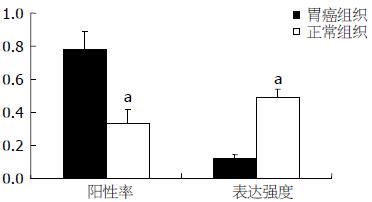
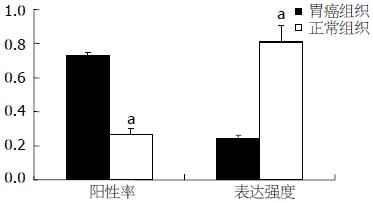
45例胃癌组织中检出TGF-β1蛋白35例(阳性率77.8%), 正常组织中检出15例(阳性率33.3%); 检出Smad2蛋白33例(阳性率为73.3%), 正常组织中检出12例(阳性率为26.7%). 胃癌组织TGF-β1、Smad2蛋白阳性率显著高于正常组织(P = 0.000), 且与正常组织相比, TGF-β1、Smad2在胃癌组织样品中的表达强度分别提高3.9倍(P<0.01)、3.3倍(P<0.01, 图1, 2).
TGF-β1 mRNA在45例胃癌组织中测出40例(88.9%), 正常组织中测出16例(35.6%); 45例胃癌组织中Smad2 mRNA测出38例(84.4%), 正常组织中测出14例(31.1%). 与正常组织相比, 胃癌组织TGF-β1、Smad2 mRNA阳性率显著高于正常组织(P = 0.000), TGF-β1、Smad2、Smad3在胃癌组织样品中的表达强度分别提高3.5倍(P<0.01)、2.6倍(P<0.05).
TGF-β超家族由一类结构、功能相关的多肽生长因子亚家族组成, 其中包括TGF-β1、生长分化因子(growth differentiation factor, GDF)、骨形态发生蛋白(bone morphogenetic protein, BMP)、活化素(activin)等. TGF-β除了对细胞的增殖、分化产生影响, 还在胚胎发育、胞外基质形成、骨的形成和重建等方面起着重要作用[3,4]. TGF-β1超家族成员通过与2种不同型(I型、Ⅱ型)受体结合而发挥作用, 其中I型为丝氨酸(Ser)激酶型受体, Ⅱ型为苏氨酸(Thr)激酶型受体, 而细胞内信号传导的特异性由I型受体决定. TGF-β1参与多种细胞生长调控机制, 在细胞的表型转化中起到极为重要的作用, 并且与恶性肿瘤的生物学行为及预后密切相关. TGF-β1在肿瘤发展过程中可以刺激血管生成、抑制免疫反应、促进细胞外基质(extracellular matrix, ECM)形成, 为肿瘤细胞的快速生长、转移提供良好的局部环境, 成为促进肿瘤发展的因子[5-8].
本组实验中, 胃癌组织中TGF-β1蛋白表达的阳性率为77.8%, mRNA表达的阳性率为88.9%, 均明显高于正常对照组(P<0.05); 正常组织中即使有TGF-β1蛋白表达, 其表达强度亦显著低于癌组织, 提示检测胃癌组织中TGF-β1的表达对于预测肿瘤的恶性程度有一定价值, 也进一步说明TGF-β1可能在肿瘤的发生发展进程及细胞恶性表型转化过程中起重要作用.
Smad蛋白是由Smad基因编码的相对分子质量为42-60 kDa的蛋白质分子, 是TGF-β1受体复合物的下游信号调节蛋白, 存在于胞质中, 可将信号由胞膜传导至胞核调节转录[9,10]. 有研究表明, TGF-β1/Smad2信号途径参与了模纹肌肉瘤、肝癌、结肠癌等的发生发展, 但在胃癌中的表达情况尚未见报道. 研究表明, Smad2与TGF-β1早期诱导基因mRNA对辨别正常及肿瘤组织具有良好敏感性和特异性, 说明Smad2在肿瘤增殖中起重要作用, 且对鉴别正常及肿瘤组织有一定的价值[11-13].
本组研究结果表明, 胃癌组织中Smad2蛋白阳性率为73.3%, 显著高于正常组织(P<0.05). Smad2 mRNA阳性表达水平为84.4%, 正常组织为31.1%, 正常组织中即使有Smad蛋白、mRNA表达, 其表达强度亦显著低于胃癌组织. 提示Smad基因表达的变化参与了胃细胞癌变, 在胃癌的发生、发展中起到了一定作用.
另外, 本研究还发现, 癌旁组织TGF-β1/Smad2蛋白、mRNA均存在差异表达, 即mRNA的表达明显高于蛋白表达, 这种差异表达的真实生物学意义尚不清楚, 或许提示在胃癌形成过程中Smad2基因密码突变而不表达蛋白, 也可能存在某种物质调节或抑制了TGF-β1及Smad2蛋白的翻译, 这些变化直接或间接地参与了胃癌形成过程.
同时我们也研究了TGF-β1、Smad2与胃癌临床病理特征之间的关系, 发现二者的表达均与肿瘤病理分级、淋巴结转移、浸润深度、脉管浸润有相关性, 已发生淋巴结转移或浸润已达到浆膜层的组织、有脉浸润的组织TGF-β1、Smad2表达高(P<0.05), 表明其表达可能与胃癌的浸润、转移有一定相关性. 本研究未发现TGF-β1、Smad2与患者年龄、性别、肿瘤大小等临床病理特征之间有明显相关性. 我们通过对胃癌组织中TGF-β1/Smad2的联合检测, 发现他们是浸润、转移情况的一项重要指标, 具有一定的临床应用前景. 但目前对TGF-β1/Smad2信号通路作用于肿瘤的确切机制尚不完全清楚, 需要进一步深入研究[14,15].
研究表明, TGF-β1/Smad通路的异常激活与横纹肌肉瘤、结肠癌等发生有关, 但在胃癌中的表达情况尚未见相关报道. 探讨TGF-β1和Smad2在胃癌组织中的表达, 有助于阐明其病理生理机制, 并为临床上寻找新的治疗靶标提供坚实的理论依据.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科; 高泽立, 副教授, 上海交大医学院九院周浦分院消化科
TGF-β1、Smad2与患者年龄、性别、肿瘤大小等临床病理特征之间有明显相关性. 通过对胃癌组织中TGF-β1/Smad2的联合检测, 发现他们是浸润、转移情况的一项重要指标, 具有一定的临床应用前景.
通过检测TGF-β1和Smad2信号在胃癌中的表达, 探讨TGF-β1和Smad2在胃癌的发生、发展中的作用, 对胃癌发生机制的研究提供了一些线索, 具有一定的研究意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Todorović-Raković N, Milovanović J, Nikolić-Vukosavljević D. TGF-β and its coreceptors in cancerogenesis: an overview. Biomark Med. 2011;5:855-863. [PubMed] [DOI] |
| 2. | Brase JC, Johannes M, Mannsperger H, Fälth M, Metzger J, Kacprzyk LA, Andrasiuk T, Gade S, Meister M, Sirma H. TMPRSS2-ERG -specific transcriptional modulation is associated with prostate cancer biomarkers and TGF-β signaling. BMC Cancer. 2011;11:507. [PubMed] [DOI] |
| 3. | Gulubova M, Manolova I, Ananiev J, Julianov A, Yovchev Y, Peeva K. Role of TGF-beta1, its receptor TGFbetaRII, and Smad proteins in the progression of colorectal cancer. Int J Colorectal Dis. 2010;25:591-599. [PubMed] [DOI] |
| 4. | 李 晓茹, 李 玉红, 许 倩, 赵 连志, 赵 胜军, 赵 丽. 转化生长因子-β1对绒癌JEG-3细胞MMP-9 mRNA及TIMP-1 mRNA表达的影响. 山东医药. 2009;49:18-22. |
| 5. | Hsu YC, Chen MJ, Yu YM, Ko SY, Chang CC. Suppression of TGF-β1/SMAD pathway and extracellular matrix production in primary keloid fibroblasts by curcuminoids: its potential therapeutic use in the chemoprevention of keloid. Arch Dermatol Res. 2010;302:717-724. [PubMed] [DOI] |
| 6. | 黄 忠诚, 杨 竹林, 李 永国, 钟 德玝, 王 群伟, 黄 生福. 胰腺癌组织smad4 mRNA, TGF-β1和TGF-βR1的表达及意义. 中国普通外科杂志. 2002;11:609-611. |
| 7. | Ijichi H, Ikenoue T, Kato N, Mitsuno Y, Togo G, Kato J, Kanai F, Shiratori Y, Omata M. Systematic analysis of the TGF-beta-Smad signaling pathway in gastrointestinal cancer cells. Biochem Biophys Res Commun. 2001;289:350-357. [PubMed] [DOI] |
| 9. | 陈 伟, 付 小兵, 盛 志勇. Smads蛋白结构与功能的研究进展. 中华医学杂志(英文版). 2002;115:446-450. |
| 11. | Yu C, Liu Y, Huang D, Dai Y, Cai G, Sun J, Xu T, Tian Y, Zhang X. TGF-β1 mediates epithelial to mesenchymal transition via the TGF-β/Smad pathway in squamous cell carcinoma of the head and neck. Oncol Rep. 2011;25:1581-1587. [PubMed] |
| 13. | Halder SK, Cho YJ, Datta A, Anumanthan G, Ham AJ, Carbone DP, Datta PK. Elucidating the mechanism of regulation of transforming growth factor β Type II receptor expression in human lung cancer cell lines. Neoplasia. 2011;13:912-922. [PubMed] |
| 14. | Reinholz MM, An MW, Johnsen SA, Subramaniam M, Suman VJ, Ingle JN, Roche PC, Spelsberg TC. Differential gene expression of TGF beta inducible early gene (TIEG), Smad7, Smad2 and Bard1 in normal and malignant breast tissue. Breast Cancer Res Treat. 2004;86:75-88. [PubMed] [DOI] |
| 15. | Banz-Jansen C, Münchow B, Diedrich K, Finas D. Bridge-1 is expressed in human breast carcinomas: silencing of Bridge-1 decreases Smad2, Smad3 and Smad4 expression in MCF-7 cells, a human breast cancer cell line. Arch Gynecol Obstet. 2011;284:1543-1549. [PubMed] [DOI] |