修回日期: 2012-03-15
接受日期: 2012-04-17
在线出版日期: 2012-05-18
目的: 探讨我国广西壮族人群NOD2/CARD15基因R702W、G908R及L1007fs的遗传多态性与炎症性肠病的相关性.
方法: 分别收集2007-02/2010-10在广西地区无亲缘关系的壮族(n = 70)和汉族(n = 76)IBD患者及壮族(n = 80)和汉族(n = 84)正常对照者的肠黏膜组织. 采用酚氯仿法提取各组织样本DNA, 采用聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)方法对NOD2/CARD15基因R702W、G908R及L1007fs进行检测, 统计基因型及等位基因频率, 分析上述3个多态性位点与广西壮族人群炎症性肠病的相关性.
结果: 广西壮族和汉族IBD患者与正常对照者均未发现NOD2/CARD15基因R702W、G908R及L1007fs突变型基因型, 所有多态性位点上的基因型全部为野生型纯合子, 其基因型频率和等位基因频率分布在IBD患者和正常对照者中差异无统计学意义(P>0.05).
结论: NOD2/CARD15基因R702W、G908R及L1007fs多态性与广西壮族人群炎症性肠病无明显相关性.
引文著录: 林美娇, 吕小平, 陈兰, 詹灵凌. NOD2/CARD15基因R702W、G908R及L1007fs多态性与广西壮族人群炎症性肠病的相关性. 世界华人消化杂志 2012; 20(14): 1210-1215
Revised: March 15, 2012
Accepted: April 17, 2012
Published online: May 18, 2012
AIM: To investigate the relationship between R702W, G908R and L1007fs polymorphisms of the NOD2/CARD15 gene and susceptibility to inflammatory bowel disease (IBD) in a Zhuang population in Guangxi, China.
METHODS: Intestinal tissue samples of 70 Zhuang and 76 Han unrelated IBD patients and 80 Zhuang and 84 Han unrelated healthy people were collected in Guangxi from February 2007 to October 2010. Genomic DNA was prepared from these intestinal samples and used to genotype the R702W, G908R and L1007fs polymorphisms of the NOD2/CARD15 gene by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP).
RESULTS: None of the patients with IBD and healthy controls had heterozygous or homozygous SNP variants. The distributions of genotype and allele frequencies were not significantly different between the IBD group and healthy control group. No significant differences were noted in the NOD2/CARD15 gene R702W, G908R and L1007fs polymorphisms among patients with Crohn's disease, ulcerative colitis and control subjects in Zhuang and Han populations in Guangxi (all P > 0.05). Gene mutation genotypes of the NOD2/CARD15 gene R702W, G908R and L1007fs polymorphisms were not found in these populations.
CONCLUSION: R702W, G908R and L1007fs polymorphisms of the NOD2/CARD15 gene are not associated with susceptibility to IBD in the Zhuang population in Guangxi.
- Citation: Lin MJ, Lv XP, Chen L, Zhan LL. Correlation of R702W, G908R and L1007fs polymorphisms of the NOD2/CARD15 gene with susceptibility to inflammatory bowel disease in Zhuang population in Guangxi, China. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1210-1215
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1210.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1210
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(Ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)两种临床类型. 目前关于炎症性肠病的病因和发病机制尚未有定论, 大多数学者的观点是携带遗传易感基因的人群在环境因素、细菌感染及自身免疫等多种因素的共同作用下, 引起肠道黏膜慢性感染, 黏膜抗原屏障缺陷, 自身免疫功能失衡最终导致疾病的发生[1,2]. 其中, 遗传易感性在IBD发病中起着重要作用. 迄今, 已发现多个与西方白人IBD发病相关的易感基因和易感单核苷酸多态性(single nucleotide polymorphism, SNP)位点[3-5]. NOD2/CARD15基因是第1个被发现的CD易感基因, 已证实该基因上的3个SNPs(R702W、G908R和L1007fs)与西方白种人CD有显著相关性[6,7], 但在亚洲人群中未得到证实[8-10]. 在广西壮族人群中, NOD2/CARD15基因变异与IBD的相关性如何目前尚未见报道. 因此, 本研究以广西壮族人群为研究样本, 通过聚合酶链限制性片段分析(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)方法对NOD2基因的多态性位点进行检测, 从分子水平上探讨该基因多态性与广西壮族人群炎症性肠病的相关性.
收集2007-02/2010-10广西医科大学第一附属医院消化内科就诊的广西地区无亲缘关系的IBD患者146例, 男74例, 女72例, 年龄38岁±11岁, UC患者86例, CD患者60例, 其中壮族患者70例, 汉族患者76例. UC及CD诊断参照2007年中华医学会消化病学分会制定的标准[9], 并除外合并其他自身免疫性疾病. 另取广西地区无亲缘关系的健康对照者164例, 男81例, 女83例, 年龄42岁±9岁, 其中壮族80例, 汉族84例. IBD组和健康对照组间年龄及性别比较差异无统计学意义(P>0.05).
1.2.1 基因组DNA的提取: 收集两组新鲜的肠黏膜组织约30-50 mg, 保存于液氮灌中. 将新鲜标本用生理盐水清洗干净、剪碎, 加入450 µL TES、50 µL 10%SDS和5 µL蛋白酶K(20 g/L), 混匀后置于56 ℃水浴4-6 h, 加入等体积苯酚, 混匀后4 ℃, 12 000 r/min离心10 min; 提取上清液于另一试管, 加入等体积酚、氯仿和异戊醇(25:24:1), 混匀后4 ℃, 12 000 r/min离心10 min; 提取上清液于另一试管, 加入等体积氯仿和异戊醇(24:1), 混匀后4 ℃, 12 000 r/min离心10 min. 提取上清液移至另一试管中, 加入2.5倍体积无水乙醇, 反复抽吸直至看到白色絮状沉淀完全析出; 在白色絮状物中加入75%乙醇混匀洗涤2次, 4 ℃, 12 000 r/min离心5 min, 去掉上清液, 放置于冰箱挥干, 将挥干的DNA加入50-100 μL TE溶解, -20 ℃保存, 并测定DNA纯度与浓度.
1.2.2 PCR扩增目的片段: 采用限制性片段长度PCR技术扩增NOD2/CARD15目的基因. 引物序列参考文献[10]设计, 由上海生工生物工程技术有限公司合成(表1). PCR反应总体系为25 µL, 包括10×PCR buffer 2.5 µL, 2×Taq 酶1 U, dNTP mix 0.5 µL, 上下游引物各1 µL, DNA模版1 µL, ddH2O补足至25 µL. PCR扩增反应条件: 94 ℃预变性5 min; 94 ℃变性35 s, 退火40 s(温度见表1), 72 ℃延伸50 s, 35个循环; 72 ℃终末延伸5 min. PCR产物置4 ℃冰箱保存, 取PCR产物于2%琼脂糖凝胶电泳, 并在紫外分析仪下分析鉴定.
| SNPs | 引物序列 | 片段长度(bp) | 退火温度(℃) |
| R702W | F: 5'TTCAGATCACAGCAGCCTTC3' | 313 | 53 |
| R: 5'CCCACACTGCAAAATGTCAAC3' | |||
| G908R | F: 5'TCTGGCTGGGACTGCAGAGG3' | 131 | 56 |
| R: 5'CCCCTCGTCACCCACTCTGTCGC3' | |||
| 3020insC | F: 5'GGCAGAAGCCCTCCTGCAGGGCC3' | 151 | 63 |
| R: 5'CCTCAAAATTCTGCCATTCC3' |
1.2.3 PCR-RFLP: 取PCR产物10 µL, 分别加入10×Buffer缓冲液1.5 µL, 限制性内切酶1 µL, 灭菌双蒸水1.5 µL, 使反应总体系为15 µL, 混匀后1 000 r/min离心1 min, 置于37 ℃的恒温水浴箱中酶切消化10 h. 将酶切好的PCR产物10 µL, 加样到含有核酸染料(Goldview)的3%琼脂糖凝胶中, 以1×TBE为电泳缓冲液, 100 V电泳40-60 min, 在紫外分析成像仪上拍照并保存图像(各位点对应的内切酶及酶切后片段大小见表2).
| SNP | 突变点 | 内切酶 | 野生型酶切片段(bp) | 突变型酶切片段 |
| R702W | 2104C→T | MspⅠ | 34, 20, 259 | 130, 183 |
| G908R | 2722G→C | BstUⅠ | 131 | 109, 22 |
| 1007finsC | 3020insC | ApaⅠ | 151 | 20, 131 |
统计学处理 采用统计学软件SPSS15.0进行分析, 用计数法计算R702W、g908R及L1007fs 3个多态性位点基因型频率和等位基因频率, 并进行Hardy-Weinberg遗传平衡检验, 比较各组间基因型及等位基因分布的差异采用χ2检验, P<0.05表示差异有统计学意义.
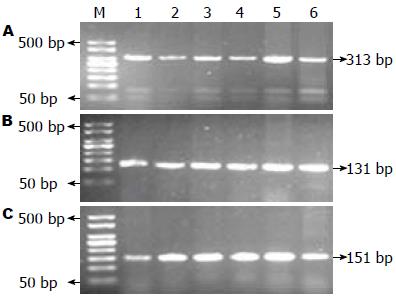
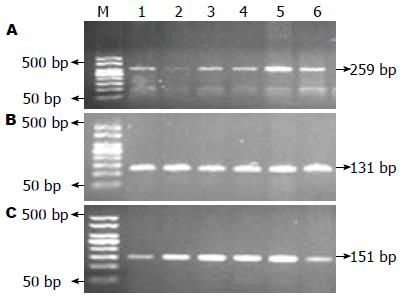
所有研究对象的PCR产物与目的片段大小一致, R702W、G908R、L1007fs位点扩增的目的长度分别为313 bp、131 bp、151 bp(图1), 说明扩增成功.
2.2.1 R702W位点: PCR扩增产物长度为313 bp, 被限制性内切酶MspⅠ酶切后, CC纯合子可被酶切成259 bp、20 bp和34 bp 3个片段, CT杂合子可被酶切成259 bp、20 bp、34 bp、130 bp、183 bp和313 bp 6个片段, TT纯合子则被切割成130 bp和183 bp 2个片段. 图2A为R702W位点的酶切电泳结果, 均为CC纯合子基因型, 未发现突变型基因型(因20 bp和34 bp片段过小, 电泳后已移到凝胶以外).
2.2.2 G908R位点: PCR扩增产物长度为131 bp, 被限制性内切酶BstUⅠ酶切后, CC纯合子可被酶切成109 bp和22 bp 2个片段, GC杂合子可被酶切成22 bp、109 bp和131 bp 3个片段, GG纯合子则不能被切割. 图2B为G908R的酶切电泳图, 均为GG纯合子.
2.2.3 L1007fs位点: PCR产物长度为151 bp, 经限制性内切酶ApaⅠ酶切后, 纯合子突变型可被酶切成20 bp和131 bp 2个片段, 杂合子突变型可被酶切成20 bp、131 bp和151 bp 3个片段, 纯合子野生型则不能被切割. 图2C为L1007fs酶切电泳图结果, 均为纯合子野生型.
对NOD2/CARD15基因的3个SNP(R702W、G908R和L1007fs)位点的基因型和等位基因频率分布进行Hardy-Weinberg平衡检验, 各组间差异无统计学意义(χ2 = 0.000, P = 1.000, P>0.05), 说明病例组和对照组均是达到遗传平衡的群体, 具有群体代表性. 在IBD患者和正常对照者中, NOD2/CARD15基因3个常见多态性位点的基因型均为野生型纯合子, 未发现突变型基因型; IBD患者与正常对照组NOD/CARD15基因的3个等位基因携带频率比较差异无统计学意义(均P>0.05, 表3), 提示NOD2/CARD15基因的R702W、G908R及L1007fs位点的多态性可能与中国广西壮族自治区的IBD无明显相关性.
| SNPs | 基因型 | IBD(壮族, n) | IBD(汉族, n) | 正常对照组(n) |
| R702W | C/C | 70 | 76 | 164 |
| C/T | 0 | 0 | 0 | |
| T/T | 0 | 0 | 0 | |
| T等位基因频率(%) | 0 | 0 | 0 | |
| G908R | G/G | 70 | 76 | 164 |
| G/C | 0 | 0 | 0 | |
| C/C | 0 | 0 | 0 | |
| C等位基因频率(%) | 0 | 0 | 0 | |
| 1007finsC | WT/WT | 70 | 76 | 164 |
| WT/M | 0 | 0 | 0 | |
| M/M | 0 | 0 | 0 | |
| insC等位基因频率(%) | 0 | 0 | 0 |
人类NOD2/CARD15基因位于16q12, 编码的NOD2蛋白包含2个N末端caspase征集区(caspase recruitment domain, CARD), 1个中央核酸结合域(nucleotide binding domain, NBD)和1个C末端富含亮氨酸重复区(Leucine rich repeat, LRR), LRR区域具有结合脂多糖(lipopolysaccharide, LPS)和胞壁酰二态(muramyl dipeptide, MDP)等微生物成分的活性. NOD2蛋白是参与细胞凋亡调控的Apaf-ced4超家族的第3成员, 主要在外周血单核巨噬细胞中表达, 其功能包括介导细胞凋亡、诱导核因子(nuclear transcription factor-κB, NF-κB)活化以及影响肠道先天性防御功能如小肠潘氏细胞防御素的表达[11]. NOD2蛋白的功能与自身结构密切相关, 当基因发生突变时, 其编码的蛋白功能也将发生改变. NOD2通过激活NF-κB而参与应答细菌LPS和PGNs的免疫反应, 然后通过信号转导途径诱导一系列炎性细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素及抗炎因子的转录和表达, 这些炎性因子可引起炎性细胞向病原体侵入部位作趋化运动并释放炎性介质, 引起局部防御性炎性改变[12]. NOD2/CARD15基因发生突变时均可降低NF-κB的活性, 使人体对细菌产物的先天性免疫反应减弱, 受到未及时清除的细胞成分及细菌产物的损害, 导致CD特征性的肠道改变[13]. 有研究发现转染野生型NOD2的Caco2细胞清除细菌的能力明显强于转染突变型NOD2的细胞, 机制可能是CARD15通过LRR识别细菌肽聚糖MDP, 后刺激包括α防御素等抗微生物肽的分泌来保护机体[13], 在CD患者体内防御素水平下降, 尤其是携带NOD2基因变异的患者体内下降更明显, 这也支持了NOD2基因突变与CD发病相关的结论. 大多数研究表明, NOD2基因的3个多态性只与CD相关, 而与UC无关, 并且与CD患者的发病年龄、发病部位、病情严重程度及是否有并发症密切相关[14-16], 说明了UC和CD为IBD的2种不同临床类型.
对比多个国内外的研究结果, 发现NOD2/CARD15基因3个SNP位点的基因型和等位基因携带频率分布均存在明显的地域、种族及人群的差异, 即研究样本的种族和遗传背景不同, 研究结果也不一致. 在高加索白人IBD患者中, NOD2基因的3个等位基因携带频率分别为R702W 3.5%-12.9%, G908W 0.8%-6%, L1007fs 1.7%-13.7%, 而在挪威3个等位基因的携带率相对较低[15-17]. 普遍认为, NOD2突变率在北美、欧洲中部和西部发生率较高(19.1%-29%), 而非裔美国人的突变率却较低(2.6%)[18-21]. NOD2基因多态性与亚洲人群的相关性研究与西方国家研究结果不一致, NOD2基因3个SNP的突变率在亚洲人群中(包括日本、中国浙江、香港和韩国[10,22-24])不存在或者极低. 另外, 对巴西IBD患者的研究发现R702W突变率(9.63%)与欧洲人群相似, 而3020insC突变率(3.47%)却比西欧、北美国家低(6%-16%)低, 这一现象在芬兰、苏格兰、西班牙也可观察到[25-29]. 这些充分说明不同的基因突变型对不同种族和不同地区人群的IBD发病易感性的影响不同, 种族差异性是遗传异质性的分子基础之一, 验证了基因多态性作为疾病易感性遗传标记的复杂性.
本研究通过PCR-RFLP分析方法对NOD2/CARD15的3个单核苷酸多态性位点与中国广西壮族IBD患者的相关性进行检测. 在146例IBD患者和164例健康对照者中均未能检测到NOD2/CARD15基因R702W、G908W及L1007fs的突变, 提示这3个西方白种人常见的NOD2基因多态性位点发生率在中国广西壮族人群中极低或者不存在, 说明NOD2/CARD15基因R702W、G908W及L1007fs多态性可能与中国广西壮族人群IBD发病的易感性无相关性. 而在其他国家和地区报道他们与IBD发病的易感性有相关性, 可能是由于明显的地域、种族及人群的差异性所致.
研究发现遗传易感性在炎症性肠病(IBD)发病中起着重要作用. NOD2/CARD15基因是第1个被发现的CD易感基因, 已证实该基因上的3个SNPs(R702W、G908R和L1007fs)与西方白种人CD有显著相关性, 但在亚洲人群中未得到证实.
任粉玉, 教授, 延边大学附属医院消化内科
IBD是一种复杂的多基因疾病, 其易感性涉及多个基因位点, 且有着显著的种族、地域和人群差异性, 其具体的发生机制及如何将其运用于IBD患者的诊断和治疗尚待进一步研究. 迄今为止, 还没有找到与我国乃至亚洲IBD人群明显相关的基因和SNP位点.
本研究通过PCR-RFLP分析方法发现NOD2/CARD15基因R702W、G908W及L1007fs的单核苷酸多态性位点与中国广西壮族人群IBD发病的易感性无相关性, 而与西方白种人CD有显著相关性, 提示IBD基因单核苷酸多态性位点突变有着显著的种族和地域差异性.
IBD基因单核苷酸多态性位点突变有着显著的种族和地域差异性. 因此, 在我国人群中应展开大规模的易感基因及易感突变位点的筛查.
PCR-RFLP: 聚合酶链限制性片段分析, 是集限制性内切酶、核酸电泳、印迹技术、探针杂交等技术于一体的综合应用, 多用于临床遗传性疾病的基因诊断, 其常用于生物群体的遗传分析.
本研究提示NOD2/CARD15基因的3个单核苷酸多态性位点可能与中国广西壮族人群IBD发病的易感性无相关性, 这对于研究我国壮族人群IBD遗传易感基因有较重要的临床意义, 具有较好的实用性.
编辑: 张姗姗 电编:鲁亚静
| 1. | Irving PM, Gibson PR. Infections and IBD. Nat Clin Pract Gastroenterol Hepatol. 2008;5:18-27. [PubMed] [DOI] |
| 2. | Matricon J, Barnich N, Ardid D. Immunopathogenesis of inflammatory bowel disease. Self Nonself. 2010;1:299-309. [PubMed] [DOI] |
| 3. | Gazouli M, Pachoula I, Panayotou I, Mantzaris G, Chrousos G, Anagnou NP, Roma-Giannikou E. NOD2/CARD15, ATG16L1 and IL23R gene polymorphisms and childhood-onset of Crohn's disease. World J Gastroenterol. 2010;16:1753-1758. [PubMed] [DOI] |
| 4. | Cucchiara S, Latiano A, Palmieri O, Staiano AM, D'Incà R, Guariso G, Vieni G, Rutigliano V, Borrelli O, Valvano MR. Role of CARD15, DLG5 and OCTN genes polymorphisms in children with inflammatory bowel diseases. World J Gastroenterol. 2007;13:1221-1229. [PubMed] |
| 5. | Newman WG, Zhang Q, Liu X, Amos CI, Siminovitch KA. Genetic variants in IL-23R and ATG16L1 independently predispose to increased susceptibility to Crohn's disease in a Canadian population. J Clin Gastroenterol. 2009;43:444-447. [PubMed] [DOI] |
| 6. | Lapis K. [Barrier- and autophagic functions of the intestinal epithelia: role of disturbances in the pathogenesis of Crohn's disease]. Orv Hetil. 2010;151:1645-1655. [PubMed] [DOI] |
| 7. | Bamias G, Cominelli F. Immunopathogenesis of inflammatory bowel disease: current concepts. Curr Opin Gastroenterol. 2007;23:365-369. [PubMed] [DOI] |
| 8. | Peltekova VD, Wintle RF, Rubin LA, Amos CI, Huang Q, Gu X, Newman B, Van Oene M, Cescon D, Greenberg G. Functional variants of OCTN cation transporter genes are associated with Crohn disease. Nat Genet. 2004;36:471-475. [PubMed] [DOI] |
| 10. | Li M, Gao X, Guo CC, Wu KC, Zhang X, Hu PJ. OCTN and CARD15 gene polymorphism in Chinese patients with inflammatory bowel disease. World J Gastroenterol. 2008;14:4923-4927. [PubMed] [DOI] |
| 11. | Strober W, Watanabe T. NOD2, an intracellular innate immune sensor involved in host defense and Crohn's disease. Mucosal Immunol. 2011;4:484-495. [PubMed] [DOI] |
| 12. | Salucci V, Rimoldi M, Penati C, Sampietro GM, van Duist MM, Matteoli G, Saibeni S, Vecchi M, Ardizzone S, Porro GB. Monocyte-derived dendritic cells from Crohn patients show differential NOD2/CARD15-dependent immune responses to bacteria. Inflamm Bowel Dis. 2008;14:812-818. [PubMed] [DOI] |
| 13. | Hruz P, Eckmann L. Innate immune defence: NOD2 and autophagy in the pathogenesis of Crohn's disease. Swiss Med Wkly. 2011;140:w13135. [PubMed] |
| 14. | Okazaki T, Wang MH, Rawsthorne P, Sargent M, Datta LW, Shugart YY, Bernstein CN, Brant SR. Contributions of IBD5, IL23R, ATG16L1, and NOD2 to Crohn's disease risk in a population-based case-control study: evidence of gene-gene interactions. Inflamm Bowel Dis. 2008;14:1528-1541. [PubMed] [DOI] |
| 15. | Núñez C, Barreiro M, Domínguez-Muñoz JE, Lorenzo A, Zapata C, Peña AS. CARD15 mutations in patients with Crohn's disease in a homogeneous Spanish population. Am J Gastroenterol. 2004;99:450-456. [PubMed] [DOI] |
| 16. | Protic MB, Pavlovic ST, Bojic DZ, Krstic MN, Radojicic ZA, Tarabar DK, Stevanovic AZ, Karan Djurasevic TZ, Godjevac MV, Svorcan PV. CARD15 gene polymorphisms in Serbian patients with Crohn's disease: genotype-phenotype analysis. Eur J Gastroenterol Hepatol. 2008;20:978-984. [PubMed] [DOI] |
| 17. | Mitrovič M, Potočnik U. High-resolution melting curve analysis for high-throughput genotyping of NOD2/CARD15 mutations and distribution of these mutations in Slovenian inflammatory bowel diseases patients. Dis Markers. 2011;30:265-274. [PubMed] |
| 18. | Hugot JP, Zaccaria I, Cavanaugh J, Yang H, Vermeire S, Lappalainen M, Schreiber S, Annese V, Jewell DP, Fowler EV. Prevalence of CARD15/NOD2 mutations in Caucasian healthy people. Am J Gastroenterol. 2007;102:1259-1267. [PubMed] [DOI] |
| 19. | van der Linde K, Boor PP, Houwing-Duistermaat JJ, Crusius BJ, Wilson PJ, Kuipers EJ, de Rooij FW. CARD15 mutations in Dutch familial and sporadic inflammatory bowel disease and an overview of European studies. Eur J Gastroenterol Hepatol. 2007;19:449-459. [PubMed] [DOI] |
| 20. | Rigoli L, Romano C, Caruso RA, Lo Presti MA, Di Bella C, Procopio V, Lo Giudice G, Amorini M, Costantino G, Sergi MD. Clinical significance of NOD2/CARD15 and Toll-like receptor 4 gene single nucleotide polymorphisms in inflammatory bowel disease. World J Gastroenterol. 2008;14:4454-4461. [PubMed] |
| 21. | Lakatos PL, Lakatos L, Szalay F, Willheim-Polli C, Osterreicher C, Tulassay Z, Molnar T, Reinisch W, Papp J, Mozsik G. Toll-like receptor 4 and NOD2/CARD15 mutations in Hungarian patients with Crohn's disease: phenotype-genotype correlations. World J Gastroenterol. 2005;11:1489-1495. [PubMed] |
| 22. | Inoue N, Tamura K, Kinouchi Y, Fukuda Y, Takahashi S, Ogura Y, Inohara N, Núñez G, Kishi Y, Koike Y. Lack of common NOD2 variants in Japanese patients with Crohn's disease. Gastroenterology. 2002;123:86-91. [PubMed] [DOI] |
| 23. | Wang ZW, Ji F, Teng WJ, Yuan XG, Ye XM. Risk factors and gene polymorphisms of inflammatory bowel disease in population of Zhejiang, China. World J Gastroenterol. 2011;17:118-122. [PubMed] [DOI] |
| 24. | Leong RW, Armuzzi A, Ahmad T, Wong ML, Tse P, Jewell DP, Sung JJ. NOD2/CARD15 gene polymorphisms and Crohn's disease in the Chinese population. Aliment Pharmacol Ther. 2003;17:1465-1470. [PubMed] [DOI] |
| 25. | Medici V, Mascheretti S, Croucher PJ, Stoll M, Hampe J, Grebe J, Sturniolo GC, Solberg C, Jahnsen J, Moum B. Extreme heterogeneity in CARD15 and DLG5 Crohn disease-associated polymorphisms between German and Norwegian populations. Eur J Hum Genet. 2006;14:459-468. [PubMed] [DOI] |
| 26. | Arnott ID, Nimmo ER, Drummond HE, Fennell J, Smith BR, MacKinlay E, Morecroft J, Anderson N, Kelleher D, O'Sullivan M. NOD2/CARD15, TLR4 and CD14 mutations in Scottish and Irish Crohn's disease patients: evidence for genetic heterogeneity within Europe? Genes Immun. 2004;5:417-425. [PubMed] [DOI] |
| 27. | Baptista ML, Amarante H, Picheth G, Sdepanian VL, Peterson N, Babasukumar U, Lima HC, Kugathasan S. CARD15 and IL23R influences Crohn's disease susceptibility but not disease phenotype in a Brazilian population. Inflamm Bowel Dis. 2008;14:674-679. [PubMed] [DOI] |
| 28. | Tukel T, Shalata A, Present D, Rachmilewitz D, Mayer L, Grant D, Risch N, Desnick RJ. Crohn disease: frequency and nature of CARD15 mutations in Ashkenazi and Sephardi/Oriental Jewish families. Am J Hum Genet. 2004;74:623-636. [PubMed] [DOI] |
| 29. | Lappalainen M, Halme L, Turunen U, Saavalainen P, Einarsdottir E, Färkkilä M, Kontula K, Paavola-Sakki P. Association of IL23R, TNFRSF1A, and HLA-DRB1*0103 allele variants with inflammatory bowel disease phenotypes in the Finnish population. Inflamm Bowel Dis. 2008;14:1118-1124. [PubMed] [DOI] |