修回日期: 2012-03-15
接受日期: 2012-04-17
在线出版日期: 2012-05-18
目的: 探讨IL-17细胞因子在TNBS诱导的炎性肠病动物模型中的表达变化, 明确IL-17和脂多糖(LPS)在诱导HT-29肠上皮细胞IL-8表达中的协同作用及细胞内信号机制探讨肝衰竭患者血浆(liver failure plasma, LFP)抑制HepG2细胞生长、增殖的机制及表皮生长因子(epidermal growth factor, EGF)对其抑制作用的调控作用.
方法: 通过用50%LFP与HepG2细胞共同培养(肝衰竭组), 以相同浓度正常人血浆(正常对照组)作对照. 采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)、Hoechst法分别观察不同时间点细胞增殖率及凋亡率, 并用Western blotting法检测细胞周期蛋白Cyclin D1、细胞周期蛋白依赖激酶4(cyclin-dependent kinase 4, CDK4)表达. 进一步观察不同浓度EGF对LFP培养的HepG2细胞生长及增殖的刺激作用.
结果: 50%LFP对HepG2细胞生长及增殖有明显的抑制作用, 且呈时间依赖性. EGF对正常对照组HepG2细胞的生长及增殖有明显促进作用, 但仅大剂量EGF对肝衰竭组HepG2细胞生长和增殖有一过性刺激作用. 与EGF刺激正常对照组比较, 肝衰竭组各时间点细胞增殖仍受到明显抑制. LFP与HepG2细胞培养后, 细胞凋亡率无明显增加(P>0.05). 随着作用时间的延长, LFP抑制HepG2细胞内Cyclin D1、CDK4的表达.
结论: LFP对HepG2细胞生长及增殖具有较强的抑制作用, 但并不明显诱导其凋亡. 大剂量EGF对LFP培养的HepG2细胞增殖虽有一过性刺激作用, 但并不能逆转其抑制作用. LFP抑制HepG2细胞生长和增殖的机制可能与其抑制细胞内Cyclin D1、CDK4的表达有关.
引文著录: 李玮, 林世德, 龙骏. 肝衰竭患者血浆对HepG2细胞增殖的抑制及表皮生长因子的调控作用. 世界华人消化杂志 2012; 20(14): 1204-1209
Revised: March 15, 2012
Accepted: April 17, 2012
Published online: May 18, 2012
AIM: To explore the mechanisms by which plasma from patients with liver failure inhibits the proliferation of HepG2 cells and to evaluate whether epidermal growth factor (EGF) can reverse this inhibitory effect.
METHODS: Plasma samples were collected from three patients with acute-on-chronic liver failure during plasma exchange therapy and treated with heparin. After HepG2 cells were cultured in medium containing 50% plasma from patients with liver failure with or without EGF stimulation, cell proliferation and apoptosis were detected by methyl thiazolyl tetrazolium (MTT) assay and Hoechst staining, respectively. The expression of intracellular cyclin D1 and cyclin-dependent kinase 4 (CDK4) in HepG2 cells was examined by Western blotting.
RESULTS: Treatment with 50% plasma from patients with liver failure for 12 to 72 hours significantly inhibited the proliferation of HepG2 cells in a time-dependent manner when compared to cells cultured with 50% normal control plasma (NCP). EGF at a concentration of 5, 10 or 20 μg/L significantly induced the proliferation of HepG2 cells cultured with NCP, while only high-dose EGF (20 μg/L) showed a transient promotion to the proliferation of HepG2 cells cultured with plasma from patients with liver failure. After stimulation with 20 μg/L EGF, the proliferation was still significantly inhibited in cells cultured with patient plasma compared to those cultured with NCP. The presence of 50% patient plasma did not significantly alter apoptosis index of HepG2 cells (P > 0.05). The expression of intracellular cyclin D1 and CDK4 in HepG2 cells was obviously inhibited after treatment with patient plasma for 12 to 72 hours.
CONCLUSION: Plasma from patients with liver failure inhibits the proliferation of HepG2 cells possibly by down-regulating the expression of intracellular cyclin D1 and CDK4. EGF can not reverse this inhibitory effect.
- Citation: Li W, Lin SD, Long J. Plasma from patients with liver failure inhibits the proliferation of HepG2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1204-1209
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1204
我国有1.3亿慢性乙型肝炎病毒感染者, 部分慢性乙型肝炎患者病情恶化发展为慢加急性肝衰竭[1,2]. 目前国内外对肝衰竭的内科治疗缺乏有效手段, 其死亡率高达50%-80%[3]. 越来越多的研究表明, 肝衰竭患者存在肝再生障碍是其死亡率高的一个主要因素[4-6]. 因此, 探讨肝衰竭患者肝再生障碍的原因及提高肝再生能力的可能性对提高肝衰竭患者生存率有重要临床意义.
目前国内外对肝衰竭患者肝再生障碍的机制尚未阐明, 有研究提示肝衰竭患者血清抑制肝细胞生长和增殖, 但对其机制缺乏深入了解; 另外有研究提示肝衰竭患者外周血肝再生刺激因子与肝再生抑制因子的不平衡升高可能是其肝再生迟缓的原因之一, 但临床上广泛使用促肝细胞生长素治疗肝衰竭的疗效有限, 肝再生刺激因子能不能促进肝衰竭患者肝细胞增殖尚缺乏实验依据. 在本研究中, 我们通过观察肝衰竭患者血浆(liver failure plasma, LFP)对HepG2细胞生长和增殖、细胞增殖相关蛋白Cyclin D1及其辅助激酶(cyclin-dependent kinase 4, CDK4)表达的影响, 初步探讨LFP抑制肝细胞生长和增殖的机制. 并进一步探讨不同浓度表皮细胞生长因子(epidermal growth factor, EGF)对LFP抑制肝细胞生长和增殖的调控作用.
人肝癌细胞株HepG2购自上海细胞库(ATCC); DMEM高糖培养基购自Gibco公司; 新生小牛血清购自杭州四季清公司; 四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)细胞增殖试剂盒购自上海凯基生物有限公司; Hoechst细胞凋亡染色试剂盒购自碧云天生物有限公司; 表皮生长因子购自R&D公司; 鼠抗人Cyclin D1多克隆抗体、兔抗人CDK4多克隆抗体及内参β-actin抗体购自美国Santa cruz公司; 辣根过氧化物酶标记羊抗鼠或羊抗兔IgG抗体购自碧云天生物有限公司.
实验所用血浆来自本科室3例慢加急性LFP置换时分离血浆, 实验前血浆未经过任何处理. 诊断参照中华医学会感染病学分会和肝病学分会修订的《肝衰竭诊疗指南》诊断标准[7]. 患者均为乙型肝炎病毒感染, 并除外甲型、丙型、戊型肝炎病毒感染. 血浆置换前, 3例患者均未使用过促肝细胞生长素、糖皮质激素、胰岛素等已知对肝细胞生长和增殖有影响的药物治疗. 3例患者凝血功能和生化等检查如下: 凝血酶原时间23.7 s±10.6 s, 总胆红素680.1 μmol/L±153.1 μmol/L, 总蛋白28.7 g/L±2.0 g/L. HBsAg均阳性, HBV-DNA都在106 copies/mL以上. 用50%正常人血浆(normal control plasma, NCP)作对照, 正常对照血浆来自3例肝功能正常的本院职工, 除外肝炎病毒感染, 年龄及性别与肝衰竭患者无统计学差异. 根据预实验采用10%、20%、30%、40%、50%浓度LFP与HepG2细胞培养, 发现50%LFP抑制作用最明显, 因此, 本实验选择50%LFP进行. 所有实验都采用3例LFP并重复2次进行, 最后取平均值.
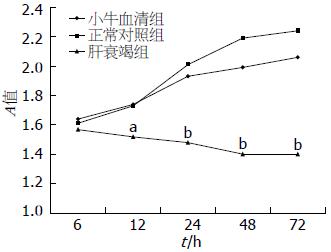
1.2.1 MTT法检测细胞增殖实验: 以含100 mL/L小牛血清的DMEM培养基调整HepG2细胞至1×104/mL浓度, 接种于96孔板中培养6 h, 去除培养基, 用无血清培养基同步后, 磷酸盐缓冲液(PBS)冲洗3遍, 分别加入含50%LFP(肝衰竭组)、50%NCP(正常对照组)和100 mL/L小牛血清的DMEM培养继续培养6、12、24、48、72 h后, 用MTT法检测细胞增殖, 在490 nm波长下, 酶标仪测吸光度(A)值.
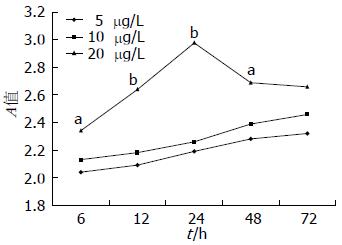
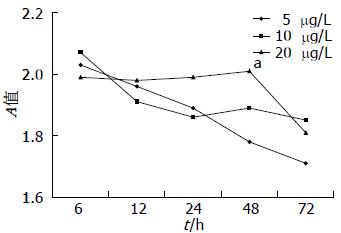
1.2.2 EGF对HepG2细胞生长与增殖的影响: 在肝衰竭组及正常对照组培养基中加入EGF, 使EGF浓度分别达到5、10、20 μg/L, 同上述实验方法培养细胞, 并用MTT法观察细胞生长及增殖情况.
1.2.3 Hoechst法检查细胞凋亡: 取对数期生长的HepG2细胞, 制成细胞悬液, 调整细胞浓度为1×104/mL, 取适量细胞悬液进行爬片, 加入50%LFP或50%NCP培养6、12、24、48、72 h后, 用Hoechst33258试剂进行染色, 荧光显微镜下观察细胞核变化(×200), 每个时间点在任意视野下选取100个细胞计算细胞凋亡率, 实验重复3次, 结果取平均值.
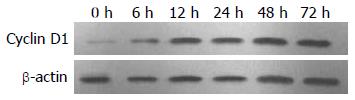
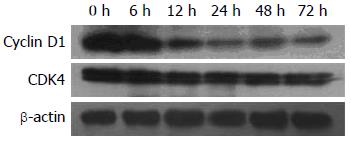
1.2.4 Western blot检测HepG2细胞内Cyclin D1、CDK4蛋白表达: 首先观察50%NCP对HepG2细胞Cyclin D1的调节, 再观察50%LFP对HepG2细胞Cyclin D1及CDK4的调节. 方法如下: 加入50%NCP或50%LFP培养细胞6、12、24、48、72 h后, 用全细胞蛋白质抽提试剂盒提取各组HepG2细胞蛋白质, 用BCA蛋白浓度测定试剂盒测定蛋白浓度. 取40 μg蛋白质样品加上样缓冲液煮沸变性后, 8%SDS-PAGE分离蛋白, 转移至硝酸纤维素膜, 用含5%脱脂奶粉的TBST封闭1 h, 分别加入鼠抗人Cyclin D1多抗, 兔抗人CDK4多抗, 摇匀后, 4 ℃冰箱过夜; TBST洗膜3次, 每次10 min, 分别加入兔抗鼠及羊抗兔二抗室温下反应1 h, TBST洗膜3次, 每次10 min, 以化学发光法特异性检测膜上Cyclin D1或CDK4的表达.
统计学处理 实验所得数据以mean±SD表示, 采用SPSS13.0统计分析软件包对数据进行分析, 利用单因素方差分析, 独立样本t检验进行差异比较, P<0.05为差异有统计学意义, P<0.01为差异有显著统计学意义.
与正常对照组相比, 在所有时间段LFP培养的HepG2细胞生长与增殖均受到抑制, A值有不同程度下降, 血浆作用时间越长, 下降越明显. 12 h时明显低于正常对照组(P<0.05), 24 h时与正常对照组比较有显著差异(P<0.01, 图1).
LFP培养HepG2细胞后, 6、12、24、48、72 h的凋亡率分别为14%±3%、13%±4%、13%±5%、11%±6%及13%±7%, 与正常对照组比较无统计学意义(P>0.05).
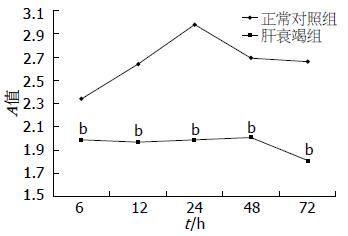
不同浓度EGF对正常对照组HepG2细胞生长均有刺激作用, 呈浓度依赖性, 在24 h时, 20 μg/L浓度组与10 μg/L、20 μg/L浓度组有显著差异(P<0.01, 图2). 然而, 仅大剂量EGF对肝衰竭组HepG2细胞生长与增殖有一过性刺激作用, 在48 h时, 20 μg/L EGF浓度组细胞数明显多于5 μg/LEGF浓度组(P<0.05), 72 h时, 20 μg/L浓度组与5 μg/L浓度组差异无统计学意义(图3). 进一步比较20 μg/L EGF对正常对照组及肝衰竭组HepG2细胞的刺激作用发现, 肝衰竭组HepG2细胞各时间点仍明显低于正常对照组(P<0.01, 图4). 提示大剂量EGF虽然对LFP培养HepG2细胞增殖有一过性刺激作用, 但仍然不能逆转LFP对HepG2细胞的抑制作用.
急性或亚急性(包括慢加急性或亚急性)肝衰竭患者预后主要和肝脏炎症坏死程度和肝再生能力有关[8,9], 部分肝衰竭患者通过合理治疗后, 可以通过肝脏再生恢复肝脏功能. 但多数肝衰竭患者肝脏损伤后迟迟不能再生, 存在肝再生障碍, 肝脏功能得不到恢复, 最后出现各种并发症而死亡[10,11]. 国内外学者对肝衰竭患者肝再生障碍的机制作了初步探索[12-14], 可能与很多因素有关, 包括肝损害程度过重、促肝细胞生长因子浓度相对不足及其信号传导通路障碍、肝细胞增殖相关基因表达和蛋白水平低下等[15-18].
既往研究证实肝衰竭患者血清或血浆抑制肝细胞增殖[19,20], 但对其抑制机制尚缺乏了解. 在本研究中, LFP与HepG2细胞共同培养后, MTT法检测发现其活力逐渐下降, 并且这种作用随着时间的延长而增强, 细胞凋亡无明显增加, 提示LFP抑制HepG2细胞生长与增殖, 与既往研究结果一致. 肝癌细胞株虽然与正常肝细胞在其生长、增殖及增殖信号的传递等方面可能存在差异, 但由于肝癌细胞株是一种生长、繁殖较快的细胞株, 对生长抑制信号更为敏感[20]. 因而, 我们在本研究中采用肝癌细胞株HepG2细胞初步探讨LFP抑制肝细胞生长和增殖的机制.
肝细胞增殖是一个复杂的过程[21], 他需要通过几个关键周期. 细胞周期蛋白在细胞周期中起到非常重要的作用, 其中CyclinD1及CDK4是调控细胞从G1期进入S期的关键蛋白[22-24]. 通过本实验我们发现LFP下调HepG2细胞内Cyclin D1、CDK4的表达, 其中以CyclinD1较明显, 提示LFP抑制HepG2细胞生长与增殖的机制可能与其抑制细胞内Cyclin D1、CDK4的表达有关.
既往研究中我们及其他学者均发现肝衰竭患者外周血肝再生促进因子和肝再生抑制因子都有不同程度升高[25], 因而, 有学者认为肝再生促进因子与肝再生抑制因子的不平衡升高可能是肝衰竭患者肝再生障碍的原因之一. 本实验中我们进一步用外源性EGF刺激HepG2细胞, 通过改变LFP中肝再生促进因子水平及肝再生促进因子与肝再生抑制因子的平衡, 观察LFP对HepG2细胞生长与增殖的作用. 发现在正常对照组EGF对HepG2细胞的生长与增殖有较强的刺激作用; 但在肝衰竭组, 仅大剂量EGF有一过性刺激作用, 持续时间明显缩短, 说明大剂量EGF不能逆转LFP对HepG2细胞的抑制, 提示LFP抑制HepG2细胞生长及增殖的原因, 可能与肝再生促进因子与肝再生抑制因子的平衡失调无明显关系.
EGF虽被认为是强有力的促进细胞生长因子, 但其必须与其受体EGFR结合, 使EGFR磷酸化, 并通过细胞内一系列信号传递, 才能发挥刺激细胞生长的作用[26-29]. LFP是否会引起HepG2细胞EGFR表达下降及细胞内信号传递障碍值得进一步研究. 有报道肝衰竭小鼠肝细胞存在内质网应激反应[30], 而内质网应激反应会降低EGFR的表达[31]. 另外, 通过增加其他肝再生促进因子如HGF能不能逆转LFP对正常肝细胞的抑制作用有待今后做进一步研究.
总之, 我们的研究结果提示肝衰竭患者肝再生障碍的原因之一可能与其血浆抑制肝细胞增殖有关, 增加血浆中肝再生促进因子EGF并不能明显改善肝衰竭患者肝细胞增殖能力.
我国慢性乙型肝炎病毒携带者近1.2亿人, 部分患者病情加重发展肝衰竭, 其死亡率高达50%-80%. 因而, 探讨肝衰竭患者的发病机制及提高其内科治疗效果非常必要, 并一直是国内外学者的研究热点.
范学工, 教授, 中南大学湘雅医院感染病科
Aladjem等研究显示在小鼠2/3肝切除后的DNA合成前, Cyclin D1的mRNA和蛋白量达到最高水平; Hirsch等通过在G1期给纤维母细胞株进行抗Cyclin D1抗体细胞内微注射, 则S期的启动被阻止.
本研究发现大剂量EGF对肝衰竭患者血浆(LFP)培养的HepG2细胞增殖虽有一过性刺激作用, 但并不能逆转其抑制作用; LFP抑制HepG2细胞生长和增殖的机制可能与其抑制细胞内Cyclin D1、CDK4的表达有关.
了解Cyclin D1、CDK4在肝衰竭患者肝再生障碍中的作用, 有助于阐明肝衰竭患者肝再生障碍的机制, 为肝衰竭患者的治疗提供理论基础.
本文研究LFP对HepG2细胞生长、增殖的抑制作用及可能机制, 并进一步探讨EGF对这种抑制作用的调控作用; 课题设计较为合理, 论据较为充分, 对阐明肝衰竭的发病机制有一定意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Liu Q, Liu Z, Wang T, Wang Q, Shi X, Dao W. Characteristics of acute and sub-acute liver failure in China: nomination, classification and interval. J Gastroenterol Hepatol. 2007;22:2101-2106. [PubMed] [DOI] |
| 2. | Sarin SK, Kumar A, Almeida JA, Chawla YK, Fan ST, Garg H, de Silva HJ, Hamid SS, Jalan R, Komolmit P. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL). Hepatol Int. 2009;3:269-282. [PubMed] [DOI] |
| 3. | Shi XL, Gu JY, Zhang Y, Han B, Xiao JQ, Yuan XW, Zhang N, Ding YT. Protective effects of ACLF sera on metabolic functions and proliferation of hepatocytes co-cultured with bone marrow MSCs in vitro. World J Gastroenterol. 2011;17:2397-2406. [PubMed] [DOI] |
| 4. | Riordan SM, Williams R. Perspectives on liver failure: past and future. Semin Liver Dis. 2008;28:137-141. [PubMed] [DOI] |
| 5. | Rutherford A, Chung RT. Acute liver failure: mechanisms of hepatocyte injury and regeneration. Semin Liver Dis. 2008;28:167-174. [PubMed] [DOI] |
| 6. | Stravitz RT, Kramer DJ. Management of acute liver failure. Nat Rev Gastroenterol Hepatol. 2009;6:542-553. [PubMed] [DOI] |
| 8. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006;43:S45-S53. [PubMed] [DOI] |
| 9. | Zhu RZ, Xiang D, Xie C, Li JJ, Hu JJ, He HL, Yuan YS, Gao J, Han W, Yu Y. Protective effect of recombinant human IL-1Ra on CCl4-induced acute liver injury in mice. World J Gastroenterol. 2010;16:2771-2779. [PubMed] [DOI] |
| 10. | O'Grady JG. Acute liver failure. Postgrad Med J. 2005;81:148-154. [PubMed] [DOI] |
| 11. | McKenzie TJ, Lillegard JB, Nyberg SL. Artificial and bioartificial liver support. Semin Liver Dis. 2008;28:210-217. [PubMed] [DOI] |
| 13. | Su AI, Guidotti LG, Pezacki JP, Chisari FV, Schultz PG. Gene expression during the priming phase of liver regeneration after partial hepatectomy in mice. Proc Natl Acad Sci U S A. 2002;99:11181-11186. [PubMed] [DOI] |
| 14. | Yu CH, Chen HL, Chen YH, Chang MF, Chien CS, Chang MH. Impaired hepatocyte regeneration in acute severe hepatic injury enhances effective repopulation by transplanted hepatocytes. Cell Transplant. 2009;18:1081-1092. [PubMed] [DOI] |
| 15. | Michalopoulos GK. Liver regeneration. J Cell Physiol. 2007;213:286-300. [PubMed] [DOI] |
| 16. | Rozga J. Hepatocyte proliferation in health and in liver failure. Med Sci Monit. 2002;8:RA32-RA38. [PubMed] |
| 18. | Gatzidou E, Kouraklis G, Theocharis S. Insights on augmenter of liver regeneration cloning and function. World J Gastroenterol. 2006;12:4951-4958. [PubMed] |
| 20. | Shi Q, Gaylor JD, Cousins R, Plevris J, Hayes PC, Grant MH. The effects of serum from patients with acute liver failure on the growth and metabolism of Hep G2 cells. Artif Organs. 1998;22:1023-1030. [PubMed] [DOI] |
| 22. | Boylan JM, Gruppuso PA. D-type cyclins and G1 progression during liver development in the rat. Biochem Biophys Res Commun. 2005;330:722-730. [PubMed] [DOI] |
| 23. | Makino H, Shimada H, Morioka D, Kunisaki C, Morita T, Matsuyama R, Kubota T, Shimizu D, Ichikawa Y, Tanaka K. Analysis of gene expression profiles in fatal hepatic failure after hepatectomy in mice. J Surg Res. 2011;169:36-43. [PubMed] [DOI] |
| 24. | Ehrenfried JA, Ko TC, Thompson EA, Evers BM. Cell cycle-mediated regulation of hepatic regeneration. Surgery. 1997;122:927-935. [PubMed] [DOI] |
| 25. | Lin SD, Kawakami T, Ushio A, Sato A, Sato S, Iwai M, Endo R, Takikawa Y, Suzuki K. Ratio of circulating follistatin and activin A reflects the severity of acute liver injury and prognosis in patients with acute liver failure. J Gastroenterol Hepatol. 2006;21:374-380. [PubMed] [DOI] |
| 26. | Hornberg JJ, Bruggeman FJ, Binder B, Geest CR, de Vaate AJ, Lankelma J, Heinrich R, Westerhoff HV. Principles behind the multifarious control of signal transduction. ERK phosphorylation and kinase/phosphatase control. FEBS J. 2005;272:244-258. [PubMed] [DOI] |
| 27. | Reinehr R, Häussinger D. CD95 death receptor and epidermal growth factor receptor (EGFR) in liver cell apoptosis and regeneration. Arch Biochem Biophys. 2012;518:2-7. [PubMed] [DOI] |
| 28. | Natarajan A, Wagner B, Sibilia M. The EGF receptor is required for efficient liver regeneration. Proc Natl Acad Sci U S A. 2007;104:17081-17086. [PubMed] [DOI] |
| 29. | Khai NC, Takahashi T, Ushikoshi H, Nagano S, Yuge K, Esaki M, Kawai T, Goto K, Murofushi Y, Fujiwara T. In vivo hepatic HB-EGF gene transduction inhibits Fas-induced liver injury and induces liver regeneration in mice: a comparative study to HGF. J Hepatol. 2006;44:1046-1054. [PubMed] [DOI] |
| 30. | 周 惠娟, 谢 青, 姜 山, 李 光明, 周 霞秋, 刘 海防, 俞 红, 郭 清. Caspase-12在D-氨基半乳糖联合脂多糖诱导小鼠急性肝功能衰竭中的表达及作用. 中华肝脏病杂志. 2005;13:685-688. |
| 31. | Ling YH, Li T, Perez-Soler R, Haigentz M. Activation of ER stress and inhibition of EGFR N-glycosylation by tunicamycin enhances susceptibility of human non-small cell lung cancer cells to erlotinib. Cancer Chemother Pharmacol. 2009;64:539-548. [PubMed] [DOI] |