修回日期: 2012-03-25
接受日期: 2012-04-17
在线出版日期: 2012-05-18
目的: 研究CDH1基因多态性与胃腺癌患者舌苔辨证的关系.
方法: 应用连接酶检测反应, 对387例胃腺癌患者和392例健康对照的CDH1基因的4个位点进行基因分型, 并且按中医舌诊辨证要求, 由中医诊断学专家进行舌色、舌质的诊断.
结果: 胃腺癌组不按时吃饭的比例高于对照组(χ2 = 9.124, P = 0.010), 胃腺癌组与对照组相比饮食口味偏咸(χ2 = 74.409, P<0.001), 胃腺癌组的吸烟率高于对照组(χ2 = 18.019, P<0.001), 胃腺癌组经常吃豆制品的频率明显低于对照组(χ2 = 10.669, P = 0.014), 并且其经常吃新鲜水果的频率明显低于对照组(χ2 = 59.905, P<0.001). rs13689、rs17690554位点携带突变基因型并且苔色为黄色的个体在病例组的分布频率明显高于对照组(χ2 = 4.064, P = 0.044; χ2 = 5.868, P = 0.015). 两组人群在各位点同一基因型的不同苔质的差异均具有统计学意义(P<0.050).
结论: CDH1基因多态性与胃腺癌患者舌苔辨证有一定关联, 本研究结果有助于揭示胃腺癌患者基因位点突变与舌苔形成和变化的科学内涵.
引文著录: 秦蕾, 张军峰, 杨亚平, 李谨, 佟书娟, 张春兵, 赵旺胜, 杨学文, 邱红, 董伟, 詹瑧. CDH1基因多态性与胃腺癌患者舌苔辨证的相关性. 世界华人消化杂志 2012; 20(14): 1191-1198
Revised: March 25, 2012
Accepted: April 17, 2012
Published online: May 18, 2012
AIM: To investigate the association between CDH1 gene polymorphisms and tongue coatings in patients with gastric adenocarcinoma.
METHODS: PCR-RFLP method was used to detect the polymorphisms of the CDH1 gene in 387 patients with gastric adenocarcinoma and 392 normal control subjects.
RESULTS: The percentages of subjects not eating on time, those eating salty flavor, and smoking subjects were higher in the gastric adenocarcinoma group than in the control group (χ2 = 9.124, P = 0.010; χ2 = 74.409, P < 0.001; χ2 = 18.019, P < 0.001). The frequencies of regularly eating soy products and fresh fruit in the gastric adenocarcinoma group were significantly lower than those in the control group (χ2 = 10.669, P = 0.014; χ2 = 59.905, P < 0.001). The frequencies of mutated genotypes of rs13689 and rs17690554 and yellow tongue coating were significantly higher in the case group than in the control group (χ2 = 4.064, P = 0.044; χ2 = 5.868, P = 0.015).
CONCLUSION: CDH1 gene polymorphisms may be associated with the change in tongue coatings in patients with gastric adenocarcinoma.
- Citation: Qin L, Zhang JF, Yang YP, Li J, Tong SJ, Zhang CB, Zhao WS, Yang XW, Qiu H, Dong W, Zhan Z. Association between CDH1 gene polymorphisms and tongue coatings in patients with gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1191-1198
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1191.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1191
胃腺癌是中国人群常见的恶性肿瘤之一, 有关其病变过程从中医和西医的角度众多专家给予了不同的解释. 中医认为, 舌为"心之苗, 胃之镜, 外感温热病之候", 舌诊是中医临床望诊的重要内容之一, 对临床辨证论治有重要诊断价值, 为历代医家所重视[1,2], 也是识病养生、自我康复的重要判断指标[3]. 近代医家在进行舌诊时, 将各种舌象特征作精细的诊察和描述, 其中舌苔(包括苔色和苔质)在辨证中的价值最大[4]. 胃癌中医证型的大样本研究发现, 舌象是中医胃癌临床证候分类的重要指标, 对于判断疾病的性质、推断病情的进退和预测疾病预后有着重要的作用[5]. 因此, 在胃的病变过程中, 观察舌苔变化可了解病邪的深浅、病证的性质、邪正的消长及胃气的存亡[6].
许多研究发现E-钙粘蛋白(E-cad)介导的细胞间黏附作用在胃腺癌发生、发展及转移过程中发挥重要作用, 其在癌组织中表达异常是胃腺癌重要的恶性生物学特征, 可能成为胃腺癌恶性程度的一种生物学指标[7-9]. E-cad编码的基因为CDH1, 是一种肿瘤抑制基因和肿瘤转移抑制基因, 定位于16q 22.1, 其产物为Ca2+依赖性细胞黏附分子, 几乎表达于所有的上皮细胞, 对于介导同型细胞的黏附、维持上皮细胞的极性和完整性至关重要, 与多种上皮来源的恶性肿瘤的发生、发展、侵袭转移密切相关[10]. 本课题组的前期研究结果表明E-cad在不同舌苔中表达差异显著且具有明显的规律[11]. 从基因角度来看, 在胃腺癌发生发展和患者舌苔形成过程中, 基因单核苷酸多态性(single nucleotide polymorphism, SNP)可能也是一个重要影响因素, 参与基因表达的调控[12].
已有很多证据表明肿瘤患者、重症患者、急症患者的舌苔变化很明显, 与正常人相比有很大差异, 究其为何会有这种表现是我们课题组想探索研究的问题. 本研究设计的目的是探讨胃腺癌患者舌苔的苔色和苔质的变化与CDH1基因多态性的关系. 同为胃癌患者可能会有不同的舌苔类型, 也可能会有不同的基因型(包括野生型、杂合型和突变型), 为了开展相关研究以及控制相关临床研究中的条件, 本研究以单一病种为基础, 采用病例对照方法, 通过人群流行病学研究, 分析舌苔辨证分型与基因分型之间的关联, 揭示基因位点突变是否与舌苔表型在胃腺癌的发生、发展过程中起到协同作用. 阐明上述现象之间的规律性和相关性, 其医学意义不仅在于揭示舌苔形成和变化的科学内涵、调控舌苔变化的相关分子机制以及研究胃腺癌发生的潜在危险因素, 亦为寻找既具备胃腺癌的危险基因又具备异常舌苔表型的高危人群筛查提供依据.
病例组: 2009-07/2010-07在江苏省中医院、江苏省人民医院、八一医院收治的江苏籍胃腺癌患者, 经过统一的病理组织学诊断确诊, 共计387例. 对照组: 随机选取2009-07/2010-07在上述3家医院健康体检合格的江苏籍居民(无消化系疾病史)392例.
1.2.1 问卷调查: 采用统一设计的调查表, 分别对病例组人群和健康对照进行面访调查. 调查内容包括一般人口学特征、饮食生活习惯、中医四诊信息等, 由中医高年资主任医师和中医诊断学专家进行舌苔的辨证和分型, 其中苔色分为2组: 白苔组和黄苔组, 苔质按照临床常见的厚苔、薄苔、剥苔和其他苔质(因为统计学需要, 将其他少见类型苔质合并为一组进行处理)进行大类分类. 以上研究对象均签署了知情同意书并提供了外周静脉血5 mL, 用于实验室检测相关指标及基因多态性检测.
1.2.2 基因多态性检测: 经过PUBMED数据库筛选CDH1基因5'near gene区rs16260位点、rs17690554位点, 3'UTR区rs13689位点以及1个同义突变位点rs1801552. 利用引物延伸法进行基因多态性检测, 由上海翼和应用生物技术有限公司完成.
统计学处理 用Epidata3.0软件建立数据库, 双重录入全部数据后核对并经逻辑检查无误后经SPSS13.0进行统计分析. 统计方法包括t检验、χ2检验, 以P<0.05为具有统计学差异.
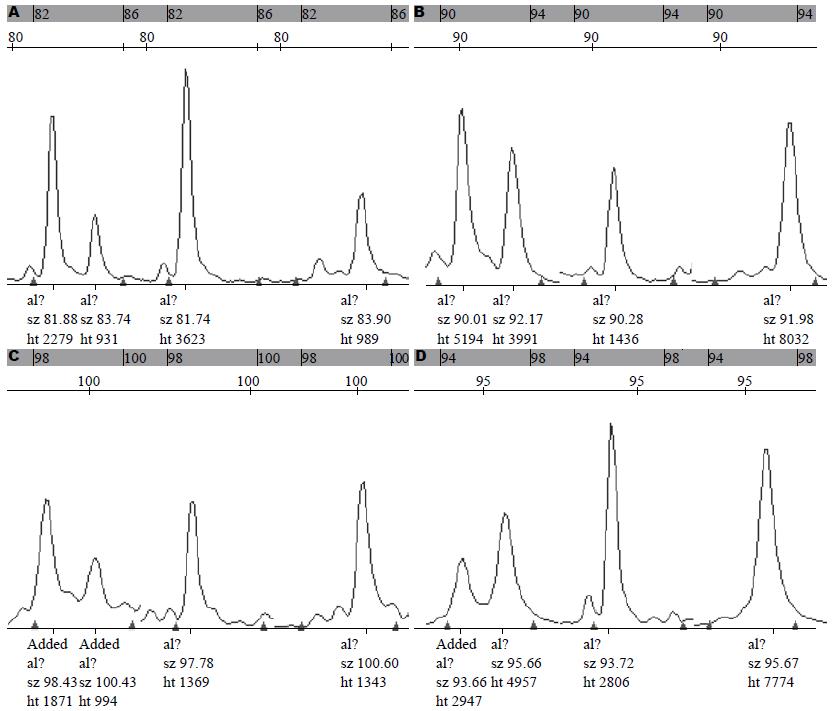
胃腺癌病例组男271例, 平均年龄61.21岁±10.33岁; 女116例, 平均年龄55.15岁±13.60岁. 对照组男237例, 平均年龄50.24岁±13.59岁; 女155例, 平均年龄51.23岁±12.66岁. 基因位点检测情况: rs13689进行成功基因分型744例(95.5%), rs1801552进行成功基因分型767例(98.5%), rs17690554进行成功基因分型724例(92.9%), rs16260进行成功基因分型715例(91.8%). 对照组基因型经Hardy-Weinberg遗传平衡定律检验, 各基因型频率达到遗传平衡, 具有群体代表性(P分别为0.348、0.526、0.053、0.057). 4个位点基因分型图片见图1.
胃腺癌组不按时吃饭的比例高于对照组(χ2 = 9.124, P = 0.010), 胃腺癌组与对照组相比饮食口味偏咸(χ2 = 74.409, P<0.001), 胃腺癌组的吸烟率高于对照组(χ2 = 18.019, P<0.001), 胃腺癌组经常吃豆制品的频率明显低于对照组(χ2 = 10.669, P = 0.014), 并且其吃新鲜水果的频率明显低于对照组(χ2 = 59.905, P<0.001, 表1).
| 病例组n(%)n = 387 | 对照组n(%)n = 392 | χ2值 | P值 | |
| 按时吃饭 | ||||
| 经常不按时 | 36(9.3) | 17(4.3) | 9.124 | 0.010 |
| 有时不按时 | 47(12.1) | 39(9.9) | ||
| 按时 | 304(78.6) | 336(85.7) | ||
| 进食速度 | ||||
| 快 | 212(54.8) | 188(48.0) | 3.988 | 0.136 |
| 适中 | 157(40.6) | 179(45.7) | ||
| 慢 | 18(4.70) | 25(6.4) | ||
| 饮食口味1 | ||||
| 偏咸 | 203(52.5) | 101(26.0) | 74.409 | 0.000 |
| 适中 | 147(38.0) | 175(45.1) | ||
| 偏µ | 37(9.60) | 112(28.9) | ||
| 吃豆制品2 | ||||
| 完全不吃 | 6(3.7) | 13(3.6) | 10.669 | 0.014 |
| 偶尔吃 | 58(36.0) | 83(22.7) | ||
| 经常吃 | 93(57.8) | 262(71.6) | ||
| 天天吃 | 4(2.5) | 8(2.2) | ||
| 吃新鲜水果3 | ||||
| 完全不吃 | 18(10.4) | 16(4.3) | 59.905 | 0.000 |
| 偶尔吃 | 91(52.6) | 97(26.1) | ||
| 经常吃 | 59(34.1) | 190(51.1) | ||
| 天天吃 | 5(2.9) | 69(18.5) | ||
| 是否吸烟 | ||||
| 否 | 204(52.7) | 265(67.6) | 18.019 | 0.000 |
| 是 | 183(47.3) | 127(32.4) |
4个位点的等位基因频率及基因型频率在病例组和对照组的分布均无统计学差异(表2, 3).
| 位点 | 等位基因 | 病例组n(%) | 对照组n(%) | χ2值 | P值 |
| rs13689 | T | 606(81.2) | 612(82.5) | 0.389 | 0.533 |
| C | 140(18.8) | 130(17.5) | |||
| rs1801552 | C | 477(62.8) | 490(63.3) | 0.049 | 0.825 |
| T | 283(37.2) | 284(36.7) | |||
| rs17690554 | C | 574(81.1) | 609(82.3) | 0.362 | 0.547 |
| G | 134(18.9) | 131(17.7) | |||
| rs16260 | C | 529(74.4) | 554(76.7) | 0.789 | 0.374 |
| A | 179(25.3) | 168(23.3) |
| 位点 | 基因型 | 病例组n(%) | 对照组n(%) | χ2值 | P值 |
| rs13689 | TT | 243(65.1) | 255(68.7) | 1.081 | 0.299 |
| TC/CC | 130(34.9) | 116(31.3) | |||
| rs1801552 | CC | 149(39.2) | 158(40.8) | 0.355 | 0.837 |
| CT | 179(47.1) | 174(45.0) | |||
| TT | 52(13.7) | 55(14.2) | |||
| rs17690554 | CC | 233(65.8) | 257(69.5) | 1.096 | 0.295 |
| CG/GG | 121(34.2) | 113(30.5) | |||
| rs16260 | CC | 196(55.4) | 219(60.7) | 3.481 | 0.175 |
| CA | 137(38.7) | 116(32.1) | |||
| AA | 21(5.9) | 26(7.2) |
rs13689位点携带突变基因型TC/CC并且苔色为黄色的个体在病例组的分布频率明显高于对照组, 其差异具有统计学差异(χ2 = 4.064, P = 0.044); rs17690554位点携带突变基因型CG/GG并且苔色为黄色的个体在病例组的分布频率明显高于对照组, 其差异具有统计学意义(χ2 = 5.868, P = 0.015, 表4).
| 位点 | 苔色 | 基因分型 | 病例组n(%) | 对照组n(%) | χ2值 | P值 |
| rs13689 | 白色 | TT | 145(66.8) | 173(66.3) | 0.015 | 0.901 |
| TC/CC | 72(33.2) | 88(33.7) | ||||
| 黄色 | TT | 33(58.9) | 48(76.2) | 4.064 | 0.044 | |
| TC/CC | 23(41.1) | 15(23.8) | ||||
| rs1801552 | 白色 | CC | 78(35.9) | 103(39.5) | 0.624 | 0.430 |
| CT/TT | 139(64.1) | 158(60.5) | ||||
| 黄色 | CC | 28(50.0) | 29(44.4) | 0.367 | 0.544 | |
| CT/TT | 28(50.0) | 35(55.6) | ||||
| rs17690554 | 白色 | CC | 147(67.7) | 176(67.4) | 0.005 | 0.943 |
| CG/GG | 70(32.3) | 85(32.6) | ||||
| 黄色 | CC | 33(58.9) | 50(79.4) | 5.868 | 0.015 | |
| CG/GG | 23(41.1) | 13(20.6) | ||||
| rs16260 | 白色 | CC | 118(54.4) | 154(59.0) | 1.034 | 0.309 |
| CA/AA | 99(45.6) | 107(41.0) | ||||
| 黄色 | CC | 29(51.8) | 39(61.9) | 1.240 | 0.266 | |
| CA/AA | 27(48.2) | 24(38.1) |
在相同苔质的条件下, 各位点基因分型在病例和对照组间尚未观察到统计学差异(表5); 两组人群在各位点同一基因型的不同苔质的差异均具有统计学意义(均P<0.050, 表6).
| 位点 | 苔质 | 基因分型 | 病例组n(%) | 对照组n(%) | χ2值 | P值 |
| rs13689 | 薄苔 | TT | 72(69.2) | 159(69.4) | 0.001 | 0.971 |
| TC/CC | 32(30.8) | 70(30.6) | ||||
| 厚苔 | TT | 59(64.1) | 48(64.9) | 0.010 | 0.922 | |
| TC/CC | 33(35.9) | 26(35.1) | ||||
| 剥苔 | TT | 23(69.7) | 3(75.0) | 1.0001 | ||
| TC/CC | 10(30.3) | 1(25.0) | ||||
| 其他苔质舌苔 | TT | 24(54.5) | 11(64.7) | 0.518 | 0.472 | |
| TC/CC | 20(45.5) | 6(35.3) | ||||
| rs1801552 | 薄苔 | CC | 43(41.3) | 88(38.4) | 0.255 | 0.613 |
| CT/TT | 61(58.7) | 141(61.6) | ||||
| 厚苔 | CC | 37(40.2) | 36(48.6) | 1.183 | 0.277 | |
| CT/TT | 55(59.8) | 38(51.4) | ||||
| 剥苔 | CC | 11(33.3) | 3(75.0) | 0.1421 | ||
| CT/TT | 22(66.7) | 1(25.0) | ||||
| 其他苔质舌苔 | CC | 15(34.1) | 4(23.5) | 0.638 | 0.425 | |
| CT/TT | 29(65.9) | 13(76.5) | ||||
| rs17690554 | 薄苔 | CC | 72(69.2) | 159(69.4) | 0.001 | 0.971 |
| CG/GG | 32(30.8) | 70(30.6) | ||||
| 厚苔 | CC | 61(66.3) | 51(68.9) | 0.128 | 0.721 | |
| CG/GG | 31(33.7) | 23(31.1) | ||||
| 剥苔 | CC | 23(69.7) | 3(75.0) | 1.0001 | ||
| CG/GG | 10(30.3) | 1(25.0) | ||||
| 其他苔质舌苔 | CC | 24(54.5) | 13(76.5) | 2.470 | 0.116 | |
| CG/GG | 20(45.5) | 4(23.5) | ||||
| rs16260 | 薄苔 | CC | 56(53.8) | 134(58.5) | 0.636 | 0.425 |
| CA/AA | 48(46.2) | 95(41.5) | ||||
| 厚苔 | CC | 55(59.8) | 47(63.5) | 0.241 | 0.624 | |
| CA/AA | 37(40.2) | 27(36.5) | ||||
| 剥苔 | CC | 14(42.4) | 1(25.0) | 0.6331 | ||
| CA/AA | 19(57.6) | 3(75.0) | ||||
| 其他苔质舌苔 | CC | 22(50.0) | 11(64.7) | 1.068 | 0.301 | |
| CA/AA | 22(50.0) | 6(35.3) |
| 位点 | 基因分型 | 苔质 | 病例组n(%) | 对照组n(%) | χ2值 | P值 |
| rs13689 | TT | 薄苔 | 72(40.4) | 159(71.9) | 50.058 | 0.000 |
| 厚苔 | 59(33.1) | 48(21.7) | ||||
| 剥苔 | 23(12.9) | 3(1.4) | ||||
| 其他苔质舌苔 | 24(13.5) | 11(5.0) | ||||
| TC/CC | 薄苔 | 32(33.7) | 70(68.0) | 29.615 | 0.000 | |
| 厚苔 | 33(34.7) | 26(25.2) | ||||
| 剥苔 | 10(10.5) | 1(1.0) | ||||
| 其他苔质舌苔 | 20(21.1) | 6(5.8) | ||||
| rs1801552 | CC | 薄苔 | 43(40.6) | 88(67.2) | 24.042 | 0.000 |
| 厚苔 | 37(34.9) | 36(27.5) | ||||
| 剥苔 | 11(10.4) | 3(2.3) | ||||
| 其他苔质舌苔 | 15(14.2) | 4(3.1) | ||||
| CT/TT | 薄苔 | 61(36.5) | 141(73.1) | 58.487 | 0.000 | |
| 厚苔 | 55(32.9) | 38(19.7) | ||||
| 剥苔 | 22(13.2) | 1(0.5) | ||||
| 其他苔质舌苔 | 29(17.4) | 13(6.7) | ||||
| rs17690554 | CC | 薄苔 | 72(40.0) | 159(70.4) | 47.715 | 0.000 |
| 厚苔 | 61(33.9) | 51(22.6) | ||||
| 剥苔 | 23(12.8) | 3(1.3) | ||||
| 其他苔质舌苔 | 24(13.3) | 13(5.8) | ||||
| CG/GG | 薄苔 | 32(34.4) | 70(71.4) | 33.264 | 0.000 | |
| 厚苔 | 31(33.3) | 23(23.5) | ||||
| 剥苔 | 10(10.8) | 1(1.0) | ||||
| 其他苔质舌苔 | 20(21.5) | 4(4.1) | ||||
| rs16260 | CC | 薄苔 | 56(38.1) | 134(69.4) | 42.129 | 0.000 |
| 厚苔 | 55(37.4) | 47(24.4) | ||||
| 剥苔 | 14(9.5) | 1(0.5) | ||||
| 其他苔质舌苔 | 22(15.0) | 11(5.7) | ||||
| CA/AA | 薄苔 | 48(38.1) | 95(72.5) | 37.706 | 0.000 | |
| 厚苔 | 37(29.4) | 27(20.6) | ||||
| 剥苔 | 19(15.1) | 3(2.3) | ||||
| 其他苔质舌苔 | 22(17.5) | 6(4.6) |
胃腺癌的发生是环境因素和遗传因素共同作用的结果. 就环境因素而言, 幽门螺杆菌感染, 高盐饮食, 维生素C摄入不足, 吸烟等被认为与胃癌的发生密切相关[13]. 本研究结果显示, 不按时吃饭、饮食口味偏咸、吸烟为胃腺癌发生的高危因素, 而经常吃豆制品、新鲜水果则可以降低胃腺癌的发病风险.
从组织学上看, 舌苔的形成与舌黏膜上皮细胞的分裂、增殖、分化、迁移和脱落密切相关, 若机体发生病变影响到这一代谢过程, 那么就会形成厚薄不同、颜色各异的舌苔[14]. 因此, 研究舌背黏膜上皮细胞增殖、分化和凋亡相关基因的表达模式, 有助于揭示舌苔形成的分子机制. 秦鉴等[15]应用mRNA差异显示技术克隆常见舌苔形成相关基因, 结果显示与舌苔厚度变化相关的45条差异表达cDNA均为细胞凋亡相关基因, 进一步证实舌苔厚度变化与舌背黏膜上皮细胞的凋亡基因表达密切相关. 由于舌苔的观察较为直观和客观, 且简便易行, 有形可循, 舌苔不仅可以作为多种疾病的辅助诊断指标[16], 也可以作为肿瘤[17]、艾滋病[18]、SARS[19]等重大疾病的辅助诊断指标. 究其机体的不同生理状态为何会有不同舌象的变化是我们课题组研究想探索的问题, 为了控制相关临床研究中的条件, 本研究以单一病种(胃腺癌)为基础进行分析, 已有了一些初步的发现, 但具体深入的结论还需要大规模流行病学调查加以验证.
有研究显示E-cad在不同舌苔中表达差异显著且具有明显的规律性[20]. 很多研究发现E-cad介导的细胞间黏附作用在胃癌发生、发展及转移过程中发挥重要作用, 其在癌组织中表达异常是胃癌重要的恶性生物学特征, 可能成为胃癌恶性程度的一种生物学指标[21-23]. E-cad编码基因CDH1是已经确认的肿瘤抑制基因, E-cad的异常表达对胃癌的转移有重要促进作用. 若E-cad分子结构中有2个氨基酸残基发生改变即可影响E-cad与钙离子的结合, 从而会导致细胞黏附的异常[24]. Li等[25]研究表明CDH1基因5'端启动子区rs16260位点的SNP可以下调基因的转录活性, 导致蛋白表达水平下调, 增加对上皮性肿瘤的易感性; Cattaneo等[26]研究表明, CDH1 rs16260单核苷酸多态性可改变基因转录活性, 从而可能改变上皮性肿瘤发病风险和侵袭转移能力; Meta分析研究显示在白种人中CDH1基因-160C>A多态性与胃癌易感性相关[27]; 曹伟军等[28]对该位点基因多态性进行Meta分析结果显示其与胃癌的易感性无关, 但对人群的分层分析显示, 其在亚洲人群中有降低胃癌发生的趋势, 在高加索人群中有增加胃癌发生的趋势, 提示此现象可能与不同人群之间的遗传背景不同有关; 国内外已有多项研究涉及rs16260位点的多态性与胃癌发病风险的相关研究, 但均尚无定论[29,30]. 然而本项研究结果也尚未显示rs16260位点的单核苷酸多态性与江苏籍胃腺癌患者的疾病易感性相关. rs13689、rs1801552、rs17690554位点多态性在病例组和对照组中也未见统计学差异, 可能与样本含量较小有关系.
在对舌苔的苔色、苔质与基因分型的研究过程中发现, rs13689位点携带突变基因型TC/CC并且苔色为黄色的个体在病例组的分布频率明显高于对照组(P = 0.044), rs17690554位点携带突变基因型CG/GG并且苔色为黄色的个体在病例组的分布频率明显高于对照组(P = 0.015), 提示含有rs13689和rs17690554位点的突变基因型个体且舌苔为黄色的人患胃腺癌的风险较高, 这2个位点的基因突变可能与舌苔苔色(表型)在胃腺癌的发生、发展过程中起到了协同作用, 两组人群在各位点同一基因型的不同苔质舌苔的差异均具有统计学意义, 这反映了胃腺癌组和对照组的苔质差别有明显的统计学差异, 对照组薄苔比例较高, 而病例组异常舌苔的比例较高. 此结果初步揭示了CDH1基因多态性与胃腺癌患者舌苔辨证有一定关联, 强调了在中医临床诊断中望舌苔辨证的科学意义, 丰富舌诊临床应用的科学内涵, 为寻找既具备胃腺癌的危险基因又具备异常舌苔表型的高危个体提供线索, 为中医舌诊方法的现代化提供科学根据.
本研究初步进行2种苔色和4种苔质与E-cad编码基因CDH1的rs16260位点、rs17690554位点, 3'UTR区rs13689位点以及一个同义突变位点 rs1801552的单核苷酸多态性分析, 进一步的研究要着重于扩大样本量和收集更多的相关生物学指标以及基因型和表型的相关性研究, 以期得出更加可靠和准确的结论, 为胃腺癌患者易感基因的鉴定、舌诊与胃腺癌之间的关系, 以及疾病的防治奠定基础.
胃癌中医证型的大样本研究发现, 舌象是中医胃癌临床证候分类的重要指标, 对于判断疾病的性质、推断病情的进退和预测疾病预后有着重要的作用.
沈克平, 主任医师, 上海中医药大学附属龙华医院
E-cad编码基因CDH1是已经确认的肿瘤抑制基因, 已有研究表明CDH1基因5'端启动子区rs16260位点的单核苷酸多态性, 可以下调基因的转录活性, 导致蛋白表达水平下调, 增加对上皮性肿瘤的易感性.
将中医舌诊与基因多态性结合起来开展中西医结合研究, 揭示胃腺癌患者基因位点突变与舌苔形成和变化的科学内涵, 具有较好的医学意义.
本文研究胃腺癌发生的潜在危险因素, 所得结果将为胃腺癌的预防及高危险人群筛查提供中西医理论支持.
舌苔: 散布在舌体表面的一层苔垢, 是由脾胃之气上熏、胃津上潮、凝聚于舌面而生. 舌苔与脾胃的生理、病理关系十分密切, 在胃的病变过程中, 舌苔的变化反映病邪的深浅、疾病的性质和邪正的消长.
本研究试图研究CDH1基因多态性与胃腺癌患者舌苔辨证的相关性, 对胃腺癌的发病机制探讨及舌苔的中医诊断提供了一定参考价值.
编辑: 张姗姗 电编:闫晋利
| 7. | 周 永宁, 徐 采朴, 韩 彪, 王 金穗, 房 殿春, 彭 贵勇, 杨 建民, 刘 海峰. 胃癌E-钙黏蛋白表达与临床病理学的关系. 世界华人消化杂志. 2002;10:1121-1124. [DOI] |
| 10. | Van Aken E, De Wever O, Correia da Rocha AS, Mareel M. Defective E-cadherin/catenin complexes in human cancer. Virchows Arch. 2001;439:725-751. [PubMed] |
| 13. | Krejs GJ. Gastric cancer: epidemiology and risk factors. Dig Dis. 2010;28:600-603. [PubMed] [DOI] |
| 19. | 齐 文升, 边 永军, 宋 庆桥, 李 攻戍, 唐 旭东, 姜 在, 付 亚龙, 王 映辉. SARS恢复期患者舌象特征及其演变规律探讨. 中国中医基础医学杂志. 2003;9:831-833. |
| 21. | 韩 亮, 沈 世强, 童 仕伦, 向 进见. E-钙粘蛋白和γ-连环蛋白在胃镜活检胃癌组织中的表达及其意义. 武汉大学学报(医学版). 2003;24:28-31. |
| 25. | Li LC, Chui RM, Sasaki M, Nakajima K, Perinchery G, Au HC, Nojima D, Carroll P, Dahiya R. A single nucleotide polymorphism in the E-cadherin gene promoter alters transcriptional activities. Cancer Res. 2000;60:873-876. [PubMed] |
| 26. | Cattaneo F, Venesio T, Molatore S, Russo A, Fiocca R, Frattini M, Scovassi AI, Ottini L, Bertario L, Ranzani GN. Functional analysis and case-control study of -160C/A polymorphism in the E-cadherin gene promoter: association with cancer risk. Anticancer Res. 2006;26:4627-4632. [PubMed] |
| 27. | Chen B, Zhou Y, Yang P, Liu L, Qin XP, Wu XT. CDH1-160C& gt; A gene polymorphism is an ethnicity-dependent risk factor for gastric cancer. Cytokine. 2011;55:266-273. [PubMed] [DOI] |
| 29. | Humar B, Graziano F, Cascinu S, Catalano V, Ruzzo AM, Magnani M, Toro T, Burchill T, Futschik ME, Merriman T. Association of CDH1 haplotypes with susceptibility to sporadic diffuse gastric cancer. Oncogene. 2002;21:8192-8195. [PubMed] [DOI] |
| 30. | Park WS, Cho YG, Park JY, Kim CJ, Lee JH, Kim HS, Lee JW, Song YH, Park CH, Park YK. A single nucleotide polymorphism in the E-cadherin gene promoter-160 is not associated with risk of Korean gastric cancer. J Korean Med Sci. 2003;18:501-504. [PubMed] |