修回日期: 2012-01-17
接受日期: 2012-04-17
在线出版日期: 2012-05-18
目的: 探讨三七总皂苷对大鼠小肠缺血再灌注(ischemia-reperfusion, IR)损伤的保护机制.
方法: 用肠系膜上动脉夹闭-松夹方式复制SD大鼠IR模型. 检测血浆脂多糖和D-乳酸含量; 取血液、肝、脾、肠系膜淋巴结, 做细菌培养; 免疫组织化学检测小肠组织中的NF-κB及TNF-α表达; 用脱氧核糖核酸末端转移酶介导的缺口末端标记技术检测小肠组织细胞凋亡.
结果: PNS组肝、脾、肠系膜淋巴结及血液细菌培养阳性数显著低于模型组(P<0.05); 三七总皂苷200 mg/kg和400 mg/kg PNS组血浆脂多糖浓度分别是461 EU/L, 320 EU/L, 与模型组(570 EU/L)比较差异显著(P<0.05); PNS组的血浆D-乳酸浓度分别是0.37 mmol/L, 0.31 mmol/L, 与模型组(0.44 mmol/L)比较差异显著(P<0.05); 三七总皂苷也可降低NF-κB和TNF-α的表达, 且细胞凋亡数密度低于模型组.
结论: 三七总皂苷通过降低NF-κB和TNF-α表达, 减轻细胞因子对小肠的损伤, 减少小肠黏膜细胞凋亡, 发挥对小肠IR损伤的保护作用.
引文著录: 钱忠义, 申丽娟, 王芳, 阮永华. 三七总皂苷预处理对大鼠小肠缺血再灌注损伤的保护作用. 世界华人消化杂志 2012; 20(14): 1178-1183
Revised: January 17, 2012
Accepted: April 17, 2012
Published online: May 18, 2012
AIM: To explore the mechanism underlying the protective effect of Panax notoginseng saponins (PNS) against intestinal ischemia-reperfusion injury in rats.
METHODS: A rat model of intestinal ischemia-reperfusion injury was generated. Rats were divided into four groups: sham-operation group, model control group, low- (200 mg/kg) and high-dose (400 mg/kg) PNS groups. After pretreatment with PNS, plasma levels of D-lactate and lipopolysaccharide (LPS) were determined.Samples of the liver, spleen, mesenteric lymph nodes and blood were taken for culturing aerobic bacteria. The expression of NF-κB and TNF-α in the intestine was detected by immunohistochemistry. Cell apoptosis in the intestine was detected by terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling (TUNEL) assay.
RESULTS: The number of positive bacterial cultures in the liver, spleen, mesenteric lymph nodes and blood was significantly lower in the PNS group than in the model control group (all P < 0.05). Plasma levels of D-lactate and LPS were significantly lower in the PNS group (200 mg/kg, 400 mg/kg) than in the model control group (LPS: 461 EU/L, 320 EU/L vs 570 EU/L; D-lactate: 0.37 mmol/L, 0.31 mmol/L vs 0.44 mmol/L, both P < 0.05). Treatment with PNS reduced the expression of NF-κB and TNF-α and the number of apoptotic cells in intestinal tissue (all P < 0.05).
CONCLUSION: Pretreatment with PNS protects against intestinal ischemia-reperfusion injury in rats possibly by reducing mucosal cell apoptosis and down-regulating NF-κB and TNF-α expression in the small intestine.
- Citation: Qian ZY, Shen LJ, Wang F, Ruan YH. Pretreatment with Panax notoginseng saponins protects against small intestinal ischemia-reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(14): 1178-1183
- URL: https://www.wjgnet.com/1009-3079/full/v20/i14/1178.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i14.1178
小肠缺血再灌注(ischemia-reperfusion, IR)是一种常见的临床病理生理过程, 甚至发生在严重的心理创伤时[1]. 临床上发生IR时, 肠源性细菌内毒素和缺氧等的共同作用使多种炎性介质和活性氧(reactive oxygen species, ROS)释放, 导致肠道黏膜通透性升高[2]. 肠上皮细胞的凋亡和坏死也导致肠黏膜的不可逆性损伤, 肠黏膜的正常屏障功能遭到破坏, 导致肠道内细菌移居和内毒素入血[3]. 肠道中细菌产生的大量D-乳酸也透过受损的肠黏膜进入血液, 使血液中D-乳酸水平升高. 侵入机体的细菌和内毒素以及由此引发的细胞因子的连锁反应, 有可能启动全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)的发生. 因而肠黏膜屏障成为近年来IR研究热点, 其核心是肠黏膜通透性增高和细菌移位. 三七总皂苷(panax notoginseng total saponins, PNS)是从三七中提取的有效活性成分. 现代化学和药理学研究发现PNS在血液系统、心脑血管系统、神经系统、物质代谢以及抗炎、抗肿瘤等方面均有较好活性[4,5].
本研究针对IR损伤的有关因素, 探索大鼠小肠IR病理过程中PNS对小肠黏膜屏障的保护作用. 通过对IR小肠组织NF-κB及TNF-α表达进行检测, 明确PNS对其表达的影响, 应用脱氧核糖核酸末端转移酶介导的缺口末端标记(terminal deoxynucleotidyl transferase-mediated nick end labeling, TUNEL)技术检测IR小肠组织细胞凋亡, 以研究实验中肠黏膜屏障的损伤机制及PNS对其影响. 检测血液中脂多糖(lipopolysaccharide, LPS)及D-乳酸, 以研究实验中肠黏膜屏障通透性及PNS的影响. 探索PNS对大鼠小肠IR损伤是否具有保护作用及作用机制.
清洁级(specific pathogen free, SPF)SD大鼠80只, 雌雄各半. 体质量: 雌鼠200-220 g, 雄鼠350-380 g, 由昆明医学院实验动物中心提供[合格证号: SCXK(滇)2008-2011]. PNS由昆明圣火制药有限责任公司提供(批号: 20080812).
1.2.1 分组: SD大鼠共分4组, 20只/组, 即模型组、PNS 200 mg/kg、400 mg/kg PNS组和假手术组.
1.2.2 急性肠缺血再灌注: 采用肠系膜上动脉夹闭-松夹方式复制肠IR损伤模型[6,7]. PNS组在建立模型12 h前灌胃给予PNS预处理. 实验结束后取材, 在取血浆及肝、脾、淋巴结后, 再取IR回肠一段, 用4%中性甲醛固定, 用于免疫组织化学检查.
1.2.3 LPS: PNS组和模型组大鼠缺血1 h, 再灌注1 h后, 假手术组暴露肠系膜上动脉2 h后, 采集肠系膜上静脉血, 采用鲨实验偶氮显色法检测血浆LPS.
1.2.4 血浆D-乳酸: 采集肠系膜静脉血血浆标本, 用肝素作为抗凝剂, 采用酶联紫外分光光度法检测血浆D-乳酸[8].
1.2.5 肠道细菌移居培养: PNS组和模型组大鼠再灌注1 h后, 假手术组暴露肠系膜上动脉2 h, 按无菌手术要求, 取肠系膜静脉血, 取肝、脾、肠系膜淋巴结称质量匀浆, 将肝、脾匀浆稀释2、4、8、16倍, 淋巴结稀释成4、16、64、256. 分别取1 mL移入含基础培养基的培养皿内, 置入CO2培养箱中做需氧细菌培养, 48 h后观察结果.
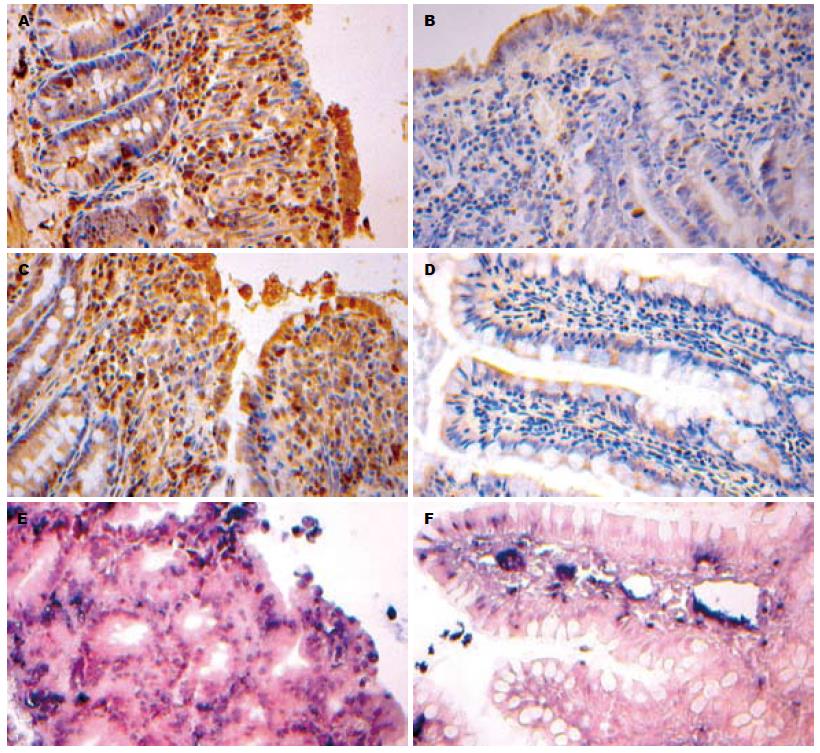
1.2.6 免疫组织化学检测TNF和NF-κB: 石蜡切片脱蜡至水, 高温高压抗原修复, 3%H2O2阻断内源性过氧化物酶的活性, 非免疫小牛血清封闭, 每张切片加50 μL一抗, 37 ℃恒温箱作用1 h, PBS冲洗, 每张切片加50 μL二抗, 37 ℃恒温箱作用15 min, DAB显色5 min, 苏木素复染, 中性树胶封固. 细胞浆内出现棕黄色颗粒为阳性, 阳性物用HPIA-2000图文分析系统定量分析, 结果用吸光度(A)值来表示, A值越大, 说明免疫组织化学阳性物质越多.
1.2.7 肠黏膜上皮细胞凋亡检测: 应用TUNEL技术检测IR小肠组织细胞凋亡, 试剂购自美国Roche. 组织切片用蛋白酶K(200 mg/L)在37 ℃消化15 min, 50 μL TdT加450 μL荧光素标记的dUTP配成TUNEL反应混合液, 阳性对照片预先经过加入100 μL DNase处理, 每片滴加TUNEL反应液37 ℃孵育1 h. 阴性对照片仅加50 μL荧光素标记的dUTP液. PBS漂洗2次, 滴加抗荧光素抗体-碱性磷酸酶复合物孵育37 ℃ 30 min. BCIP/NBT显色8 min. 核快红复染3 min, 水性封片剂封片. 结果为TUNEL凋亡细胞核呈蓝紫色, 正常细胞核呈红色. 阳性细胞用HPIA-2000图文分析系统计数分析, 结果用数密度(凋亡细胞数/检测面积)表示, 数密度值越大, 表明凋亡细胞越多.
统计学处理 实验数据在Windows XP操作系统中, 应用SPSS11.5统计软件进行分析检验. 对血浆LPS浓度、小肠组织免疫组织化学TNF-α和NF-κB的表达进行相关性统计分析.
PNS组血浆LPS浓度为320 EU/L, 明显低于模型组(570 EU/L, P<0.05), 但略高于假手术组. PNS组血浆D-乳酸比模型组低(0.31 mmol/L vs 0.44 mmol/L, P<0.05), 但接近假手术组水平(表1).
模型组培养阳性数较高, 20例SD大鼠中, 淋巴结、肝、脾和血液中培养的阳性数分别是19例、18例、18例和18例; PNS组相对较低, 20例PNS组(200 mg/kg)SD大鼠中, 在淋巴结、肝、脾和血液中培养的阳性数分别是12例、9例、9例和10例; 20例PNS组(400 mg/kg)SD大鼠中, 在淋巴结、肝、脾和血液中培养的阳性数分别是10例、8例、9例和7例. PNS组与模型组比较差异显著(P<0.05), 假手术组全部为零(表2).
绒毛上皮细胞浆内可见棕黄色的TNF-α、NF-κB阳性表达颗粒, 绒毛固有膜内淋巴细胞、单核细胞及中性粒细胞也有TNF-α表达, 其中模型组表达强度最高, 假手术组呈弱表达(图1). 运用病理图文分析系统对表达结果做定量分析, PNS组TNF-α和NF-κB A值比模型组低(P<0.05, 表3).
PNS能减少小肠组织细胞凋亡数密度(凋亡细胞阳性数/检测面积), 200和400 mg/kg PNS组细胞凋亡数密度依次为0.44±0.07、0.32±0.06, 模型组和假手术组依次为0.57±0.07、0.18±0.04, 组间比较差异显著(P<0.05, 图1).
LPS血浆浓度与TNF-α, NF-κB的表达均呈显著正相关(r = 0.912, P<0.01), 且TNF-α和NF-κB二者的表达也呈显著正相关(r = 0.867, P<0.01).
在小肠IR损伤病理生理过程中, LPS是一个关键的损伤因素和重要观察指标. 白细胞、血管内皮细胞、平滑肌细胞等都可能是LPS作用的靶细胞. LPS对这些细胞的激活或损伤导致多种病理过程的发生[9]. 内皮细胞受LPS刺激后可产生白介素(Interleukins, ILs)、生长因子和NO, 表达黏附分子和激活NF-κB, 这些变化在弥散性血管内凝血(diffuse intravascular coagulation, DIC)、脓毒血症和多系统器官功能衰竭(multiple system organ failure, MSOF)的发生中起重要作用[10,11]. 研究发现p38在LPS诱导TNF-α生成中具有重要作用[12,13]. 通过一系列的分子之间信号传导机制, LPS可迅速引起细胞骨架蛋白的解聚和重组, 细胞与细胞间以及细胞与基底膜间的黏附连接松解, 细胞间缝隙形成, 最后导致微血管通透性升高和肠黏膜屏障的破坏[14]. 研究中, PNS组LPS明显低于模型组, 表明PNS对IR肠黏膜屏障具有较好保护作用, 从而阻止细菌及其产物LPS向肠外器官移位. 发生IR情况时, 肠黏膜屏障遭到破坏, 肠黏膜上皮细胞间紧密连接破坏, 甚至黏膜上皮细胞坏死脱落, 因而大量LPS进入血液循环. 进入血液循环的LPS将激活多种细胞, 产生大量细胞因子, 活化相关信号传导通路, 导致组织细胞损伤. LPS刺激多种生物活性物质生成与释放, 激活补体系统和凝血系统, 这些活性物质作用于小血管造成功能紊乱而导致微循环障碍, 诱发DIC、低血压等[15], 导致患者内毒素休克, 甚至发展为SIRS.
肠道内细菌移位产生的菌血症和败血症可能导致严重临床后果, 细菌移位在基础研究中可作为评价肠黏膜屏障功能可靠的重要指标[16,17]. 研究中模型组细菌培养阳性数较高, 表明模型组小肠黏膜屏障已受到损伤, 而PNS组细菌培养阳性数明显减少. 研究结果表明PNS对肠黏膜屏障有良好保护作用, PNS预处理大鼠IR小肠仍然保留完整的阻挡细菌移位的肠黏膜屏障功能.
研究中, 模型组D-乳酸显著高于PNS组, 200 mg/kg与400 mg/kg PNS组血浆D-乳酸比较差异显著, 体现了PNS良好的量效关系. D-乳酸是肠道固有细菌的代谢终产物. D-乳酸只有在D-乳酸脱氢酶的作用下才能被代谢, 而人类以及哺乳类动物体内只有L-乳酸脱氢酶, 血液中的少量D-乳酸主要通过尿路被排泄[18]. 因此血浆D-乳酸可以作为反应肠道IR损伤的有效标志物[19]. 本研究结果表明, PNS能够有效保护肠黏膜屏障损伤, 其保护作用的有效性可通过检测血浆D-乳酸来反映.
引起IR损伤的细胞因子主要是一类具有炎症介质效应的趋化因子(chemokine). 这些趋化因子包括IL-1、IL-8、TNF-α、中性粒细胞趋化因子(cytokine-induced neutrophil chemoattractant, CINC)和ICAM-1等. 在对心肌IR损伤研究中, Bartee等[20]认为TNF-α产生的可能机制是IR过程中NF-κB通过IκB磷酸化或通过氧化应激反应直接被激活后[21], NF-κB就转位到细胞核内, 激活包括TNF-α基因在内的众多致炎因子, 最终导致IR损伤的发生. 研究显示, 模型组TNF-α呈高表达, 特别是绒毛间质内的炎症细胞出现较多的TNF-α表达. 实验数据经相关性统计分析得出TNF-α的表达量与血浆LPS浓度具有正相关性, 模型组血浆LPS浓度较高时, 小肠黏膜TNF-α表达A值也较高, 认为LPS能够诱导TNF-α表达, 这与Baregamian等[22]研究一致. 顾国嵘等[23]研究认为PNS预处理早期通过抑制TNF-α释放, 对IR心肌产生早期保护作用, 可见PNS可在减少LPS之外同样能够减少TNF-α表达. 研究结果显示, 经PNS预处理的肠标本TNF-α表达减少, 与张毅等[24]研究结论一致. 可以认为, 一方面PNS减少进入血液的LPS而降低TNF-α表达, 另一方面PNS也可能通过另外途径直接减少TNF-α的表达. 结果显示PNS能减少小肠TNF-α表达, 减轻TNF-α导致的肠黏膜损伤.
NF-κB通常与其抑制蛋白IκB(inhibitor of NF-κB)相结合, 并以非活性状态贮存于细胞质中, 在某些有效激活因子的作用下NF-κB可被激活, 从而进入细胞核发挥作用[14]. 有研究显示缺血和再灌注时产生的氧自由基可激活NF-κB[25,26], LPS也是激活NF-κB的有效因子[27]. 唐旭东等[28]研究提示PNS通过抑制核因子NF-κB的活化, 从而起到对IR心肌的保护作用. 模型组小肠组织NF-κB表达显著高于PNS组, 经相关性分析表明NF-κB表达与血浆LPS浓度及TNF-α表达呈良好正相关性, 有理由认为, 血浆LPS浓度升高与小肠组织NF-κB表达有某种关联, 支持LPS可作为NF-κB的激活因子的观点. 激活的NF-κB继而通过复杂的分子转导机制, 激活TNF-α基因的转录与表达, 最终导致组织细胞的损伤. 研究中PNS组NF-κB表达减少, 说明PNS通过某种机制减少NF-κB表达, 最终减少TNF-α等致炎性细胞因子的产生, 从而发挥对IR损伤组织的保护作用.
肠黏膜细胞凋亡是IR发生过程中肠黏膜屏障损伤的重要机制之一[29,30]. 研究运用TUNEL技术检测小肠黏膜上皮细胞凋亡发现, 模型组上皮细胞凋亡数密度明显增加, 这表明细胞凋亡在IR导致损伤过程中扮演重要角色, 而PNS能减少小肠组织细胞凋亡数密度. 本研究结果也支持NF-κB的活化在诱导上皮细胞凋亡过程中具有一定作用的观点.
总之, PNS预处理对IR肠黏膜屏障有良好保护作用, 其有效性可通过细菌移位、血浆D-乳酸和LPS来反应. PNS预处理可通过减少NF-κB及TNF-α表达, 减少IR小肠组织细胞凋亡发挥对小肠IR损伤的保护作用.
小肠缺血性再灌注(IR)是一种常见的临床病理生理过程, 在临床上发生IR时有可能启动全身炎症反应综合征(SIRS), 因而肠黏膜屏障成为近年来缺血再灌注研究热点, 其核心是肠黏膜通透性增高和细菌移位.
白爱平, 副教授, 江西省南昌大学第一附属医院消化病研究所
IR损伤机制复杂, 救治困难, 因而是近年研究热点. 细胞因子和凋亡是IR组织损伤的重要基础.
Joep等研究显示, IR诱导补体C3及其产物激活, IR肠组织出现IL-8, IL-6及TNF-α mRNA强表达, 并伴以IL-6和IL-8释放进入血液循环. 认为人类肠道IR会诱导炎症, 具有补体活化, 生产并释放细胞因子进入血液循环, 内皮细胞激活, 嗜中性粒细胞涌入IR损伤组织等特征.
本研究针对IR损伤的有关因素, 不仅仅研究作为结果的细胞凋亡和细菌移居, 而且检测小肠组织中的NF-κB、TNF-α、Bax及Bcl-2表达, 探索IR病理过程中PNS对小肠黏膜屏障的保护机制.
研究表明PNS具有减少NF-κB、TNF-PGC、Bax及Bcl-2的作用, 挖掘三七的药理功效有助于三七在临床上的合理应用, 并为发现三七的临床新用途提供科学依据.
本文探讨了三七总皂苷预处理对大鼠小肠IR损伤的保护作用, 选题准确, 具有一定的临床意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Li Q, Zhang Q, Xu G, Yin P, Li N, Li J. Metabonomics study of intestinal transplantation using ultrahigh-performance liquid chromatography time-of-flight mass spectrometry. Digestion. 2008;77:122-130. [PubMed] [DOI] |
| 2. | Santos CH, Gomes OM, Pontes JC, Miiji LN, Bispo MA. The ischemic preconditioning and postconditioning effect on the intestinal mucosa of rats undergoing mesenteric ischemia/reperfusion procedure. Acta Cir Bras. 2008;23:22-28. [PubMed] [DOI] |
| 3. | Bretz B, Blaze C, Parry N, Kudej RK. Ischemic postconditioning does not attenuate ischemia-reperfusion injury of rabbit small intestine. Vet Surg. 2010;39:216-223. [PubMed] [DOI] |
| 4. | Huang YS, Yang ZC, Yan BG, Hu XC, Li AN, Crowther RS. Improvement of early postburn cardiac function by use of Panax notoginseng and immediate total eschar excision in one operation. Burns. 1999;25:35-41. [PubMed] [DOI] |
| 5. | Chan P, Thomas GN, Tomlinson B. Protective effects of trilinolein extracted from panax notoginseng against cardiovascular disease. Acta Pharmacol Sin. 2002;23:1157-1162. [PubMed] |
| 6. | Sukhotnik I, Shehadeh N, Mogilner J, Shamir R, Helou H, Lurie M, Shiloni E. Beneficial effects of oral insulin on intestinal recovery following ischemia-reperfusion injury in rat. J Surg Res. 2005;128:108-113. [PubMed] [DOI] |
| 7. | Gomes OM, Brasileiro Filho G, Porto LA, Prata PH, Paixão Rde M. Ischemia-reperfusion histopathology alterations of the rabbit intestinal wall with and without exclusion of the collateral mesenteric circulation supply. Acta Cir Bras. 2010;25:318-321. [PubMed] [DOI] |
| 8. | Grootjans J, Thuijls G, Verdam F, Derikx JP, Lenaerts K, Buurman WA. Non-invasive assessment of barrier integrity and function of the human gut. World J Gastrointest Surg. 2010;2:61-69. [PubMed] [DOI] |
| 9. | Zareie M, Johnson-Henry K, Jury J, Yang PC, Ngan BY, McKay DM, Soderholm JD, Perdue MH, Sherman PM. Probiotics prevent bacterial translocation and improve intestinal barrier function in rats following chronic psychological stress. Gut. 2006;55:1553-1560. [PubMed] [DOI] |
| 10. | Park SW, Chen SW, Kim M, Brown KM, Kolls JK, D'Agati VD, Lee HT. Cytokines induce small intestine and liver injury after renal ischemia or nephrectomy. Lab Invest. 2011;91:63-84. [PubMed] [DOI] |
| 11. | Efstathopoulos N, Tsaganos T, Giamarellos-Bourboulis EJ, Kaldis P, Nicolaou V, Papalois A, Koutoukas P, Papachristou G, Giamarellou H. Early apoptosis of monocytes contributes to the pathogenesis of systemic inflammatory response and of bacterial translocation in an experimental model of multiple trauma. Clin Exp Immunol. 2006;145:139-146. [PubMed] [DOI] |
| 12. | Seitz G, Warmann SW, Guglielmetti A, Heitmann H, Ruck P, Kreis ME, Fuchs J. Protective effect of tumor necrosis factor alpha antibody on experimental necrotizing enterocolitis in the rat. J Pediatr Surg. 2005;40:1440-1445. [PubMed] [DOI] |
| 13. | Park JJ, Chung KY, Nam YS. Two-day fasting prior to intestinal ischemia-reperfusion injury on bacterial translocation in rats. J Invest Surg. 2011;24:262-266. [PubMed] [DOI] |
| 14. | Hunninghake GW, Doerschug KC, Nymon AB, Schmidt GA, Meyerholz DK, Ashare A. Insulin-like growth factor-1 levels contribute to the development of bacterial translocation in sepsis. Am J Respir Crit Care Med. 2010;182:517-525. [PubMed] [DOI] |
| 15. | Hei ZQ, Gan XL, Huang PJ, Wei J, Shen N, Gao WL. Influence of Ketotifen, Cromolyn Sodium, and Compound 48/80 on the survival rates after intestinal ischemia reperfusion injury in rats. BMC Gastroenterol. 2008;8:42. [PubMed] [DOI] |
| 16. | Sasaki M, Joh T. Oxidative stress and ischemia-reperfusion injury in gastrointestinal tract and antioxidant, protective agents. J Clin Biochem Nutr. 2007;40:1-12. [PubMed] [DOI] |
| 17. | Grootjans J, Lenaerts K, Derikx JP, Matthijsen RA, de Bruïne AP, van Bijnen AA, van Dam RM, Dejong CH, Buurman WA. Human intestinal ischemia-reperfusion-induced inflammation characterized: experiences from a new translational model. Am J Pathol. 2010;176:2283-2291. [PubMed] [DOI] |
| 18. | Assadian A, Assadian O, Senekowitsch C, Rotter R, Bahrami S, Fürst W, Jaksch W, Hagmüller GW, Hübl W. Plasma D-lactate as a potential early marker for colon ischaemia after open aortic reconstruction. Eur J Vasc Endovasc Surg. 2006;31:470-474. [PubMed] [DOI] |
| 19. | Herrera DJ, Morris K, Johnston C, Griffiths P. Automated assay for plasma D-lactate by enzymatic spectrophotometric analysis with sample blank correction. Ann Clin Biochem. 2008;45:177-183. [PubMed] [DOI] |
| 20. | Bartee E, Mohamed MR, McFadden G. Tumor necrosis factor and interferon: cytokines in harmony. Curr Opin Microbiol. 2008;11:378-383. [PubMed] [DOI] |
| 21. | Wang J, Qiao L, Li Y, Yang G. Ginsenoside Rb1 attenuates intestinal ischemia-reperfusion- induced liver injury by inhibiting NF-kappaB activation. Exp Mol Med. 2008;40:686-698. [PubMed] [DOI] |
| 22. | Baregamian N, Song J, Bailey CE, Papaconstantinou J, Evers BM, Chung DH. Tumor necrosis factor-alpha and apoptosis signal-regulating kinase 1 control reactive oxygen species release, mitochondrial autophagy, and c-Jun N-terminal kinase/p38 phosphorylation during necrotizing enterocolitis. Oxid Med Cell Longev. 2009;2:297-306. [PubMed] [DOI] |
| 23. | 顾 国嵘, 黄 培志, 葛 均波, 童 朝阳, 姚 晨玲, 施 东伟, 樊 帆. 缺血及三七总皂甙预处理对心肌缺血-再灌流损伤的保护作用. 中华急诊医学杂志. 2005;14:307-309. |
| 24. | 张 毅, 叶 启发, 明 英姿, 许 贤林, 肖 建生, 李 远明. 三七总皂甙预处理大鼠供肝对细胞凋亡及TNF-α、Caspase-3表达的影响. 中国现代医学杂志. 2005;15:172-176. |
| 25. | Wright CJ, Zhuang T, La P, Yang G, Dennery PA. Hyperoxia-induced NF-kappaB activation occurs via a maturationally sensitive atypical pathway. Am J Physiol Lung Cell Mol Physiol. 2009;296:L296-L306. [PubMed] [DOI] |
| 26. | De Plaen IG, Liu SX, Tian R, Neequaye I, May MJ, Han XB, Hsueh W, Jilling T, Lu J, Caplan MS. Inhibition of nuclear factor-kappaB ameliorates bowel injury and prolongs survival in a neonatal rat model of necrotizing enterocolitis. Pediatr Res. 2007;61:716-721. [PubMed] [DOI] |
| 27. | Arndt PG, Suzuki N, Avdi NJ, Malcolm KC, Worthen GS. Lipopolysaccharide-induced c-Jun NH2-terminal kinase activation in human neutrophils: role of phosphatidylinositol 3-Kinase and Syk-mediated pathways. J Biol Chem. 2004;279:10883-10891. [PubMed] [DOI] |
| 28. | 唐 旭东, 姜 建青, 姜 大春, 赁 常文, 刘 宝玉, 顾 大勇. 三七总皂苷对心肌缺血再灌注中中性粒细胞核因子-κB活化及其粘附的影响. 中国药理学通报. 2002;18:556-506. |
| 29. | Vyas D, Robertson CM, Stromberg PE, Martin JR, Dunne WM, Houchen CW, Barrett TA, Ayala A, Perl M, Buchman TG. Epithelial apoptosis in mechanistically distinct methods of injury in the murine small intestine. Histol Histopathol. 2007;22:623-630. [PubMed] |
| 30. | Bedirli N, Akyürek N, Kurtipek O, Kavutcu M, Kartal S, Bayraktar AC. Thoracic epidural bupivacaine attenuates inflammatory response, intestinal lipid peroxidation, oxidative injury, and mucosal apoptosis induced by mesenteric ischemia/reperfusion. Anesth Analg. 2011;113:1226-1232. [PubMed] [DOI] |