修回日期: 2012-03-13
接受日期: 2012-03-25
在线出版日期: 2012-05-08
Ménétrier's病(Ménétrier's disease, MD)是一种罕见的肥厚性胃炎, 以胃黏膜皱襞粗大、肥厚致大量蛋白质丢失, 黏液分泌增加, 胃酸分泌减少及低蛋白血症为特征. 本文报道MD致顽固性低蛋白血症1例. 患者, 女, 55岁, 以"食欲减退, 颜面及双下肢水肿半年"入院. 其血清总蛋白39.8 g/L, 白蛋白23.8 g/L. CT示胃黏膜皱襞弥漫性、不均匀增厚. 胃镜示胃底和胃体黏膜皱襞肥厚、粗大, 胃内见大量黏液潴留. 病理示胃小凹显著变长, 呈螺旋状改变, 固有层内腺体增生, 部分腺体呈囊性扩张, 可见黏液积聚. 本病例提示, 对于无任何胃病症状而出现无法解释的顽固性低蛋白血症患者, 及时采取CT和内镜检查有助于早期诊断.
引文著录: 黄颖秋, 徐俊华, 韩春丽, 刘旭妍. Ménétrier's病致顽固性低蛋白血症1例. 世界华人消化杂志 2012; 20(13): 1160-1163
Revised: March 13, 2012
Accepted: March 25, 2012
Published online: May 8, 2012
Ménétrier's disease (MD) is a rare hypertrophic gastropathy characterized by giant, hyperplastic gastric mucosal folds, hyperproliferative protein-losing gastropathy, hypoalbuminemia, increased mucus secretion, and hypochlorhydria. Here we report a case of MD with refractory hypoalbuminemia in a 55-year-old female patient who presented to our hospital with anorexia, edema in the face and double lower limbs for half a year. Her serum total protein level was 39.8 g/L and her albumin level was 23.8 g/L. A CT scan revealed diffuse, uneven thickening of large gastric mucosal folds. Gastroendoscopy showed hyperplastic gastric mucosal folds in the body and fundus and profuse mucus. Microscopic examination of the biopsied specimens showed massive hyperplasia of surface and glandular mucous cells, a remarkable distortion of the foveolar, tortuosity and cystic dilatation of the glands. CT and endoscopy can help arrive at an accurate diagnosis of unexplained refractory hypoalbuminemia in patients without any gastropathy symptoms.
- Citation: Huang YQ, Xu JH, Han CL, Liu XY. Ménétrier's disease with refractory hypoalbuminemia: A case report. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1160-1163
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1160.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1160
Ménétrier's病(Ménétrier's disease, MD)是一种不明原因的罕见胃黏膜腺体增生病, 以胃黏膜良性增生肥厚为主要特征[1]. 该病于1888年由Ménétrier医生首次发现而得名. 因其临床表现不典型, 误诊率极高, 国内外报道甚少. 本文报道MD致顽固性低蛋白血症1例, 以期引起临床工作者对此病的认识.
患者, 女, 55岁, 以"食欲减退, 颜面及双下肢水肿半年"于2011-11-07入院. 患者入院前半年, 无明显诱因自觉食欲减退, 颜面及双下肢水肿, 呈进行性加重, 无恶心、呕吐, 无烧心、反酸, 无腹痛、腹泻等消化不良症状, 曾在中国医大盛京医院诊断为"低蛋白血症", 在家自行间断输注白蛋白治疗, 因病情无缓解, 来我院诊治. 既往健康.
入院查体: 神清, 一般状态尚可, BP 120/80 mmHg, 颜面水肿, 皮肤黏膜无黄染, 无肝掌、蜘蛛痣, 全身浅表淋巴结无肿大, 心肺无异常, 腹平坦, 无胃肠型, 无腹壁静脉曲张, 全腹无压痛, 肝脾肋下未触及, 未触及腹部包块, 移动性浊音(-), 双下肢明显凹陷性水肿, 四肢关节无红肿热痛及功能障碍, 双侧肌力5级, 双侧Babinski征(-).
实验室检查: 血白细胞(white blood cells, WBC)8.65×109/L, 中性粒细胞66.87%, 红细胞(red blood cells, RBC)4.248×1012/L, Hb 130.5 g/L, 血小板247.8×109/L; 尿蛋白(-); 便潜血(-); AST 22 U/L, ALT 33 U/L, ALP 44 U/L, γ-GT 12 U/L, 总蛋白39.8 g/L, 白蛋白23.8 g/L, 总胆红素15.8 μmol/L; Cr 84 μmol/L, BUN 8.65 mmol/L; HBsAb(+), HBsAg(-), HBeAg(-), HBeAb(-), HBcAb(-), S1(-), HAVAb(-), HCVAb(-); 肿瘤标志物AFP 3.72 IU/mL, CEA 2.39 μg/L, CA125 9.67 U/mL, CA199 7.00 U/mL; FT3 4.63 pmol/L, FrT4 16.11 pmol/L, TSH3 4.811 IU/mL; B型钠尿肽前体31 ng/L.
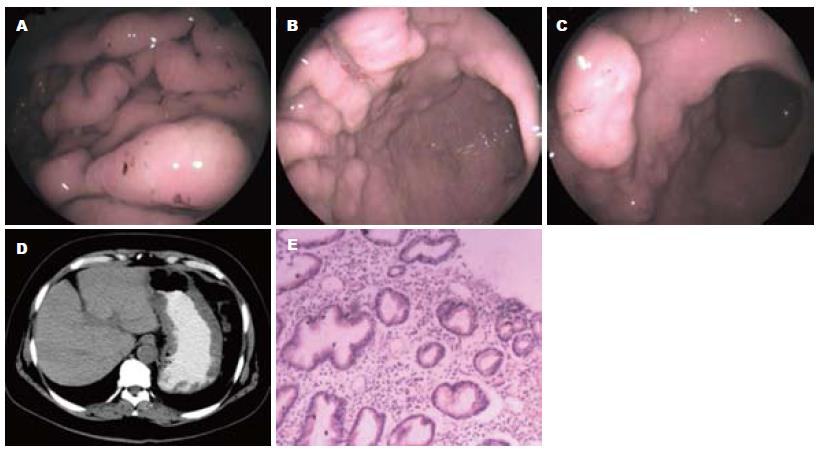
ECG、腹部和心脏彩超均未见异常. 胃镜示胃体大弯黏膜皱襞肥厚、粗大, 水浸状, 小弯黏膜多处见大小不等的颗粒样黏膜增生, 顶端见黏膜剥脱糜烂, 胃体下部前壁见一0.8 cm×0.6 cm×0.3 cm大小的结节样黏膜增生, 顶端糜烂, 白苔附着, 胃窦四壁散在颗粒样、结节样黏膜增生, 质地稍韧(图1A-C). 腹部CT示胃黏膜皱襞弥漫性、不均匀增厚, 呈手指样或息肉样改变, 胃腔变小, 肝胆脾胰未见异常(图1D).
胃镜活检组织病理报告: 胃小凹显著变长, 呈螺旋状改变, 固有层内腺体增生, 部分腺体囊性扩张, 可见黏液积聚, 间质内可见炎性细胞浸润(图1E). 根据上述资料, 该病例诊断为MD, 予白蛋白静脉滴注半月, 症状无明显缓解, 血浆总蛋白及白蛋白仍明显低于正常水平, 建议其手术治疗, 患者拒绝. 出院随访, 患者间断自行输注白蛋白症状仍无缓解, 血清白蛋白最低至19.7 g/L, 病情持续恶化, 周身水肿进一步加重, 并引发胸腔积液及大量腹腔积液, 经诊断性穿刺提示为漏出液, 于2012-01-28患者入住我院普外科病房, 拟行全胃切除术.
MD是一种以胃黏膜过度增生、胃壁广泛增厚为特征的罕见疾病[1], 其组织病理学特点为胃小凹显著变长、弯曲, 呈螺旋状或树枝样改变, 固有层内腺体增生、变形, 呈囊性扩张, 可见黏液积聚及炎性细胞浸润等. MD的发病原因尚不十分清楚, 巨细胞病毒感染[2,3]、疱疹病毒感染[4]、幽门螺杆菌(Helicobacter pylori, H. pylori)感染[2,5,6]、血管内皮生长因子(vascular endothelial growth factor, VEGF)介导[7]、胃上皮内转化生长因子-α(transforming growth factor-α, TGF-α)的过度表达[1]以及TGF-α相关的MUC2和MUC3的过度表达[8]等因素可能参与了MD的发病机制.
MD患者多有消化不良症状, 可能与胃腺体的黏液细胞增生, 主细胞和壁细胞减少导致的胃蛋白酶和胃酸分泌减少有关. 低蛋白血症是MD患者的主要特征, 这可能由于蛋白摄入过少、丢失过多或胃黏膜过度分泌白蛋白以及重吸收障碍所致. 此外, VEGF也可能介导了低蛋白血症的发生[7]. 上述原因常导致患者出现顽固的低蛋白血症.
MD为癌前病变[9], 已见MD引发胃癌的相关报道[10]. MD与胃肠道间质瘤(gastrointestinal stromal tumor, GIST)都是酪氨酸激酶受体(PTKs)异常[11]导致的胃部增生性疾病. MD的发病可能与TGF-α和表皮生长因子受体(EGFR、PTK配体)的过度表达有关, 由于TGF-α局部产生过多, 可过度激活EGFR信号通路, 导致胃黏膜上皮细胞过度增生而形成巨大肥厚的胃黏膜皱襞[11]. 而GIST的发病可能与编码PTK的KIT基因突变导致构激酶(constitutive kinase)的激活和消化系Cajal细胞的肿瘤转变有关[11].
轻型MD患者采用质子泵抑制剂、胃黏膜保护剂及补充白蛋白等治疗可暂时缓解症状, 但无法根治. 近年研究显示, 清除H. pylori[6]、应用奥曲肽[12]及EGFR抑制剂[13]也可暂时缓解MD患者的低蛋白血症, 这可能与奥曲肽或EGFR抑制剂阻断了EGF的促细胞增殖作用有关[12,13]. 但外科手术仍是目前MD确切有效的治疗手段. 对内科治疗无效或癌变者, 可行全胃切除手术[14]或腹腔镜下全胃切除术[15], 对于无蛋白减少的MD患者, 也可在超声内镜(endoscopic ultrasound, EUS)引导下行内镜黏膜下切除术[16].
本例患者以"食欲减退、颜面及双下肢水肿半年"入院, 院前及住院后的多次实验室检查均显示严重的低蛋白血症, 其肿瘤标志物、肝脏、肾脏、心脏及甲状腺功能等各项指标均正常, 患者无摄食障碍及偏食习惯, 也无小肠吸收不良综合征及蛋白丢失性肠病的依据, 因此可排除上述原因导致的水肿及低蛋白血症. 该患者经输注白蛋白等对症治疗半月后, 症状无缓解, 低蛋白血症也无改善, 对于这种无法解释的顽固性低蛋白血症患者, 应高度怀疑MD的可能. 此时采取胃镜或腹部CT检查显得极为重要. 该患经腹部CT、胃镜检查及病理活检最终证实为MD.
本例患者的临床表现很不典型, 其原因尚不清楚, 可能与个体差异有关. 此外, MD为癌前病变, 可诱发或伴发胃癌, 本例患者不仅胃底和胃体黏膜皱襞粗大、肥厚, 且胃体见0.8 cm×0.6 cm×0.3 cm大小的黏膜增生性病变, 应与相关疾病鉴别. 病理活检、肿瘤标志物及相关实验室检查有助于MD与淋巴细胞性胃炎、嗜酸细胞性胃炎、H. pylori相关性胃炎、卓-艾氏综合症、胃癌、胃恶性淋巴瘤及各种胃肉芽肿病的鉴别诊断.
本例MD患者经内科保守治疗无效, 尽早采取外科手术或腹腔镜下全胃或部分胃切除应是最佳和有效的治疗手段.
Ménétrier's病是临床罕见疾病, 以胃黏膜皱襞良性增生肥厚及低蛋白血症为主要特征, 多有消化不良症状, 但临床表现不典型, 容易误诊, 自1888年发现迄今仅见100余例报道.
姜相君, 主任医师, 青岛市市立医院消化科
Iwama等报道巨细胞病毒和H. pylori双重感染致Ménétrier's病1例, 该报道为探讨Ménétrier's病的发病原因提供了依据.
本病例以顽固性低蛋白血症为主要特征, 无任何消化不良症状. 本病例提示, 对于临床无法解释的、治疗无效的顽固性低蛋白血症患者应高度怀疑Ménétrier's病, 应尽早行胃镜及活检组织病理检查.
淋巴细胞性胃炎: 一种新型胃炎, 组织学以胃黏膜表面上皮和小凹上皮内的T淋巴细胞密集浸润为特征, 并以胃体黏膜最为显著, 内镜则显示胃黏膜皱襞粗大、糜烂等.
本文报道的病例罕见, 内容详实可靠, 对临床相关疾病的诊治有较好的指导意义.
编辑: 张珊珊 电编:鲁亚静
| 1. | Lambrecht NW. Ménétrier's disease of the stomach: a clinical challenge. Curr Gastroenterol Rep. 2011;13:513-517. [PubMed] [DOI] |
| 2. | Iwama I, Kagimoto S, Takano T, Sekijima T, Kishimoto H, Oba A. Case of pediatric Ménétrier disease with cytomegalovirus and Helicobacter pylori co-infection. Pediatr Int. 2010;52:e200-e203. [PubMed] [DOI] |
| 3. | Gökçe S, Taşçilar ME, Dabak O, Devrim I, Aydin HI, Unay B. Cytomegalovirus infection with gastric ulcers in Ménétrier's disease and hypergammaglobulinemia. Turk J Pediatr. 2009;51:524. [PubMed] |
| 4. | Jun DW, Kim DH, Kim SH, Song MH, Lee HH, Kim SH, Jo YJ, Park YS. Ménétrier's disease associated with herpes infection: response to treatment with acyclovir. Gastrointest Endosc. 2007;65:1092-1095. [PubMed] [DOI] |
| 5. | Fretzayas A, Moustaki M, Alexopoulou E, Nicolaidou P. Menetrier's disease associated with Helicobacter pylori: three cases with sonographic findings and a literature review. Ann Trop Paediatr. 2011;31:141-147. [PubMed] [DOI] |
| 6. | Lee SY. Future candidates for indications of Helicobacter pylori eradication: do the indications need to be revised? J Gastroenterol Hepatol. 2012;27:200-211. [PubMed] [DOI] |
| 7. | Takeda T, Mitsuyama K, Tsuruta O, Kuboyama S, Kitazaki S, Sata M. Role of vascular endothelial growth factor in protein loss of Ménétrier's disease. Int J Mol Med. 2006;18:571-576. [PubMed] |
| 8. | Zimmer KP, Heine M, Weissen-Plenz G, Scholand KA, Herbst H, Naim HY. TGFα-associated MUC2 and MUC3 expression of the gastric epithelium in Menetrier's disease during remission of ulcerative colitis. Gut. 2011;60:1607-1608. [PubMed] [DOI] |
| 9. | Famularo G, Sajeva MR, Gasbarrone L. Beyond gastritis and before cancer: the strange case of Ménétrier's disease. Intern Emerg Med. 2011;6:369-371. [PubMed] [DOI] |
| 10. | Pereyra L, Gómez EJ, Mella JM, Casas G, Bugari G, Cimmino D, Pedreira S, Boerr LA. [Diffuse gastric cancer associated with Ménétrier's disease]. Acta Gastroenterol Latinoam. 2011;41:142-145. [PubMed] |
| 11. | Coffey RJ, Washington MK, Corless CL, Heinrich MC. Ménétrier disease and gastrointestinal stromal tumors: hyperproliferative disorders of the stomach. J Clin Invest. 2007;117:70-80. [PubMed] [DOI] |
| 12. | Rothenberg M, Pai R, Stuart K. Successful use of octreotide to treat Ménétrier's disease: a rare cause of abdominal pain, weight loss, edema, and hypoalbuminemia. Dig Dis Sci. 2009;54:1403-1407. [PubMed] [DOI] |
| 13. | Fiske WH, Tanksley J, Nam KT, Goldenring JR, Slebos RJ, Liebler DC, Abtahi AM, La Fleur B, Ayers GD, Lind CD. Efficacy of cetuximab in the treatment of Menetrier's disease. Sci Transl Med. 2009;1:8ra18. [PubMed] |
| 14. | de Silva AP, Aryasingha S, Dassanayake AS, Hevavisenthi J, Ratnasena BG, de Silva HJ. Mènétrier's disease treated with gastrectomy. Ceylon Med J. 2008;53:22-23. [PubMed] [DOI] |
| 15. | Sanchez C, Brody F, Pucci E, Bashir S. Laparoscopic total gastrectomy for Ménétrier's disease. J Laparoendosc Adv Surg Tech A. 2007;17:32-35. [PubMed] [DOI] |
| 16. | Gleeson FC, Mangan TF, Levy MJ. Endoscopic ultrasound and endoscopic mucosal resection features of a non-protein losing form of Ménétrier's disease. Clin Gastroenterol Hepatol. 2008;6:e24-e25. [PubMed] [DOI] |