修回日期: 2012-04-06
接受日期: 2012-04-17
在线出版日期: 2012-05-08
目的: 探讨尿皮质素3(Urocotin3, Ucn3)及其受体促肾上腺皮质释放因子受体2(corticotrophin releasing factor receptor 2, CRFR2)在肠易激综合征中的表达.
方法: 将36只180-220 g的Wistar大鼠随机分为对照组(N)、急性应激组(A, 急性束缚1 h)、慢性应激组(C, 28 d不可预知轻度应激)、急慢性联合应激组(AC, 在慢性应激基础上给予急性束缚)4组建模. 采用排便粒数、敞箱行为评分和蔗糖水偏嗜度评价动物模型. 建成后留取大鼠结肠组织, 采用real-time PCR方法检测各组大鼠结肠中Ucn3及其受体CRFR2表达水平的变化.
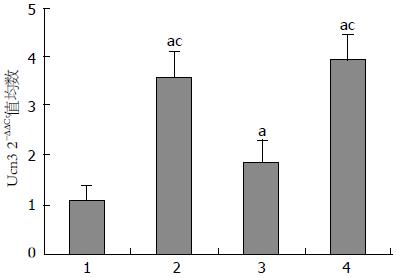
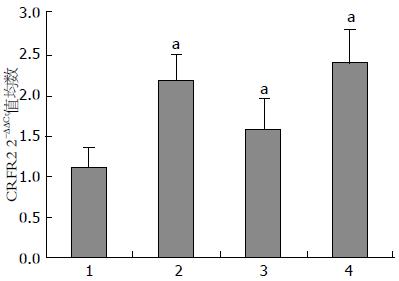
结果: Ucn3在各组大鼠结肠中的表达: N组 1.108±0.293, A组 3.594±1.839, C组 1.852±0.674, AC组 3.989±1.591, 各应激组Ucn3的表达均高于对照组(P<0.05), 各应激组间A组 vs C组(P<0.017), C组 vs AC组(P<0.002), 表达有统计学差异. CRFR2在各组大鼠结肠中的表达: N组 1.042±0.217, A组 2.119±0.468, C组 1.568±0.507, AC组 2.392±0.840, 各应激组CRFR2的表达均高于对照组(P<0.05). 各应激组之间没有统计学差异.
结论: 慢性应激、慢急性联合应激建立肠易激综合征大鼠模型重复性好. Ucn3及其受体CRFR2在肠易激综合征中表达升高, 且Ucn3 在急性应激后升高比慢性应激后更明显.
引文著录: 刘兆霞, 季万胜, 刘晓丽, 王琳, 韩慧蓉, 房春燕, 赵廷坤, 徐继马, 张广学, 曲梅花. Ucn3及其受体CRFR2在肠易激综合征大鼠模型肠神经系统中的表达. 世界华人消化杂志 2012; 20(13): 1094-1099
Revised: April 6, 2012
Accepted: April 17, 2012
Published online: May 8, 2012
AIM: To examine the expression of Urocotin3 (Ucn3) and its receptor corticotrophin-releasing factor receptor 2 (CRFR2) in the colon of rats with irritable bowel syndrome (IBS).
METHODS: Thirty-six Wistar rats were randomly divided into four groups: normal control group (N), acute stress group (A), chronic stress group (C), and acute-chronic stress group (AC). The animal models were assessed by counting fecal pellets, open-field behavior scoring and fluid consumption testing. On day 28 after induction of IBS, the animals were killed to take colon tissue for detecting the expression of Ucn3 and CRFR2 by real-time PCR and for dissecting the myenteric plexus and submucosal plexus for immunoflurescence.
RESULTS: Both Ucn3 and CRFR2 were expressed in the myenteric and submucosal plexus in the colon of rats with IBS. The expression level of Ucn3 was higher in each stress group than in the control group (N: 1.108 ± 0.293; A: 3.594 ± 1.839; C: 1.852 ± 0.674; AC: 3.989 ± 1.591; all P < 0.05). The expression of Ucn3 in the acute stress and acute-chronic groups was higher than that in the chronic stress group (P < 0.017, 0.002). CRFR2 expression was also increased in all the three stress groups compared to the control group (A: 2.119 ± 0.468; C: 1.568 ± 0.507; AC: 2.392 ± 0.840; all P < 0.05). CRFR2 expression showed no significant differences among the three stress groups.
CONCLUSION: The expression of both Ucn3 and CRFR2 increases in the colon of IBS rats, and they may play an important role in the enteric neural system in rats with IBS.
- Citation: Liu ZX, Ji WS, Liu XL, Wang L, Han HR, Fang CY, Zhao TK, Xu JM, Zhang GX, Qu MH. Expression of Urocotin3 and CRFR2 in the enteric nervous system of rats with irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2012; 20(13): 1094-1099
- URL: https://www.wjgnet.com/1009-3079/full/v20/i13/1094.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i13.1094
尿皮质素3(Urocotin3, Ucn3)是CRF家族的一个成员, 由Lewis等[1]于2001年从小鼠和人cDNA文库中克隆出来的1个新基因, 对促肾上腺皮质释放因子受体2(corticotrophin-releasing factor receptor, CRFR2)具有高亲和性, 因而被认为是CRFR2的内源配体[2,3]. Ohata等[4]给自由活动的♂Wistar大鼠脑室内注射Ucn3后, 大鼠的自发性活动明显减少, 固定在一个姿势的时间延长, 表明Ucn3有抗焦虑作用. 并且, 注射Ucn3后大鼠在熟悉的环境中活动明显被抑制, 说明Ucn3有很强的镇静效应. Hsu等[5]应用PCR分析的方法观察到SCP即Ucn3在大多数组织中都有分布, 结肠、小肠、骨骼肌、胃、甲状腺、肾上腺、胰、脾、心都有较高水平的表达, 但其在肠易激综合征(irritable bowel syndrome, IBS)患者肠道的表达是否有改变还不清楚. CRFR2从组织分布上来看, CRFR2广泛分布于中枢和外周组织. 在中枢, CRFR2可见于大脑皮质、下丘脑到脑干的各级水平. 在外周, 分布于心肌细胞、胃肠道、肺、卵巢以及骨骼肌. 且有研究发现CRFR2的激活可缓解结肠扩张诱导的内脏感觉[6]. 但有关CRFR2在大鼠结肠定量、定性、定位研究的报道尚未见. 本研究具体检测Ucn3、CRFR2在结肠的表达, 探讨其表达变化与IBS发病机制的联系, 为进一步阐明Ucn3、CRFR2在IBS发生中的作用提供新的证据.
Wistar大鼠,♂, 体质量160-180 g. 由山东鲁抗医药股份有限公司质检中心试验动物室提供[SLXK鲁20080002]. 荧光定量real-time PCR试剂盒、总RNA提取试剂盒、cDNA逆转录合成试剂盒、DEPC、DNA Marker、EDTA均购自上海生工生物工程技术服务有限公司; 所用引物由大连宝生物公司设计合成; 美国PE公司5700型定量基因分析仪; 英国SYNGENE公司GENE GENIUS数码凝胶成像仪.
1.2.1 肠易激动物模型的建立: 实验动物按体质量排序后依据数字表法随机分为4组: 对照组、急性应激组、慢性应激组和联合应激组. 前4周, 急性应激组、对照组大鼠单笼常规饲养. 慢性应激组、联合应激组大鼠单只孤养, 并参照文献[7]施加以慢性不可预见性的刺激. 第5周不予任何刺激, 第35天急性应激组、联合应激组给予急性束缚应激[8].
1.2.2 肠道敏感性评估: (1)排便测定: 动物置于代谢笼中, 测定各组大鼠2 h内排便粒数; (2)敞箱实验(open-field test): 本实验方法见文献[9,10]; (3)糖水消耗实验: 本实验方法见文献[11].
1.2.3 免疫荧光检测Ucn3的表达: (1)取材: 将大鼠麻醉处死. 剖腹手术分离远端结肠, 取距肛门约4 cm处结肠3 cm. 沿肠系膜处打开肠管, 置于4 ℃含氧Kreb's溶液冲洗2遍, 至干净. 将肠管的浆膜面向上, 固定于树脂托盘上, 沿横轴和纵轴将其展开至面积最大, 置于固定液室温固定至少24 h; (2)制备肠黏膜下神经丛(submucosal plexus, SMP)铺片标本: 将固定好的标本裁剪成约1 cm×1 cm大小, 在体视镜下可见黏膜层呈细颗粒状, 应用显微分离器械小心分离黏膜层. 然后将标本翻转, 浆膜面向上固定, 依次去除纵行肌和环形肌肌束, 即得到完整的SMP铺片标本; (3)制备肠肌间神经丛(myenteric plexus, MP)铺片标本: 浆膜面向上固定于树脂托盘上, 镜下将肠壁的纵行肌和环形肌一同从黏膜下层剥离下来, 然后将分离开的肌肉层环形肌面向上将其肌束剥离, 即可得到MP铺片标本, 显微镜下可见MP神经节呈网格状; (4)Ucn3抗体免疫荧光检测方法: 将制备好的铺片标本裁剪成约0.5 cm×0.5 cm大小, 室温下PBS溶液中漂洗10 min×3. 10%封闭血清中室温下孵育2 h. 加Ucn3一抗(
1:100), 室温过夜. 室温下PBS漂洗10 min×3. SMP与MP分别加FITC标记羊抗兔IgG二抗(1:1 000), 室温避光2 h. PBS漂洗10 min×3, 室温避光. 将标本完全展开平铺于载玻片上, 甘油封片, 加盖玻片. 荧光显微镜检查.
1.2.4 定量real-time PCR检测基因表达差异: (1)取材: 对大鼠进行评分后, 给予水合氯醛腹腔注射麻醉处死. 剖腹手术分离远端结肠, 取距肛门约4 cm处结肠l cm; (2)mRNA的提取: 按照生工RNA提取试剂盒说明提取结肠总RNA. (3)cDNA的合成: 按照生工cDNA合成试剂盒逆转录出cDNA; 取总RNA 1.5 µg, 0.5 µg Oligo(dT) 12-18(0.5 g/L), 加入DEPC H2O至总体积10 µL, 混匀后, 70 ℃, 5 min; 立刻冰浴后加入5 µL M-MLV 5×Reaction Buffer, 2.5 µL dNTP(单个浓度为5 mmol/L), 0.5 µL RNasin Inhibitor, 1 µL M-MLV, 然后补充DEPC水至总体积25 µL, 轻轻混匀, 37 ℃, 60 min, 70 ℃, 15 min; (4)PCR扩增: 引物设计: 从GenBank中查出大鼠Ucn3、CRFR2的mRNA序列, 由大连宝生物公司设计合成引物如下: GAPDH上游引物: GGCACAGTCAAGGCTGAGAATG, 下游引物: ATGGTGGTGAAGACGCCAGTA. 扩增产物143 bp; Ucn3上游引物: TCCCACAAGTTCTACAACGCAGGA, 下游引物: TGGGCAGGTAGCCAAAGTTCTTCT, 扩增产物124 bp; CRFR2上游引物: TGGTGCATACCCTGCCCTATCATT, 下游引物: ACTAAGTCACCAGGTTCCTTGCCA, 扩增产物98 bp. 取2 µL cDNA为模板进行PCR扩展, 加入扩增反应体系中, 设3个复孔, PCR反应体系(25 µL)如下: 12.5 µL MIX, 6.5 µL ddH2O, 上下游引物各2 µL, 2 µL cDNA模板. GAPDH反应条件: 50 ℃ 2 min, 预变性95 ℃ 5 min; 变性94 ℃ 5 s, 退火59 ℃ 30 s, 延伸72 ℃ 30 s, 共40个循环; 终末延伸72 ℃ 7 min. CRFR2、Ucn3反应条件: 50 ℃ 2 min, 预变性95 ℃ 5 min; 变性94 ℃ 5 s, 退火57 ℃ 30 s, 延伸72 ℃ 30 s, 共40个循环; 终末延伸72 ℃ 7 min. PCR产物通过含gold view的琼脂糖凝胶电泳, 应用GENE GENIUS数码凝胶成像分析系统扫描分析, 通过软件分析吸光度(A)值.
统计学处理 数据以mean±SD表示, 采用SPSS13.0软件进行统计学分析, 经方差齐性检验后, 进行单因素方差分析, 以P<0.05为有统计学显著差异.
给予应激刺激后, 模型组大鼠排便数量明显增加, 其中应激后7、14、21 d时, 慢性应激组和联合应激组与对照组比较差异明显(P<0.05). 在应激28 d时, 急性应激组、联合应激组动物排便显著多于对照组, 统计学差异明显; 慢性应激组仍多于对照组, 但统计学差异不明显.
给予应激刺激后的早期(9 d和18 d), 模型组动物敞箱行为评分(包括水平运动得分和垂直运动得分)比对照组略有降低, 但二者没有统计学差异. 至应激27 d时, 模型组动物敞箱行为评分显著低于对照组(P<0.05). 至应激35 d时, 这种降低的趋势仍然存在.
给予大鼠应激刺激, 可导致其兴趣缺失, 表现为模型组动物蔗糖水偏嗜度降低, 其中造模28 d时, 慢性应激组、联合应激组与对照组相比差异有统计学意义(P<0.05); 造模35 d时给予急性应激后, 急性应激组、联合应激组与对照组相比差异有显著性(P<0.001). 通过检测应激刺激对大鼠排便的影响; 应激对大鼠敞箱行为评分的影响以及应激对大鼠蔗糖水偏嗜度的影响, 均说明肠应激大鼠动物模型建立成功.
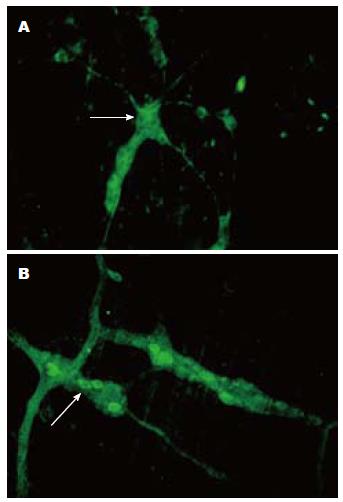
检测Ucn3在大鼠结肠黏膜下神经丛和肌间神经丛神经细胞中的表达, 结果显示Ucn3在黏膜下神经丛和肌间神经丛均有表达(图中箭头所指), 图1.
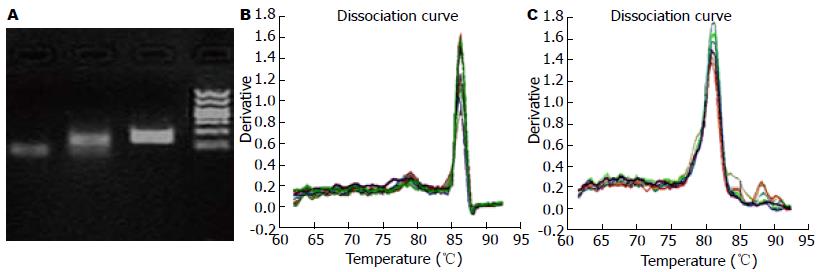
提取RNA后, 1.2%琼脂糖凝胶电泳分离, 在紫外线照射下清楚可见28S及18S的RNA带, 表明RNA无降解及DNA污染. 核酸定量仪测定的A260/A280比值大于1.8, 表明RNA纯度较高. Ucn3、CRFR2、GAPDH的扩增曲线成单峰, 表明扩增的PCR产物单一, 无特异性扩增产物. 显示Ucn3和CRFR2片段扩增情况(图2A), Ucn3预期片段为124 bp, CRFR2预期片段为98 bp. 分别显示Ucn3和CRFR2扩增片段退火曲线(图2B, C), 结果显示PCR产物为预期设计的Ucn3和CRFR2特异片段.
与正常对照组比较, 各应激组模型大鼠结肠中Ucn3以及CRFR2的表达量均有升高(P<0.01).
2.4.1 Ucn3在各组大鼠结肠中的表达: 与正常对照组相比, 急性应激组Ucn3的表达升高至3.59±1.84倍, 慢性应激组Ucn3的表达升高至1.85±0.67倍, 联合应激组Ucn3的表达升高至3.99±1.59倍, 急性应激组和联合应急组动物结肠Ucn3的表达明显高于慢性应急组(图3).
2.4.2 CRFR2在各组大鼠结肠中的表达: 与正常对照组相比, 急性应激组(A)CRFR2的表达升高至2.12倍±0.47倍, 慢性应激组(C)CRFR2的表达升高至1.575倍±0.51倍, 联合应激组(AC)CRFR2的表达升高至2.39倍±0.84倍, 急性应激组和联合应急组动物结肠Ucn3的表达明显高于慢性应急组. 各应激组CRFR2的表达均高于对照组(P<0.05), 但各应激组之间没有统计学差异(图4).
应激行为是指动物在环境突然改变时, 表现出的不良行为反应. 本研究通过给予wistar大鼠急性应激、慢性应激、急慢性联合应激, 观察各组大鼠的排便粒数、敞箱行为和蔗糖水偏嗜度的改变, 发现慢性应激组和慢急性联合应激组大鼠排便粒数减少; 行为动作减少, 敞箱实验评分减低; 兴趣淡漠, 糖水偏嗜度降低, 从而成功建立了IBS大鼠模型.
过去IBS一直被认为是肠动力异常的疾病, 以后进一步的研究证实其具有内脏感觉异常[12,13], 结肠对刺激的敏感性增高, 微弱的刺激在健康人不能引起明显的反应, 却可使IBS患者肠道痉挛性收缩而引起腹痛和排便异常, 降低了患者的生活质量[14]. 研究较多的是肠神经丛和中枢神经在本病发病中的作用[15]. 肠神经丛遍布于黏膜到浆膜的整个肠壁, 通过神经纤维和神经介质与中枢神经系统相联系, 把感觉信息传达到大脑, 使肠道的活动受中枢的调控.
促肾上腺激素释放激素(corticotrophin releasing factor, CRF)是一种重要的神经内分泌肽[16,17], 主要由下丘脑分泌, CRF肽家族包括CRF配体(CRF、Ucn1、Ucn2、Ucn3等)以及CRF受体(CRFR1、CRFR2), 该家族的主要功能是调动机体各系统以应答应激刺激[18], 调节内脏活动和情绪反应[19-21]. Ucn3是CRF家族的一个新成员, 广泛分布在结肠、小肠、骨骼肌、胃、甲状腺、肾上腺、胰、脾、心等组织[22]. 目前有关Ucn3在应激反应中作用的结论不一, 其具体作用机制也不详. Venihaki等[23,24]采用open-field模型和明暗箱模型, 发现侧脑室注射Ucn3后, 大鼠在旷场模型中的探究行为增多, 在明暗箱模型中进入亮室的次数增加, 这均提示Ucn3发挥了抗焦虑的作用. Ohata等[25]发现在熟悉的环境中, 中枢给予Ucn3甚至能够削弱CRF所导致的焦虑样行为. 目前也有实验结果不支持Ucn3抗焦虑作用, Pelleymounter等[26,27]中枢给予小鼠Ucn3 30 min后, 进行EPM的行为学评定, 未发现焦虑样行为有明显变化. 本实验通过real-time PCR试验方法定量检测到Ucn3在IBS大鼠的结肠中表达升高, 并通过免疫荧光定位检测到Ucn3在黏膜神经丛和肌间神经丛的表达. 并发现应激后大鼠结肠中Ucn3表达均升高. 但是急性应激后结肠中Ucn3表达较慢性应激后升高更明显, 两者间有统计学差异, 可能是由脑-肠互动[28-30]发挥作用引起.
CRFR2因其mRNA剪接不同形成CRFR2α、CRFR2β和CRFR2γ 3种亚型. 其中CRFR2α主要分布在中枢[31], 而CRFR2β在外周如骨骼肌及心肌等均有分布. Ucn3对CRFR2具有高亲和性, 因而认为CRFR2是Ucn3的内源配体. 本实验发现给予应激后大鼠结肠中CRFR2表达升高, 但其表达与Ucn3并未形成相关关系. 总之, 通过本次实验我们检测Ucn3及其受体CRFR2在应激后wistar大鼠结肠中表达, 不仅发现了其在各种应激中的表达差异, 还重点观察到了两因子在IBS中的表达变化情况, 这为研究IBS的发病机制提供了新的证据, 并对新型抗焦虑药物的开发提供理论依据.
随着人类对自身疾病谱变化的认识, 功能性胃肠病日渐受到重视, 其中肠易激综合征(IBS)作为功能性肠病的典型代表, 尤其受到关注. 目前IBS的发病原因和机制不明.
李晓波, 教授, 上海交通大学药学院
研究表明, 中枢神经和肠神经丛与IBS发病密切相关, 脑-肠轴上有多种机制单独或共同作用. Urocotin3及其受体是CRF家族的重要成员, 在IBS患者肠道神经的功能和分布尚不清楚.
本研究旨在给予Wistar大鼠急慢性刺激建立IBS动物模型, 检测Ucn3及其受体CRFR2在结肠肠道神经的表达. 研究表明, Ucn3及其受体在肠道神经有表达, 且表达升高. 机制可能是: Ucn3及其受体CRFR2通过表达增加来改变肠道神经的信号通路, 积极调动机体各系统以应答应激刺激, 调节内脏活动和情绪反应, 从而延缓或抑制IBS的发生.
本研究表明Ucn3及其受体在IBS的表达较正常升高, 这为研究IBS的发病机制提供了新的证据以及对新型抗焦虑药物的开发提供理论依据.
本文采用RT-PCR方法探讨Ucn3及其受体CRFR2在IBS大鼠结肠中的表达, 实验设计较合理, 并具有一定的理论价值和实际意义.
编辑: 李军亮 电编:鲁亚静
| 1. | Lewis K, Li C, Perrin MH, Blount A, Kunitake K, Donaldson C, Vaughan J, Reyes TM, Gulyas J, Fischer W. Identification of urocortin III, an additional member of the corticotropin-releasing factor (CRF) family with high affinity for the CRF2 receptor. Proc Natl Acad Sci USA. 2001;98:7570-7575. [PubMed] [DOI] |
| 2. | Hauger RL, Grigoriadis DE, Dallman MF, Plotsky PM, Vale WW, Dautzenberg FM. International Union of Pharmacology. XXXVI. Current status of the nomenclature for receptors for corticotropin-releasing factor and their ligands. Pharmacol Rev. 2003;55:21-26. [PubMed] [DOI] |
| 3. | Nakamura T, Kawabe K, Sapru HN. Cardiovascular responses to microinjections of urocortin 3 into the nucleus tractus solitarius of the rat. Am J Physiol Heart Circ Physiol. 2009;296:H325-H332. [PubMed] [DOI] |
| 4. | Ohata H, Suzuki K, Oki Y, Shibasaki T. Urocortin in the ventromedial hypothalamic nucleus acts as an inhibitor of feeding behavior in rats. Brain Res. 2000;861:1-7. [PubMed] [DOI] |
| 5. | Hsu SY, Hsueh AJ. Human stresscopin and stresscopin-related peptide are selective ligands for the type 2 corticotropin-releasing hormone receptor. Nat Med. 2001;7:605-611. [PubMed] [DOI] |
| 6. | Spiller RC. Treatment of Irritable Bowel Syndrome. Curr Treat Options Gastroenterol. 2003;6:329-337. [PubMed] [DOI] |
| 7. | Liu S, Gao N, Hu HZ, Wang X, Wang GD, Fang X, Gao X, Xia Y, Wood JD. Distribution and chemical coding of corticotropin-releasing factor-immunoreactive neurons in the guinea pig enteric nervous system. J Comp Neurol. 2006;494:63-74. [PubMed] [DOI] |
| 8. | Williams CL, Villar RG, Peterson JM, Burks TF. Stress-induced changes in intestinal transit in the rat: a model for irritable bowel syndrome. Gastroenterology. 1988;94:611-621. [PubMed] |
| 9. | 郭 玉婷, 李 延青, 庄 明蕊, 欧阳 建东, 夏 培君, 左 秀丽, 张 海燕, 匡 荣光, 袁 海鹏. 替加色罗治疗内脏高敏感大鼠前后感觉阈值的变化. 胃肠病学和肝病学杂志. 2004;13:337-380. |
| 10. | Fang X, Liu S, Wang XY, Gao N, Hu HZ, Wang GD, Cook CH, Needleman BJ, Mikami DJ, Xia Y. Neurogastroenterology of tegaserod (HTF 919) in the submucosal division of the guinea-pig and human enteric nervous system. Neurogastroenterol Motil. 2008;20:80-93. [PubMed] |
| 11. | Benelli A, Filaferro M, Bertolini A, Genedani S. Influence of S-adenosyl-L-methionine on chronic mild stress-induced anhedonia in castrated rats. Br J Pharmacol. 1999;127:645-654. [PubMed] [DOI] |
| 12. | La JH, Sung TS, Kim HJ, Kim TW, Kang TM, Yang IS. Peripheral corticotropin releasing hormone mediates post-inflammatory visceral hypersensitivity in rats. World J Gastroenterol. 2008;14:731-736. [PubMed] [DOI] |
| 13. | Harris ML, Aziz Q. Brain-gut interaction in irritable bowel syndrome. Hosp Med. 2003;64:264-269. [PubMed] |
| 15. | Kiba T. Relationships between the autonomic nervous system, humoral factors and immune functions in the intestine. Digestion. 2006;74:215-227. [PubMed] |
| 16. | Caso JR, Leza JC, Menchén L. The effects of physical and psychological stress on the gastro-intestinal tract: lessons from animal models. Curr Mol Med. 2008;8:299-312. [PubMed] [DOI] |
| 17. | Taché Y, Bonaz B. Corticotropin-releasing factor receptors and stress-related alterations of gut motor function. J Clin Invest. 2007;117:33-40. [PubMed] [DOI] |
| 18. | Stengel A, Taché Y. Neuroendocrine control of the gut during stress: corticotropin-releasing factor signaling pathways in the spotlight. Annu Rev Physiol. 2009;71:219-239. [PubMed] [DOI] |
| 19. | Taché Y, Perdue MH. Role of peripheral CRF signalling pathways in stress-related alterations of gut motility and mucosal function. Neurogastroenterol Motil. 2004;16 Suppl 1:137-142. [PubMed] [DOI] |
| 20. | Chatzaki E, Murphy BJ, Wang L, Million M, Ohning GV, Crowe PD, Petroski R, Taché Y, Grigoriadis DE. Differential profile of CRF receptor distribution in the rat stomach and duodenum assessed by newly developed CRF receptor antibodies. J Neurochem. 2004;88:1-11. [PubMed] [DOI] |
| 21. | Fukudo S. Role of corticotropin-releasing hormone in irritable bowel syndrome and intestinal inflammation. J Gastroenterol. 2007;42 Suppl 17:48-51. [PubMed] [DOI] |
| 22. | Baigent SM, Lowry PJ. mRNA expression profiles for corticotrophin-releasing factor (CRF), urocortin, CRF receptors and CRF-binding protein in peripheral rat tissues. J Mol Endocrinol. 2000;25:43-52. [PubMed] [DOI] |
| 23. | Fekete EM, Inoue K, Zhao Y, Rivier JE, Vale WW, Szücs A, Koob GF, Zorrilla EP. Delayed satiety-like actions and altered feeding microstructure by a selective type 2 corticotropin-releasing factor agonist in rats: intra-hypothalamic urocortin 3 administration reduces food intake by prolonging the post-meal interval. Neuropsychopharmacology. 2007;32:1052-1068. [PubMed] [DOI] |
| 24. | Venihaki M, Sakihara S, Subramanian S, Dikkes P, Weninger SC, Liapakis G, Graf T, Majzoub JA. Urocortin III, a brain neuropeptide of the corticotropin-releasing hormone family: modulation by stress and attenuation of some anxiety-like behaviours. J Neuroendocrinol. 2004;16:411-422. [PubMed] [DOI] |
| 25. | Ohata H, Shibasaki T. Effects of urocortin 2 and 3 on motor activity and food intake in rats. Peptides. 2004;25:1703-1709. [PubMed] [DOI] |
| 26. | Pelleymounter MA, Joppa M, Carmouche M, Cullen MJ, Brown B, Murphy B, Grigoriadis DE, Ling N, Foster AC. Role of corticotropin-releasing factor (CRF) receptors in the anorexic syndrome induced by CRF. J Pharmacol Exp Ther. 2000;293:799-806. [PubMed] |
| 27. | Pelleymounter MA, Joppa M, Ling N, Foster AC. Behavioral and neuroendocrine effects of the selective CRF2 receptor agonists urocortin II and urocortin III. Peptides. 2004;25:659-666. [PubMed] [DOI] |
| 28. | Liu S, Hu HZ, Gao N, Gao C, Wang G, Wang X, Peck OC, Kim G, Gao X, Xia Y. Neuroimmune interactions in guinea pig stomach and small intestine. Am J Physiol Gastrointest Liver Physiol. 2003;284:G154-G164. [PubMed] |
| 30. | Liu S, Ren W, Qu MH, Bishop GA, Wang GD, Wang XY, Xia Y, Wood JD. Differential actions of urocortins on neurons of the myenteric division of the enteric nervous system in guinea pig distal colon. Br J Pharmacol. 2010;159:222-236. [PubMed] [DOI] |
| 31. | Chen A, Perrin M, Brar B, Li C, Jamieson P, Digruccio M, Lewis K, Vale W. Mouse corticotropin-releasing factor receptor type 2alpha gene: isolation, distribution, pharmacological characterization and regulation by stress and glucocorticoids. Mol Endocrinol. 2005;19:441-458. [PubMed] [DOI] |