修回日期: 2012-02-20
接受日期: 2012-03-20
在线出版日期: 2012-04-28
目的: 探讨高糖对大鼠结肠平滑肌细胞(SMCs)表达内源性胰岛素样生长因子1(IGF-1)的影响.
方法: 酶解法分离培养SD大鼠结肠SMCs, α-actin免疫荧光鉴定, 然后将大鼠结肠SMCs随机给予葡萄糖不同浓度(5.5 mmol/L和25 mmol/L)组及甘露醇对照组(5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇)刺激, CCK8实验检测SMCs增殖情况; 流式细胞术检测SMCs细胞周期; ELISA检测培养液上清中IGF-1的含量; Western blot、Real-time PCR法检测SMCs合成内源性IGF-1的表达变化.
结果: 高糖(25 mmol/L)抑制大鼠结肠SMCs的增殖, 在24 h与正常糖浓度间差异最大(0.494±0.003 vs 0.597±0.044, P<0.05); 高糖使约90%的结肠SMCs停滞在G1期(90.850%±0.706% vs 55.202%±3.807%, P<0.05), 进入S期的SMCs明显减少(3.622%±0.156% vs 30.780%±3.808%, P<0.05); 高糖环境中, 结肠SMCs合成分泌的IGF-1减少(208.000 ng/L±31.443 ng/L vs 265.750 ng/L±26.538 ng/L, P<0.05), SMCs表达内源性的IGF-1 mRNA和蛋白也均减少(2.037±0.196 vs 2.257±0.273; 0.247±0.045 vs 0.906±0.103, P<0.05).
结论: 高糖抑制大鼠结肠SMCs增殖, 使SMCs内源性IGF-1表达减少.
引文著录: 徐新寓, 王云, 杨微微, 林琳. 高糖对大鼠结肠平滑肌细胞表达内源性胰岛素样生长因子1的影响. 世界华人消化杂志 2012; 20(12): 998-1003
Revised: February 20, 2012
Accepted: March 20, 2012
Published online: April 28, 2012
AIM: To investigate the effect of high glucose on the expression of endogenous insulin-like growth factor-1 (IGF-1) in rat colonic smooth muscle cells (SMCs).
METHODS: Rat colonic SMCs were separated, cultured, identified by immunofluorescence staining of α-actin, and divided into three groups: normal glucose group (5.5 mmol/L glucose), mannitol control group (5.5 mmol/L glucose plus 19.5 mmol/L mannitol) and high glucose group (25 mmol/L glucose). After treatment, cell proliferation was determined using Cell Counting Kit-8, and cell cycle analysis was performed by flow cytometry. ELISA was designed to measure the content of IGF-I in SMCs culture supernatants. Real-time quantitative-PCR and Western blotting were performed to analyze the mRNA and protein expression of IGF-1 in SMCs.
RESULTS: Compared to the normal glucose group, treatment with high glucose significantly inhibited the proliferation of rat colonic SMCs (0.494 ± 0.0030 vs 0.597 ± 0.044, P < 0.05), resulted in cell accumulation in the G1 phase (90.850% ± 0.706% vs 55.202% ± 3.807%, P < 0.05) and a significant decrease in the percentage of cells in the S phase (3.622% ± 0.156% vs 30.780% ± 3.808%, P < 0.05), and decreased the content of IGF-I in SMCs culture supernatants (208.000 ng/L ± 31.443 ng/L vs 265.750 ng/L ± 26.538 ng/L, P < 0.05) and the expression of IGF-I mRNA and protein (2.037 ± 0.196 vs 2.257 ± 0.273; 0.247 ± 0.045 vs 0.906 ± 0.103, both P < 0.05). However, there were no significant differences in the above parameters between the normal glucose group and mannitol control group.
CONCLUSION: High glucose inhibits the proliferation of rat colonic SMCs and decreases the expression of endogenous IGF-1 in SMCs.
- Citation: Xu XY, Wang Y, Yang WW, Lin L. High glucose down-regulates the expression of endogenous insulin-like growth factor-1 in rat colonic smooth muscle cells. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 998-1003
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/998.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.998
糖尿病胃肠动力障碍是糖尿病(diabetes mellitus, DM)的慢性并发症之一, 发生于30%-50%的糖尿病患者[1,2]. DM胃肠动力障碍不仅使患者出现诸多胃肠症状, 且使患者血糖更加难以控制, 严重影响患者生存质量, 并带来沉重的经济负担[3,4]. 目前有学者认为DM胃肠动力障碍是一种胃肠道神经肌肉的营养障碍, 而非单纯的"功能性"障碍. 其发病与胃肠自主神经、Cajal间质细胞(interstitial cells of Cajal, ICC)及平滑肌细胞(smooth muscle cells, SMCs)病变有关, 而营养因子缺乏在细胞损伤中亦有不可或缺的作用[5,6]. 胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)是胃肠道SMCs生长、增殖、分化的重要营养因子, 对胃肠道起搏细胞ICC亦具有保护作用. 有研究证实该病与胃肠道IGF-1信号的缺乏密切相关[6-8]. 本文旨在探讨高糖是否影响结肠SMCs表达内源性的IGF-1, 为进一步探讨糖尿病胃肠动力障碍的相关机制提供依据.
SD大鼠, 雌雄不拘, 体质量150-200 g, 由南京医科大学医学实验动物中心提供. 低糖/高糖DMEM培养液(Gibco, USA)、甘露醇(Amresco)、胎牛血清(Gibco, USA)、Ⅱ型胶原酶(Sigma)、大豆胰蛋白酶抑制剂(Gibco, USA)、青链霉素混悬液(Gibco, USA)、α-actin抗体(北京博奥森), Cell Counting Kit-8(CCK-8试剂盒, 碧云天)、PI/RNase Staining Buffer(BD Pharmingen, USA)、IGF-1抗体(ab36532; Abcam, Cambridge, MA)、Quantikine Mouse/Rat IGF-I Immunoassay(R&D, UK).
IGF-1引物由Invitrogen公司合成, 序列参照文献[9,10].
1.2.1 结肠SMCs的分离和培养[11-13]: SD大鼠以10%水合氯醛腹腔麻醉后, 快速自肛门上2 cm取结肠10 cm左右, 用含抗生素的Hepes-Ringer缓冲液反复冲洗, 去除黏膜层和浆膜层. 将平滑肌组织剪碎, 置入消化液(0.1%的Ⅱ型胶原酶和0.01%的大豆胰蛋白酶抑制剂)中消化、离心, DMEM培养液重悬细胞, 过筛; 于950 mL/L O2和50 mL/L CO2, 37 ℃孵育箱中培养, SMCs长至致密单层时, 传代培养. 采用第2代SMCs进行实验.
1.2.2 结肠SMCs的鉴定[11-13]: 取对数生长期的SMCs, 胰蛋白酶消化, 制成单细胞悬液; 将SMCs接种到放置载玻片的培养皿中, 置CO2孵箱中培养1-3 d待SMCs长至单层时, 取出载玻片. PBS冲洗、丙酮固定, 3% H2O2阻断内源性过氧化物酶; 滴加α-actin一抗(1∶100), 4 ℃过夜, PBS冲洗, 滴加罗丹明标记的羊抗兔IgG二抗, 室温避光湿盒中孵育1 h, PBS冲洗, 滴加Hoechst染核, PBS冲洗、封片, 观察特异性荧光.
1.2.3 分组与处理: 将2.5×108/L的SMCs接种于含100 mL/L胎牛血清的DMEM培养液中培养至70%融和后, PBS洗涤, 加入含2.5 mL/L胎牛血清的培养基饥饿24 h. 分别给予正常糖浓度组(5.5 mmol/L葡萄糖)、甘露醇高渗对照组(5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇)和高糖浓度组(25 mmol/L)的培养液刺激.
1.2.4 CCK8实验检测细胞增殖情况: 收集对数期细胞, 调整细胞悬液浓度为5 000个细胞/100 μL, 接种于96孔板, 入CO2孵育箱培养过夜后显微镜下观察细胞单层铺盖满孔的60%, 给予含2.5 mL/L胎牛血清的培养液饥饿24 h, 给予3种不同的培养液刺激, 收集不同时间点的细胞; 每孔加入10 μL的CCK8溶液, 在培养箱内继续孵育1 h, 450 nm测定吸光度(A)值.
1.2.5 流式细胞术检测细胞周期: 将3组不同培养液处理的SMCs培养24 h, 胰酶消化收集细胞, 冰PBS洗2遍, 弃上清, 加入1 mL 70%预冷乙醇中, 吹打均匀, 4 ℃固定过夜; 固定好的细胞离心, 弃上清, PBS洗2遍; 1 mL PBS重悬细胞后过滤, 离心弃上清后, 加入PI/RNase至终浓度50 g/L, 避光染色至少30 min, 上机检测.
1.2.6 ELISA法检测培养液上清中IGF-1的浓度: 收集不同组细胞培养液, 离心取上清, 加1∶2稀释的待检样品100 μL于上述已包被的反应孔中, 室温孵育2 h(同时做空白孔和标准孔); 洗涤5次后每孔加酶标抗体100 μL, 室温孵育2 h; 洗涤5次后每孔加底物显色液100 μL, 室温避光显色30 min; 每孔加入100 μL的终止液终止反应, 在450 nm波长下读板.
1.2.7 Real-time PCR检测IGF-1 mRNA表达: 按TRIzol试剂提取各组细胞的总mRNA, 以cDNA为模板进行PCR扩增. PCR的反应条件: 95 ℃预变性30 s; 95 ℃退火5 s, 60 ℃延伸30 s, 共循环40次. IGF-1上游引物: 5'-GGCATTGTGGATGAGTGTTG-3'; 下游引物: 5'-GTCTTGGGCATGTCAGTGTG-3'. 18 S RNA上游引物: 5'-GGCATCGTTTATGGTCGGAAC-3'; 下游引物: 5'-GCGAAAGCATTTGCCAAGAA-3'.
1.2.8 Western blot法检测IGF-1蛋白表达: 蛋白裂解液提取各组细胞蛋白, BCA法测定蛋白浓度. 120 μg蛋白/泳道加样, 恒流30 mA电泳, 恒压100 V转膜45 min, 封闭2 h. 加入IGF-1一抗(1∶100), 4 ℃过夜; 二抗(1∶10 000), 37 ℃孵育, 曝光、显影.
统计学处理 所有数据录入SPSS13.0软件包分析, 以mean±SD表示, 采用成组t检验, P<0.05为有显著性差异.
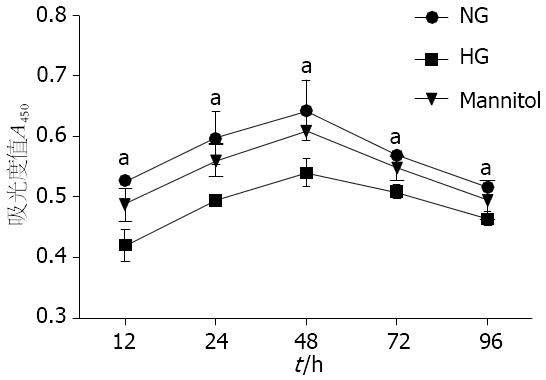
与正常糖浓度组相比, 从12 h起高糖(25 mmol/L)在各时间点(24、48、72、96 h)均可抑制大鼠结肠SMCs的增殖, 差异有统计学意义(0.420±0.025 vs 0.527±0.069; 0.494±0.003 vs 0.597±0.044; 0.540±0.024 vs 0.634±0.049; 0.509±0.118 vs 0.568±0.008; 0.463±0.109 vs 0.516±0.008, P<0.05), 在24 h两者间差异最为显著; 因此选用不同浓度葡萄糖培养第24小时的SMCs进行后续试验. 甘露醇对照组与正常糖浓度组比, 结肠SMCs增殖无差异(P>0.05, 图1).
与正常糖浓度组相比, 高糖(25 mmol/L)使约90%的SMCs停滞在G1期(90.850%±0.706% vs 55.202%±3.807%, P<0.05), S期细胞明显减少(3.622%±0.156% vs 30.780%±3.808%, P<0.05), 提示高糖抑制SMCs进入S期; 而甘露醇对照组与正常糖浓度组比, 结肠SMCs的细胞周期变化无差异(P>0.05, 表1).
| 分组 | G0/1 | S | G2/M |
| 正常糖浓度组 | 55.202±3.807 | 30.780±3.808 | 13.918±1.112 |
| 甘露醇对照组 | 53.232±4.110 | 26.753±5.541 | 12.837±0.849 |
| 高糖浓度组 | 90.850±0.706a | 3.622±0.156a | 5.530±0.597a |
与正常糖浓度组相比, 高糖(25 mmol/L)环境下, SMCs合成分泌IGF-1明显减少(208.000 ng/L±31.443 ng/L vs 265.750 ng/L±26.538 ng/L, P<0.05), 而甘露醇对照组与正常糖浓度组比, SMCs合成分泌的IGF-1无差异(247.000 ng/L±36.833 ng/L vs 265.750 ng/L±26.538 ng/L, P>0.05, 表2).
| 分组 | IGF-1浓度(ng/L) |
| 正常糖浓度组 | 265.750±26.538 |
| 甘露醇对照组 | 247.000±36.833 |
| 高糖浓度组 | 208.000±31.443a |
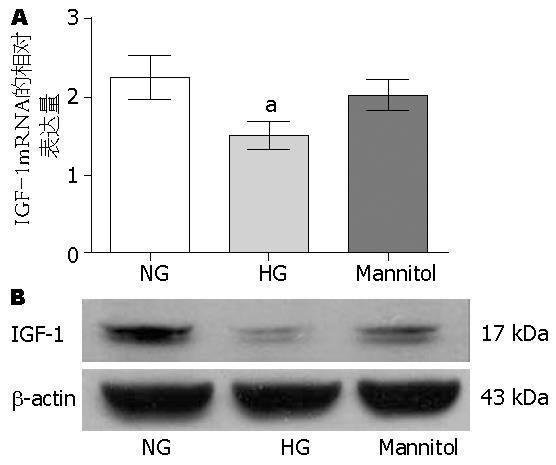
高糖(25 mmol/L)可抑制内源性IGF-1 mRNA的表达(2.037±0.196 vs 2.257±0.273, P<0.05); 而甘露醇对照组与正常糖浓度组比, SMCs表达内源性IGF-1mRNA无差异(P>0.05, 图2A).
Western blot结果与Real-time PCR结果一致, 即高糖(25 mmol/L)抑制内源性IGF-1蛋白的表达(0.247±0.045 vs 0.906±0.103, P<0.05); 而甘露醇对照组与正常糖浓度组比, SMCs表达内源性IGF-1蛋白无差异(P>0.05, 图2B).
DM胃肠动力障碍临床上主要表现为胃肠排空延迟[14-16]. 有研究报道: 在病程长、血糖控制差的糖尿病患者[17,18]及某些糖尿病动物模型[8,19]的胃组织标本中发现平滑肌萎缩、纤维增生, SMCs超微结构破坏, 出现凋亡甚至坏死的现象. 然而在链脲霉素(streptozotocin, STZ)诱导的糖尿病大鼠[20,21]和NOD小鼠[22]中均发现有结肠SMCs肥大的现象. 是由于长期高糖作用, 还是其他因素导致胃肠平滑肌病变尚不明确. 因此, 本文探讨了高糖对体外培养大鼠结肠SMCs的直接作用. 本实验证实高糖可减少SMCs的DNA复制, 抑制结肠SMCs的增殖. 高糖是否促进大鼠结肠SMCs的凋亡, 尚需进一步研究.
IGF-1是体内重要的生长因子, 可在机体的多数组织中表达, 通过内分泌、旁分泌、自分泌的途径发挥生物学作用[23]. 在胃肠道, IGF-1可刺激肠上皮细胞、成纤维细胞、胃肠SMCs增殖, 且相比于血循环中的IGF-1, 由胃肠局部合成分泌的内源性IGF-1可能对肠道SMCs生长、分化及胃肠起搏细胞ICC体积的维持发挥更重要的作用[24,25], 因为: (1)转基因小鼠模型中, 肠道局部过表达的IGF-1能促进小肠SMCs增生[26,27]; (2)特异性敲除肝源性IGF-1的小鼠, 肠道局部IGF-1仍可刺激SMCs生长发育[28]; (3)内源性IGF-1可促进体外培养的人肠道SMCs增殖, 抑制其凋亡[24,29]; (4)在血糖正常的小鼠, 发现使其胃肠道局部IGF-1的合成减少可使胃肠起搏细胞ICC的体积明显下降[6]. 本实验证实高糖使大鼠结肠SMCs内源性的IGF-1 mRNA表达减少, 且合成分泌的IGF-1蛋白亦减少. 我们推测: 糖尿病时, 可能由于高糖抑制胃肠道SMCs合成内源性IGF-1, 因而SMCs增殖受抑制.
在胃肠道中, ICC、肠神经元和SMCs构成"功能元件", 共同调节胃肠道的生理功能[30,31]. ICC作为胃肠道的起搏细胞, 对胃肠道的动力调节起主导作用[32]. 而维持ICC成熟表型所需的干细胞生长因子(stem cell factor, SCF)主要来自SMCs. Horváth等[7,8]在DM胃轻瘫小鼠的研究中发现: DM时IGF-1信号减弱, 导致SMCs萎缩, SCF表达减低, 从而使ICC数量缺失及功能障碍, 使小鼠出现胃轻瘫症状. 我们的前期实验亦证实: 体外培养大鼠胃窦、结肠SMCs, 给予外源性IGF-1, 可促进SMCs增殖和SCF表达[33,34]. 因此IGF-1可能通过促进胃肠SMCs生长、抑制其凋亡、诱导其表达SCF而对ICC起保护作用, 因此在糖尿病胃肠动力障碍中, 高糖可能作为上游影响因子, 抑制SMCs合成分泌IGF-1, 进而导致SCF表达减少、ICC功能及网络结构受损.
总之, 本实验初步证实了高糖可抑制结肠SMCs增殖, 减少结肠SMCs表达内源性的IGF-1, 为进一步探讨DM胃肠动力障碍相关机制提供了新的依据, 也为DM胃肠动力障碍的治疗拓展了新的思路. 但是高糖是否通过影响结肠SMCs内源性IGF-1的表达, 进一步影响SMCs内SCF的合成, 从而导致ICC的受损; 以及高糖是如何影响结肠SMCs内源性IGF-1的表达, 是否与IGF-1相关信号通路有关, 有待进一步研究.
糖尿病胃肠动力障碍与胃肠自主神经、Cajal间质细胞及平滑肌细胞病变相关, 胰岛素样生长因子-1(IGF-1)可促进平滑肌细胞分化、增殖, 并保护Cajal间质细胞, 该因子缺乏是本疾病病理基础之一.
洪天配, 教授, 北京大学第三医院内分泌科
糖尿病胃肠动力障碍时可发生平滑肌萎缩、纤维化, 但平滑肌细胞病变在糖尿病胃肠动力障碍机制中的作用仍不清楚.
Kuemmerle等学者发现胃肠平滑肌合成内源性IGF-1; Horvath等发现IGF-1促进胃肠平滑肌细胞合成干细胞因子(SCF), 以保护胃肠起搏细胞ICC.
本研究提示高糖影响大鼠结肠平滑肌细胞合成内源性IGF-1, 可能是糖尿病时胃肠局部营养因子缺乏的原因之一, 为临床治疗糖尿病胃肠动力障碍提供治疗靶点.
本研究论点新颖, 为探索糖尿病胃肠动力障碍、平滑肌病变提供了新思路.
编辑: 张姗姗 电编: 闫晋利
| 1. | Icks A, Haastert B, Rathmann W, Wareham N. Prevalence of gastrointestinal symptoms in patients with type 2 diabetes: a population-based study. Arch Intern Med. 2002;162:1067-109; author reply 1069. [PubMed] [DOI] |
| 2. | Wang YR, Fisher RS, Parkman HP. Gastroparesis-related hospitalizations in the United States: trends, characteristics, and outcomes, 1995-2004. Am J Gastroenterol. 2008;103:313-322. [PubMed] [DOI] |
| 3. | Gautam A, Baluch A, Kaye AD, Frost EA. Modern strategies for the anesthetic management of the patient with diabetes. Middle East J Anaesthesiol. 2009;20:187-197. [PubMed] |
| 4. | Simmons RK, Unwin N, Griffin SJ. International Diabetes Federation: An update of the evidence concerning the prevention of type 2 diabetes. Diabetes Res Clin Pract. 2010;87:143-149. [PubMed] [DOI] |
| 5. | Vittal H, Farrugia G, Gomez G, Pasricha PJ. Mechanisms of disease: the pathological basis of gastroparesis--a review of experimental and clinical studies. Nat Clin Pract Gastroenterol Hepatol. 2007;4:336-346. [PubMed] [DOI] |
| 6. | Ordög T, Hayashi Y, Gibbons SJ. Cellular pathogenesis of diabetic gastroenteropathy. Minerva Gastroenterol Dietol. 2009;55:315-343. [PubMed] |
| 7. | Horváth VJ, Vittal H, Ordög T. Reduced insulin and IGF-I signaling, not hyperglycemia, underlies the diabetes-associated depletion of interstitial cells of Cajal in the murine stomach. Diabetes. 2005;54:1528-1533. [PubMed] [DOI] |
| 8. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 9. | Hamzeh M, Robaire B. Identification of early response genes and pathway activated by androgens in the initial segment and caput regions of the regressed rat epididymis. Endocrinology. 2010;151:4504-4514. [PubMed] [DOI] |
| 10. | Shynlova O, Tsui P, Dorogin A, Langille BL, Lye SJ. Insulin-like growth factors and their binding proteins define specific phases of myometrial differentiation during pregnancy in the rat. Biol Reprod. 2007;76:571-578. [PubMed] [DOI] |
| 14. | Tang DM, Friedenberg FK. Gastroparesis: approach, diagnostic evaluation, and management. Dis Mon. 2011;57:74-101. [PubMed] [DOI] |
| 15. | Parkman HP, Hasler WL, Fisher RS. American Gastroenterological Association technical review on the diagnosis and treatment of gastroparesis. Gastroenterology. 2004;127:1592-1622. [PubMed] [DOI] |
| 16. | Friedenberg FK, Parkman HP. Advances in the management of gastroparesis. Curr Treat Options Gastroenterol. 2007;10:283-293. [PubMed] [DOI] |
| 17. | Pasricha PJ, Pehlivanov ND, Gomez G, Vittal H, Lurken MS, Farrugia G. Changes in the gastric enteric nervous system and muscle: a case report on two patients with diabetic gastroparesis. BMC Gastroenterol. 2008;8:21. [PubMed] [DOI] |
| 18. | Moscoso GJ, Driver M, Guy RJ. A form of necrobiosis and atrophy of smooth muscle in diabetic gastric autonomic neuropathy. Pathol Res Pract. 1986;181:188-194. [PubMed] [DOI] |
| 19. | Diani AR, Gerritsen GC, Stromsta S, Murray P. A study of the morphological changes in the small intestine of the spontaneously diabetic Chinese hamster. Diabetologia. 1976;12:101-109. [PubMed] [DOI] |
| 20. | Forrest A, Parsons M. The enhanced spontaneous activity of the diabetic colon is not the consequence of impaired inhibitory control mechanisms. Auton Autacoid Pharmacol. 2003;23:149-158. [PubMed] [DOI] |
| 21. | Forrest A, Huizinga JD, Wang XY, Liu LW, Parsons M. Increase in stretch-induced rhythmic motor activity in the diabetic rat colon is associated with loss of ICC of the submuscular plexus. Am J Physiol Gastrointest Liver Physiol. 2008;294:G315-G326. [PubMed] [DOI] |
| 22. | Ordog T, Irwin N, Takayama I, Ward SM, Sanders KM. Depletion of interstitial cells of Cajal and electrical abnormalities in a murine model of diabetic colon dysfunction. Neurogastroenterol Motil. 2004;664. |
| 23. | Ohlsson C, Mohan S, Sjögren K, Tivesten A, Isgaard J, Isaksson O, Jansson JO, Svensson J. The role of liver-derived insulin-like growth factor-I. Endocr Rev. 2009;30:494-535. [PubMed] [DOI] |
| 24. | Kuemmerle JF. Endogenous IGF-I protects human intestinal smooth muscle cells from apoptosis by regulation of GSK-3 beta activity. Am J Physiol Gastrointest Liver Physiol. 2005;288:G101-G110. [PubMed] [DOI] |
| 25. | Flynn RS, Murthy KS, Grider JR, Kellum JM, Kuemmerle JF. Endogenous IGF-I and alphaVbeta3 integrin ligands regulate increased smooth muscle hyperplasia in stricturing Crohn's disease. Gastroenterology. 2010;138:285-293. [PubMed] [DOI] |
| 26. | Wang J, Niu W, Nikiforov Y, Naito S, Chernausek S, Witte D, LeRoith D, Strauch A, Fagin JA. Targeted overexpression of IGF-I evokes distinct patterns of organ remodeling in smooth muscle cell tissue beds of transgenic mice. J Clin Invest. 1997;100:1425-1439. [PubMed] [DOI] |
| 27. | Ohneda K, Ulshen MH, Fuller CR, D'Ercole AJ, Lund PK. Enhanced growth of small bowel in transgenic mice expressing human insulin-like growth factor I. Gastroenterology. 1997;112:444-454. [PubMed] [DOI] |
| 28. | Sjögren K, Liu JL, Blad K, Skrtic S, Vidal O, Wallenius V, LeRoith D, Törnell J, Isaksson OG, Jansson JO. Liver-derived insulin-like growth factor I (IGF-I) is the principal source of IGF-I in blood but is not required for postnatal body growth in mice. Proc Natl Acad Sci USA. 1999;96:7088-7092. [PubMed] [DOI] |
| 29. | Kuemmerle JF. Autocrine regulation of growth in cultured human intestinal muscle by growth factors. Gastroenterology. 1997;113:817-824. [PubMed] [DOI] |
| 30. | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine. Am J Physiol Cell Physiol. 2005;288:C710-C720. [PubMed] [DOI] |
| 31. | Wang XY, Sanders KM, Ward SM. Intimate relationship between interstitial cells of cajal and enteric nerves in the guinea-pig small intestine. Cell Tissue Res. 1999;295:247-256. [PubMed] [DOI] |
| 32. | Sanders KM, Koh SD, Ward SM. Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annu Rev Physiol. 2006;68:307-343. [PubMed] [DOI] |