修回日期: 2012-03-15
接受日期: 2012-03-25
在线出版日期: 2012-04-28
目的: 探讨IL-17细胞因子在TNBS诱导的炎性肠病动物模型中的表达变化, 明确IL-17和脂多糖(LPS)在诱导HT-29肠上皮细胞IL-8表达中的协同作用及细胞内信号机制.
方法: 探讨IL-17及其受体在TNBS炎性肠病模型中的表达变化, 利用细胞培养、FASC、Real-time PCR、酶联免疫吸附(ELISA)、Western blot等技术, 观察IL-17及不同剂量LPS干预人肠上皮细胞(HT-29细胞)后细胞因子IL-8在蛋白水平的表达, 以及IL-17受体(IL-17Ra)在mRNA水平的表达变化及引起上述效应的细胞内信号传导机制.
结果: TNBS诱导的炎性肠病动物模型中IL-17以及IL-17Ra显著升高(P<0.03); 炎症介质IL-17能与一定浓度范围内的LPS协同促进IL-8的表达(2187.61±132.42 vs 2634.27±134.63, P = 0.01), 增强NF-κB信号通路的活化, 促进炎症反应. 但随着LPS剂量升高, LPS本身诱导IL-8表达的活性降低, 且与IL-17的协同作用消失(1841.43±50.38 vs 1685.67±71.47, P = 0.03).
结论: IL-17与低浓度的LPS可协同促进HT-29细胞炎症介质的表达, 但与高浓度LPS联合时, 两者无协同效应.
引文著录: 林艳华, 周平, 马培娥, 郭小芹, 夏廷毅, 沈倍奋, 黎燕, 韩根成. IL-17在炎性肠病中的表达及其与LPS协同诱导肠上皮细胞表达IL-8的作用机制. 世界华人消化杂志 2012; 20(12): 991-997
Revised: March 15, 2012
Accepted: March 25, 2012
Published online: April 28, 2012
AIM: To investigate the expression of interleukin-17 (IL-17) in inflammatory bowel disease (IBD) in a mouse model and to examine the synergistic reaction of IL-17 and lipopolysaccharide (LPS) on interleukin-8 (IL-8) expression in intestinal epithelial cells (HT-29 cells).
METHODS: A mouse model of inflammatory bowel disease was induced with TNBS to detect the expression of IL-17 and its receptor IL-17Ra in IBD. HT-29 cells were treated with IL-17 and/or different concentrations of LPS to examine their synergistic action on the expression of IL-8 mRNA and protein by FACS, real-time PCR, ELISA, and Western blot.
RESULTS: The expression of IL-17 and IL-17Ra in IBD was significantly increased (both P < 0.05). IL-17 and low doses of LPS showed a synergistic action on IL-8 expression in HT-29 cells (2187.61 ± 132.42 vs 2634.27 ± 134.63, P = 0.01) by activating NF-κB and promoting inflammation. However, high doses of LPS reduced the levels of IL-8, and their synergistic action with IL-17 disappeared (1841.43 ± 50.38 vs 1685.67 ± 71.47, P = 0.03).
CONCLUSION: IL-17 has a synergistic action with low, but not high doses of LPS on the expression of inflammatory mediators in HT-29 cells.
- Citation: Lin YH, Zhou P, Ma PE, Guo XQ, Xia TY, Shen BF, Li Y, Han GC. Expression of IL-17 in inflammatory bowel disease and synergistic action of IL-17 and LPS on IL-8 expression in intestinal epithelial cells. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 991-997
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/991.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.991
炎症性肠病(inflammatory bowel disease, IBD)是一种肠道慢性非特异性疾病, 目前对其发病机制较一致的观点是遗传易感人群在环境危险因素及细菌感染等作用下, 肠道免疫系统失调, 募集炎症细胞释放炎性介质, 造成组织损伤和功能障碍. Th17细胞是近几年研究自身免疫性疾病的一大热点, 其是一群以分泌白介素17(interleukin-17, IL-17)为特征的CD4+ T细胞亚群, 具有促进免疫反应的效应, 在以慢性炎症为损伤机制的自身免疫疾病中具有重要作用. 近年来, 越来越多研究焦点落在Th17细胞及其细胞因子IL-17在自身免疫性炎性肠病发病机制中所起的作用上[1-9], 有望成为炎性肠病治疗的新靶点, 但其具体的免疫机制尚不十分清楚. 此外, 肠上皮细胞可表达特异的Toll样受体-4(toll like receptor 4, TLR-4), 而TLR-4又特异性识别脂多糖(lipopolysaccharides, LPS), LPS/TLR4通路在诱导炎症细胞因子的表达, 增强局部炎症反应方面发挥重要作用[10]. 为深入认识炎性肠病的作用机制, 本研究在证实IL-17/IL-17Ra通路在TNBS-IBD模型中活性增强的基础上, 以人肠上皮细胞系(HT-29细胞)为模型, 探讨IL-17/IL-17Ra通路与LPS/TLR4通路间可能的相互作用及机制.
BALB/c小鼠购自军事医学科学院动物中心; HT-29细胞购自ATCC; TNBS、嗜热菌蛋白酶为美国Sigma公司生产; LPS为美国Sigma公司生产; RPMI-1640、BCA蛋白定量试剂盒购自Thermo公司; 澳洲胎牛血清为Biowhittaker公司产品; IL-8 ELISA试剂盒、hIL-17a、IL-17Ra/PE、TLR-4/PE抗体为eBioscience公司产品; 脱脂奶粉为伊利高蛋白脱脂高钙奶粉; BSA(牛血清白蛋白v)购自Sigma公司; P65、P-P65、AKT、PAKT、IκB一抗均购自CST公司; GAPDH一抗购自Calibio; 人抗兔二抗、人抗鼠二抗购自KPL公司; PCR仪、实时定量PCR仪购自Bio-Rad公司; 酶标仪购自Thermo公司.
1.2.1 HT-29细胞培养: 人结肠癌细胞(HT-29细胞)用含100 mL/L胎牛血清RPMI-1640培养基培养, 于37 ℃、50 mL/L CO2细胞孵箱中传代培养.
1.2.2 IBD动物模型的建立及肠上皮细胞中IL-17/IL-17Ra的表达分析: IBD动物模型的建立按我们已经发表的文献进行[11], 主要包括BALB/c小鼠, 实验组: 2.5 mg TNBS/只(n = 21), 150 μL/只灌肠; 对照组: 等体积50%乙醇/只(n = 23), 观察小鼠体质量、粪便及精神等方面的变化. 7 d后处死小鼠, 腹正中垂直切口, 取出肠组织(结肠、直肠、部分回肠), 纵行剪开肠管, 用生理盐水冲洗至干净, 将肠组织先剪成长约2-3 mm的小片, 再剪成约1 mm×1 mm×1 mm的小块, 转入50 mL离心管中, 静置15 min; 弃去上清, 把沉淀转入50 mL三角瓶中, 加入25 mL嗜热菌蛋白酶消化酶液, 37 ℃震荡2 h; 见消化液变浑浊, 用10 mL玻璃吸管反复吹打5 min, 把消化上清液转入50 mL离心管中; 850 g离心10 min, 弃上清, 每管沉淀中加入1 mL TRIzol混匀, 移入1.5 mL进口EP管中(-70 ℃保存). 肠上皮细胞总RNA提取严格按照Gibco TRIzol RNA提取试剂盒说明书操作. 将总mRNA逆转录为cDNA, 总体系为20 μL, RNA 2 μg, 逆转录步骤严格按照RevertaidTMFirst stand cDNA synthesis kit(逆转录试剂盒)提供条件进行逆转录, 转录后的cDNA保存于-70 ℃冰箱备用.
Real-time PCR, 根据基因总长进行引物设计, mIL-17Ra引物序列: 上游5'-AGCATCACCGTAAGCG-3', 下游5'-CACAGTCAGGCACAAAGA-3', 产物长度150 bp; mIL-17a引物序列: 上游5'-GCGTGTCCAAACACTGAGGCCA-3', 下游5'-TTCATTGCGGTGGAGAGTCCAGG-3', 产物长度150 bp; mGAPDH引物序列: 上游5'-TCTTGGGCTACACTGAGGAC-3', 下游5'-CATACCAGGAAATGAGCTTGA-3', 产物长度126 bp. 引物由北京诺赛生物工程公司合成. RT-PCR扩增反应体系如下: 下游引物各0.25 μL, 灭菌注射用水7.5 μL, RT-PCR Mix10 μL, cDNA 2 μL, 反应总体系20 μL. 反应条件: 预变性95 ℃ 3 min; 变性95 ℃ 10 s, 退火60 ℃ 15 s, 延伸72 ℃ 10 s(收集荧光), 反应40个循环; 60 ℃ 30 s(收集溶解曲线), 反应71个循环. 扩增产物用实时定量PCR仪Bio-rad IQ5软件进行分析.
1.2.3 FACS检测HT-29细胞IL-17Ra、TLR-4的表达: 用100 mL/L FBS RPMI-1640培养液重悬细胞后, 按每管细胞数5×105加入流式管中, 3管细胞处理如下: (1)空白对照组; (2)单染hTLR-4/PE抗体; (3)单染hIL-17Ra/PE抗体. FACS步骤: (1)收集细胞: HT-29细胞, 分3管, 2 000 r/min, 离心5 min, 弃去上清, 余下沉淀重悬; (2)各管加FACS洗液1 mL, 2 000 r/min, 离心5 min, 弃去上清, 余下沉淀重悬; (3)1号管不处理, 2号管加hTLR-4/PE抗体、1 μL, 3号管加hIL-17Ra/PE抗体、4 μL, 避光4 ℃孵育30 min; (4)重复2步骤; (5)各管加200 μL生理盐水, 上机检测. 结果根据FACS分析仪Winmdi程序进行分析.
1.2.4 hIL-17、LPS对HT-29细胞分泌IL-8的影响: 用100 mL/L FBS RPMI-1640培养液重悬细胞后, 细胞浓度为1×105 cells/mL转种于24孔培养板, 每孔0.5 mL, 静置1 h后按以下分组处理: (1)检测LPS诱导IL-8表达的动态变化: 空白对照组、LPS(10、50、100 μg/L), 刺激时间为6、12、24 h; (2)测LPS诱导IL-8表达的量效关系: 在24 h点分别设LPS浓度梯度为0、10、50、100 μg/L, 1、5、10 mg/L; (3)检测hIL-17诱导IL-8表达的量效关系: 在24 h点分别设hIL-17浓度为0、10、20、50、100 μg/L. 收取上清保存于-70 ℃冰箱备用ELISA法测定IL-8浓度.
1.2.5 hIL-17和LPS联合作用对HT-29细胞分泌IL-8的影响: 用100 mL/L FBS RPMI-1640培养液重悬细胞后, 细胞浓度为1×105 cells/mL转种于24孔培养板, 每孔0.5 mL, 静置1 h后按以下分组处理: (1)低浓度LPS联合hIL-17: 空白对照组, LPS(50 μg/L), hIL-17(50 μg/L), LPS(50 μg/L)+hIL-17(50 μg/L); (2)高浓度LPS联合hIL-17: 空白对照组, LPS(1 mg/L), hIL-17(50 μg/L), LPS(1 mg/L) +hIL-17(50 μg/L), 培养24 h后, 收取上清保存于-70 ℃冰箱备用ELISA法测定IL-8浓度. 结果通过酶标仪Ascent software versiona软件进行分析.
1.2.6 Western blot: 用100 mL/L FBS RPM I-1640培养液重悬细胞后, 细胞浓度为2.5×105 cells/mL转种于12孔培养板, 每孔2 mL, 培养24 h后, 按以下分组处理: 空白对照组, LPS(50 μg/L), hIL-17(50 μg/L), LPS(50 μg/L)+hIL-17(50 μg/L); 共3份, 分别刺激5、15、30 min. Western blot实验步骤: 参照试剂盒蛋白提取说明提取总蛋白, 制胶, 电泳, 转印(NC膜, 电压60 V, 180 min), 封闭(5%脱脂奶粉封闭液, 室温, 1 h), 依次加入一抗、4 ℃、过夜(P65、P-P65、AKT、PAKT、IκB抗体1∶1 000稀释(5%BSA稀释), GAPDH抗体1∶2 000稀释), 洗膜(TBST×3次, 10 min/次), 二抗: 室温、1 h(5%脱脂奶粉稀释), P65、P-P65、AKT、PAKT、IκB均用辣根酶标记人抗兔抗体1∶2 000; GAPDH辣根酶标记人抗鼠抗体1∶2 000, 显色、成像, 实验结果经灰度扫描及灰度分析.
统计学处理 数据以mean±SD表示, 多组间比较采用单因素方差分析, 两组间比较采用t检验, 检验水准α = 0.05.
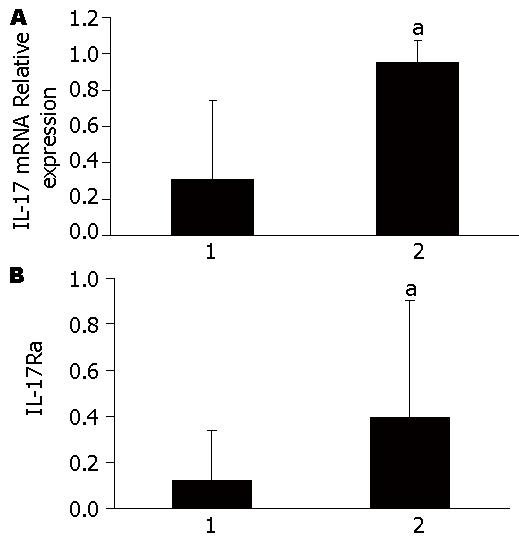
TNBS动物模型中IL-17Ra和IL-17 mRNA均表现为实验组相比较对照组表达上升(图1), 表明在IBD中IL-17、IL-17Ra表达上调, 参与炎症反应, 与既往研究相一致.
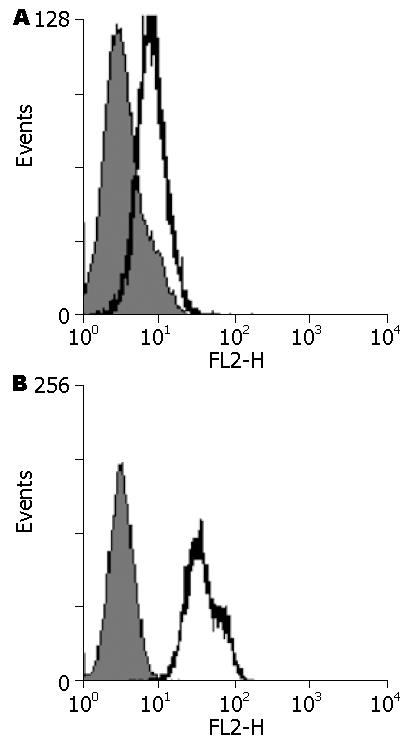
选取HT-29细胞作为研究对象, 首先检测了IL-17Ra分子在该细胞上的表达; 为探讨IL-17/IL-17RA通路与LPS/TLR4通路间可能的相互作用, FACS的方法分析TLR4在HT-29细胞上的表达情况. 结果表明HT-29细胞高表达IL-17Ra及TLR4分子(图2), 该结果为我们深入分析IL-17/IL-17Ra的效应机制以及该通路与LPS/TLR4通路之间的相互作用奠定了基础.
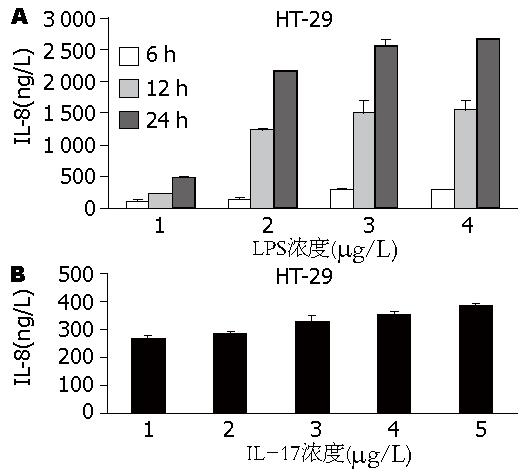
IL-17、LPS诱导HT-29细胞分泌IL-8的量-效关系曲线如图3A, B. 静息状态的HT-29细胞表达IL-8的水平低, LPS刺激(10 μg/L)6 h后肠上皮细胞开始表达IL-8, 第12小时IL-8的表达显著增加(P<0.01 vs 6 h) , 第24小时达高峰(P<0.01 vs 12 h, 图3A). 有理由推断LPS是IBD炎症形成初始阶段重要的细胞因子之一; LPS诱发的炎症反应在很大程度上是通过诱导产生IL-8为代表的趋化因子所介导的.
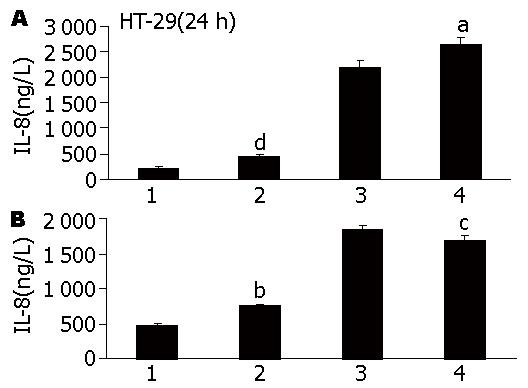
IL-17能与低浓度的LPS协同促进IL-8的分泌, 而在LPS高浓度的情况下, 该协同作用不明显, 提示与低浓度LPS协同作用可能是IL-17发挥病理效应的机制之一(图4A, B).
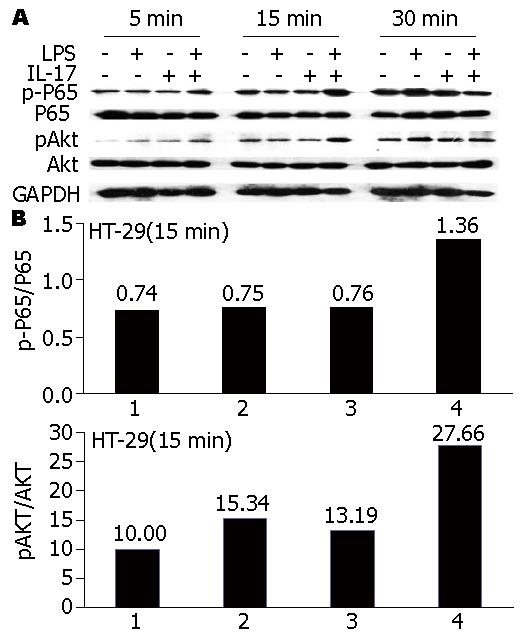
为了探讨IL-17协同低浓度LPS促进HT-29细胞活化的信号传导机制, 我们观察了在IL-17与LPS联合情况下细胞内PI3K-AKT通路以及NF-κB通路的活化情况, 结果表明在2者联合的情况下PI3K-AKT通路以及NF-κB通路的活化均显著增强(图5).
Th17细胞是一种通过其分泌细胞因子在炎症性疾病及自身免疫性疾病的发生发展中发挥重要作用的新型CD4+效应T细胞, 他有别于传统的Th1、Th2型细胞[12]. 近年研究表明在自身免疫性炎性肠病如溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(crohn's disease, CD)患者肠黏膜中存在大量的IL-17+细胞[1-13], 同时发现IL-17+细胞及其分泌的IL-17与患者病情严重程度密切相关. 且近些年大量研究报道了新型CD4+效应T细胞-Th17细胞在微环境中微生物免疫和自身免疫性疾病的动物模型中发挥重要的作用, Elson等[14]对小鼠诱导的结肠炎研究中通过比较Th1细胞和Th17细胞, 发现Th17细胞具有更显著的致病性. 在DSS-IBD动物模型中发现相比野生型老鼠, 敲除IL-17a基因老鼠的死亡率得到很大程度的降低, 提示IL-17a为一致病因素[15]. 因此对Th17细胞在自身免疫性炎性肠病中的作用进一步研究, 有助于更好地揭示炎性肠病的发病机制, 可能为治疗自身免疫性疾病提供有效的新思路.
本研究在进一步证实TNBS动物模型中IL-17/IL-17Ra活性与炎性肠病发病相关的基础上, 为深入研究IL-17/IL-17Ra通路在肠上皮细胞中的效应机制, 我们采用结肠癌细胞系HT-29细胞作为研究对象. 首先用FACS的方法分析发现, HT-29细胞高表达IL-17Ra及TLR4分子, 此结果为我们进一步探讨IL-17/IL-17Ra的效应机制以及该通路与LPS/TLR4通路之间的相互作用奠定了分子基础.
IL-17不仅对炎性肠病黏膜炎症反应的诱导和维持发挥了重要的作用, 同时也促进了多种炎性细胞因子的分泌, 如IL-6、CC家族的趋化因子等[2], 局部增多的炎性细胞因子提高了炎症反应的强度, 在炎症损伤中起着重要作用. 而趋化因子能加快诱导炎性细胞应答和介导免疫细胞募集和活化. Grimm等[16]研究发现在正常肠上皮细胞以及发生炎症反应的肠上皮细胞均可分泌IL-8的表达. IL-8是炎性介质网络中的关键成分, 为趋化因子家族的一员, 是一种有效的中性粒细胞趋化因子和活化因子, 其在IL-17诱导引起的反应中起着重要作用, 用抗IL-8的中和抗体发现其可以显著减少IL-17所引起的人中性粒细胞的趋化活性. 国内外研究发现在自身免疫性炎性肠病患者血清或肠组织中IL-8的表达异常[17-23], 且其水平不仅是评估炎性肠病活动的一个独立指标, 并能反映疾病的严重程度. 本研究通过检测LPS诱导HT-29细胞分泌IL-8的量效关系, 证实IL-8属于一种可以由LPS诱导产生的趋化因子[24-27], 且IL-8分泌水平与一定剂量范围内的LPS呈明显的时间、剂量依赖性(高浓度LPS诱导HT-29细胞分泌IL-8量效关系未显示), 与Cario等[28]研究相一致. LPS作用6 h时, HT-29细胞即表达IL-8, 说明在肠道炎症过程中, HT-29细胞在短时间内即可表达IL-8, 并可能与其他炎症细胞因子形成网络, 相互调节, 共同参与机体免疫和炎症反应. 因此我们有理由推断LPS是IBD炎症形成初始阶段重要的细胞因子之一, 且其诱发的炎症反应在很大程度上是通过诱导产生以IL-8为代表的趋化因子所介导的.
目前对IBD的致病机制研究主要表现在分子免疫学上, 其中肠黏膜免疫机制是研究的热点, 肠上皮细胞在其中扮演着非常重要的角色. 正常情况下, 肠上皮细胞时刻都在接触大量的细菌及其内毒素, 但其本身却不被激活, 其中存在相应的耐受机制. 但自身免疫性炎性肠病患者肠黏膜上皮存在严重异常时, 其耐受机制不再起保护作用. 对于机体而言, 肠道正常菌群演变成致病菌, 释放出的LPS被肠上皮细胞特异表达的TLR-4所识别, 诱导炎症细胞因子的表达. 生理情况下人肠道上皮细胞仅表达微量的TLR-4[28], 但在自身免疫性炎性肠病患者的结肠中TLR-4的表达异常[29,30], 这表明LPS/TLR4介导的信号转导通路与炎性肠病的发生密切相关. 本研究在HT-29细胞高表达IL-17Ra、 TLR-4分子, 及IL-17自身诱导HT-29细胞分泌IL-8水平低的基础上, 为进一步探讨IL-17/IL-17Ra通路与LPS/TLR-4通路间可能的相互作用, 我们通过观察IL-17与LPS联合刺激HT-29细胞的效应, 发现IL-17能与低浓度的LPS协同促进IL-8的分泌, 而在LPS高浓度的情况下, 该协同作用不明显, 提示IL-17发挥病理效应的机制之一可能是通过与低浓度LPS协同所介导的. 但LPS和IL-17在诱导IL-8表达的机制并不相同, 研究表明LPS介导的细胞启动首先与血清中LPS结合蛋白(LPS-binding protein, LBP)结合, 再与CD14、TLR-4和MD22形成复合物, 引起TLR-4活化, 最终引起NF-κB及PI3K-AKT等信号转导通路启动, 导致细胞因子的表达, 介导炎性肠病的发生. 而IL-17主要通过IL-17A与IL-17F发挥生物学效应, IL-17对HT-29细胞表达IL-8的影响可能与此有关. 其中NF-κB通路是调控IL-8表达的关键因素之一, 给予NF-κB信号抑制剂干预NF-κB信号通路可显著影响IL-8的表达. 因此为探讨IL-17协同低浓度LPS促进HT-29细胞活化的信号传导机制, 我们观察了在IL-17与LPS联合的情况下细胞内PI3K-AKT通路及NF-κB通路活化的情况, 结果表明在两者联合诱导的情况下, PI3K-AKT通路以及NF-κB通路的活化均显著增强, 为此我们有理由推论IL-17协同低浓度LPS促进HT-29细胞活化的信号传导机制是通过PI3K-AKT通路以及NF-κB通路, 介导IL-17病理效应, 引起炎性肠病的发生, 但国内外均未报道两者的相互作用. 在LPS高浓度的情况下, 该协同作用不明显, 提示可能与HT-29细胞对LPS的长时间及高浓度刺激表现耐受相关. 研究表明在LPS耐受的大鼠体内, 单核/巨噬细胞表达的IL-8显著受到抑制, LPS耐受的机制可能与TLR-4及其下游的与LPS信号转导相关的接头蛋白和TLR信号通路的负性调节因子有关. 关于HT-29细胞对LPS耐受性目前未见报道, 其发生的机制是否类似于单核/巨噬细胞仍尚需进一步的研究.
总之, Th17细胞不仅参与了自身免疫性炎性肠病的发生发展, 而且其可作为炎性肠病患者疾病严重程度的一个重要指标, 其发挥病理效应机制可能是与低浓度的LPS协同所介导, 而其信号传导机制是通过PI3K-AKT以及NF-κB通路, 因此我们可以通过阻断其信号传导通路, 调控TH17及其细胞因子的生物学效应, 进一步调节疾病的转归, 为临床提供一新的靶点和治疗措施.
目前炎症性肠病(IBD)的发病机制尚不完全明确, 其中某些细胞因子、信号传导通路等与IBD的发病机制密切相关. 随着我国近年来IBD的发病率快速上升, 对这些方面因素的探讨有重要的现实意义, 可为IBD的治疗提供新的靶点和方法.
邢建峰, 副教授, 西安交通大学医学院
IL-17具有抗感染和参与多种免疫损伤的双重作用, 因此对IL-17/IL-17R的生理、病理效应及其机制进行深入探讨以便有效发挥其抗感染作用是目前研究的热点.
近年来, 大量研究发现在多种自身免疫病及相应动物模型的血清及组织中均检测到IL-17的高表达, 提示IL-17参与了多种自身免疫性疾病的免疫损伤过程.
本研究探讨了在HT-29细胞中, IL-17/IL-17Ra通路与LPS/TLR4通路间可能的相互作用及机制, 表明Th17细胞不仅参与了自身免疫性炎性肠病的发生发展, 而且其可作为炎性肠病患者疾病严重程度的一个重要指标.
本研究较深入地探讨了IL-17/IL-17Ra与LPS/TLR4通路间可能的相互作用及机制, 为炎性肠病的临床治疗提供一新的靶点, 有一定的研究意义.
编辑: 张姗姗 电编: 闫晋利
| 1. | Kobayashi T, Okamoto S, Hisamatsu T, Kamada N, Chinen H, Saito R, Kitazume MT, Nakazawa A, Sugita A, Koganei K. IL23 differentially regulates the Th1/Th17 balance in ulcerative colitis and Crohn's disease. Gut. 2008;57:1682-1689. [PubMed] [DOI] |
| 2. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] [DOI] |
| 3. | Shih DQ, Targan SR. Immunopathogenesis of inflammatory bowel disease. World J Gastroenterol. 2008;14:390-400. [PubMed] [DOI] |
| 4. | Seiderer J, Elben I, Diegelmann J, Glas J, Stallhofer J, Tillack C, Pfennig S, Jürgens M, Schmechel S, Konrad A. Role of the novel Th17 cytokine IL-17F in inflammatory bowel disease (IBD): upregulated colonic IL-17F expression in active Crohn's disease and analysis of the IL17F p.His161Arg polymorphism in IBD. Inflamm Bowel Dis. 2008;14:437-445. [PubMed] [DOI] |
| 5. | Rovedatti L, Kudo T, Biancheri P, Sarra M, Knowles CH, Rampton DS, Corazza GR, Monteleone G, Di Sabatino A, Macdonald TT. Differential regulation of interleukin 17 and interferon gamma production in inflammatory bowel disease. Gut. 2009;58:1629-1636. [PubMed] [DOI] |
| 6. | Leppkes M, Becker C, Ivanov II, Hirth S, Wirtz S, Neufert C, Pouly S, Murphy AJ, Valenzuela DM, Yancopoulos GD. RORgamma-expressing Th17 cells induce murine chronic intestinal inflammation via redundant effects of IL-17A and IL-17F. Gastroenterology. 2009;136:257-267. [PubMed] [DOI] |
| 7. | Kleinschek MA, Boniface K, Sadekova S, Grein J, Murphy EE, Turner SP, Raskin L, Desai B, Faubion WA, de Waal Malefyt R. Circulating and gut-resident human Th17 cells express CD161 and promote intestinal inflammation. J Exp Med. 2009;206:525-534. [PubMed] [DOI] |
| 8. | Abraham C, Cho J. Interleukin-23/Th17 pathways and inflammatory bowel disease. Inflamm Bowel Dis. 2009;15:1090-1100. [PubMed] [DOI] |
| 9. | Andoh A, Yagi Y, Shioya M, Nishida A, Tsujikawa T, Fujiyama Y. Mucosal cytokine network in inflammatory bowel disease. World J Gastroenterol. 2008;14:5154-5161. [PubMed] [DOI] |
| 10. | Levin A, Shibolet O. Toll-like receptors in inflammatory bowel disease-stepping into uncharted territory. World J Gastroenterol. 2008;14:5149-5153. [PubMed] [DOI] |
| 11. | Li X, Chen G, Li Y, Wang R, Wang L, Lin Z, Gao X, Feng J, Ma Y, Shen B. Involvement of T cell Ig Mucin-3 (Tim-3) in the negative regulation of inflammatory bowel disease. Clin Immunol. 2010;134:169-177. [PubMed] [DOI] |
| 12. | Infante-Duarte C, Horton HF, Byrne MC, Kamradt T. Microbial lipopeptides induce the production of IL-17 in Th cells. J Immunol. 2000;165:6107-6115. [PubMed] [DOI] |
| 13. | Sugihara T, Kobori A, Imaeda H, Tsujikawa T, Amagase K, Takeuchi K, Fujiyama Y, Andoh A. The increased mucosal mRNA expressions of complement C3 and interleukin-17 in inflammatory bowel disease. Clin Exp Immunol. 2010;160:386-393. [PubMed] [DOI] |
| 14. | Elson CO, Cong Y, Weaver CT, Schoeb TR, McClanahan TK, Fick RB, Kastelein RA. Monoclonal anti-interleukin 23 reverses active colitis in a T cell-mediated model in mice. Gastroenterology. 2007;132:2359-2370. [PubMed] [DOI] |
| 15. | Ito R, Kita M, Shin-Ya M, Kishida T, Urano A, Takada R, Sakagami J, Imanishi J, Iwakura Y, Okanoue T. Involvement of IL-17A in the pathogenesis of DSS-induced colitis in mice. Biochem Biophys Res Commun. 2008;377:12-16. [PubMed] [DOI] |
| 16. | Grimm MC, Elsbury SK, Pavli P, Doe WF. Interleukin 8: cells of origin in inflammatory bowel disease. Gut. 1996;38:90-98. [PubMed] [DOI] |
| 17. | Fiocchi C. Inflammatory bowel disease: etiology and pathogenesis. Gastroenterology. 1998;115:182-205. [PubMed] [DOI] |
| 18. | Sartor RB. Cytokines in intestinal inflammation: pathophysiological and clinical considerations. Gastroenterology. 1994;106:533-539. [PubMed] |
| 19. | Yang SK, Choi MS, Kim OH, Myung SJ, Jung HY, Hong WS, Kim JH, Min YI. The increased expression of an array of C-X-C and C-C chemokines in the colonic mucosa of patients with ulcerative colitis: regulation by corticosteroids. Am J Gastroenterol. 2002;97:126-132. [PubMed] [DOI] |
| 20. | Melgar S, Drmotova M, Rehnström E, Jansson L, Michaëlsson E. Local production of chemokines and prostaglandin E2 in the acute, chronic and recovery phase of murine experimental colitis. Cytokine. 2006;35:275-283. [PubMed] [DOI] |
| 21. | Banks C, Bateman A, Payne R, Johnson P, Sheron N. Chemokine expression in IBD. Mucosal chemokine expression is unselectively increased in both ulcerative colitis and Crohn's disease. J Pathol. 2003;199:28-35. [PubMed] [DOI] |
| 24. | Schuerer-Maly CC, Eckmann L, Kagnoff MF, Falco MT, Maly FE. Colonic epithelial cell lines as a source of interleukin-8: stimulation by inflammatory cytokines and bacterial lipopolysaccharide. Immunology. 1994;81:85-91. [PubMed] |
| 25. | Eckmann L, Jung HC, Schürer-Maly C, Panja A, Morzycka-Wroblewska E, Kagnoff MF. Differential cytokine expression by human intestinal epithelial cell lines: regulated expression of interleukin 8. Gastroenterology. 1993;105:1689-1697. [PubMed] |
| 26. | Eckmann L, Kagnoff MF, Fierer J. Epithelial cells secrete the chemokine interleukin-8 in response to bacterial entry. Infect Immun. 1993;61:4569-4574. [PubMed] |
| 27. | McCormick BA, Colgan SP, Delp-Archer C, Miller SI, Madara JL. Salmonella typhimurium attachment to human intestinal epithelial monolayers: transcellular signalling to subepithelial neutrophils. J Cell Biol. 1993;123:895-907. [PubMed] [DOI] |
| 28. | Cario E, Podolsky DK. Differential alteration in intestinal epithelial cell expression of toll-like receptor 3 (TLR3) and TLR4 in inflammatory bowel disease. Infect Immun. 2000;68:7010-7017. [PubMed] [DOI] |
| 29. | Szebeni B, Veres G, Dezsõfi A, Rusai K, Vannay A, Mraz M, Majorova E, Arató A. Increased expression of Toll-like receptor (TLR) 2 and TLR4 in the colonic mucosa of children with inflammatory bowel disease. Clin Exp Immunol. 2008;151:34-41. [PubMed] [DOI] |
| 30. | Reaves TA, Chin AC, Parkos CA. Neutrophil transepithelial migration: role of toll-like receptors in mucosal inflammation. Mem Inst Oswaldo Cruz. 2005;100 Suppl 1:191-198. [PubMed] [DOI] |