修回日期: 2012-02-13
接受日期: 2012-03-20
在线出版日期: 2012-04-28
目的: 确定十二指肠结节性病变组织病理学特征及分型.
方法: 统计分析经内镜下被确诊为十二指肠结节性病变患者的资料. 对其年龄、性别、类型、症状、最后诊断、相关疾病和组织病理学特点等记录进行回顾性研究. 同时亦分析患者血红蛋白、平均细胞体积、血清铁蛋白、白蛋白、免疫球蛋白、腹腔自身抗体、贾第虫和粪便OVA寄生虫, ELISA分析贾第虫的特异性抗原水平.
结果: 筛选出17例经内镜确诊为十二指肠结节性病变的患者. 诊断时平均年龄为28.1岁(17-56岁), 男9例, 女8例. 十二指肠结节性病变中, 腹痛(47%)是最常见的临床症状, 胃窦结节(41%)是最常见的内镜表现. 十二指肠结节性病变的组织病理学评估显示, 所有患者均有慢性炎症, 嗜酸性粒细胞在隐窝间和上皮内增殖占70.5%, 47%的患者存在绒毛萎缩. 通过组织学检查和/或特定的蓝氏贾第鞭毛虫粪便抗原阳性实验显示有6例患者感染贾第虫. 患者的临床诊断显示某些特征, 如腹泻、贾第虫病、分泌型IgA缺乏症和幽门螺杆菌(Helicobacter pylori, H. pylori)胃炎, 并且他们中的一些与其他的有相关性.
结论: 十二指肠结节性病变其黏膜有明显淋巴细胞和/或嗜酸性粒细胞浸润, 建议应对造成这一显著炎症反应的微生物学和免疫学病因进行进一步研究.
引文著录: 时晓鑫. 十二指肠结节性病变病理分型及诊断17例. 世界华人消化杂志 2012; 20(12): 1061-1065
Revised: February 13, 2012
Accepted: March 20, 2012
Published online: April 28, 2012
AIM: To investigate the incidence, clinical presentations, histopathological features, natural history, and response to therapy of nodular duodenum.
METHODS: The clinical data for 17 patients with nodular duodenum were analyzed retrospectively, including age, sex, disease type, symptoms, final diagnosis, histopathology, hemoglobin, SF, AL, IG, and OVA.
RESULTS: Of 17 patients with nodular duodenum, 9 were male and 8 were female. Their mean age was 28.1 years. Approximately 47% of patients had stomachache. Sinus tubercle was most frequently seen endoscopically. Histology of duodenal nodules revealed chronic inflammation in all cases, intraepithelial eosinophilic granulocyte proliferation in 70.5% of cases, and villous atrophy in 47% of cases. Six patients had flagellate. Clinical diagnostic features included diarrhea, giardiasis, secretory IgA deficiency, and Helicobacter pylori-associated gastritis.
CONCLUSION: Nodular duodenum is an endoscopically distinct entity that may respond clinically to antisecretory therapy but is difficult to eradicate.
- Citation: Shi XX. Clinical and pathologic features of nodular duodenum: An analysis of 17 cases. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 1061-1065
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/1061.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.1061
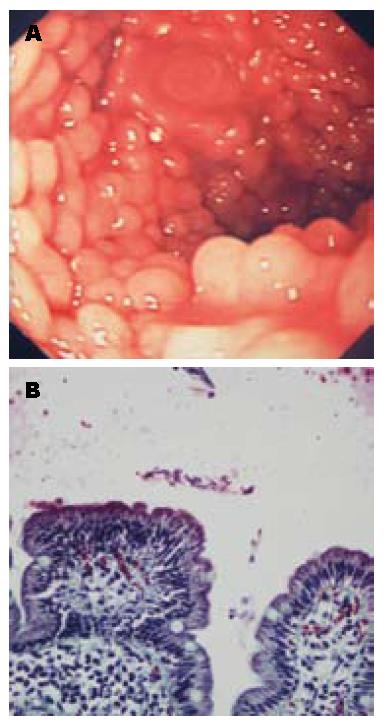
十二指肠结节性病变内镜特点为十二指肠近端可见无数黏膜结节, 其大小不等, 直径为0.2-0.5 cm, 该结节并不常见且其确切病因尚不清楚. 可能是由十二指肠球炎引起, 传染性病原体、环境、营养或其他个人因素也可能是十二指肠结节性病变的致病因素[1,2]. 本文回顾性分析我院病例, 旨在定通过上消化系内镜检查发现十二指肠球部结节性病变患病率、临床意义和组织病理学特征.
2006-02/2010-03由于各种胃肠道不适行胃镜检查或肠道活检内镜的患者.
1.2.1 患者资料统计: 选取分析20例, 十二指肠结节性病变患者的内镜记录, 对其年龄、性别、类型和症状、最后诊断、相关疾病和组织病理学特点等记录进行回顾性研究. 同时亦分析患者血红蛋白、平均细胞体积、血清铁蛋白、白蛋白、免疫球蛋白、腹腔自身抗体、贾第虫和粪便OVA寄生虫, 且ELISA分析贾第虫的特异性抗原水平. 排除终末期肾脏疾病和恶性肿瘤.
1.2.2 组织病理学检查: 十二指肠结节性病变定义为在十二指肠内镜检查下可见十二指肠近端存在多个散在的、直径0.2-0.5 cm的黏膜结节. 对患者进行十二指肠结节区的活组织镜检, 并记录食管、胃体、胃窦或十二指肠任何其他的异常情况. 组织经苏木素-伊红和过碘酸-希夫(PAS)-阿新蓝染色后, 由同1位病理专业主任医师(熟悉十二指肠内镜下的表现但并不清楚患者病史、临床表现和之前的检查结果)进行评估.
1.2.3 病理分级: 绒毛/隐窝比率范围为0-4, 规定0为正常, 将绒毛萎缩分为4个级别, 参考文献[3]. 计数远离淋巴滤泡绒毛尖端的上皮内淋巴细胞(intraepithelial lymphocytes, IELs)的数量. 对慢性和急性炎症均进行分级如下: 0, 正常; 1, 轻度; 2, 适中; 3, 严重, 分级方法参照文献[4]. 经苏木素/伊红染色, 选择嗜酸性粒细胞浸润面积最大的区域, 至少在1个高倍视野(high power field, HPF)对其进行计数. 定义为嗜酸性粒细胞>20个/HPF伴随浸润到表面和/或隐窝黏膜内为异常嗜酸性粒细胞浸润.
统计学处理 数据表示为mean±SD和百分数(%).
2006-02/2010-03我院约有1 040例上消化系内镜检查. 经内镜确诊为十二指肠结节性病变共20例(1.9%). 其中3例因其十二指肠组织样本不可用而被排除. 17例患者被纳入研究(表1), 包括男9例(53%), 女8例(47%), 患者年龄范围19-67岁(平均35.1岁±2.7岁).
| 年龄/性别 | 临床表现 | DS(mo) | 临床诊断 | 内镜特征1 | VA | IELs | CI | NLH | AI | AEI | GM | BGH | 十二指肠贾第虫 | 胃窦H. pylori | 贾第虫特异性抗原粪便检查 | 最终诊断 |
| 19/M | 贫血 | 4 | IDA | 胃窦结节性病变 | 0 | - | 3 | + | 0 | - | - | - | - | + | - | 十二指肠炎, H. pylori胃炎 |
| 21/M | 身材小 | 72 | 贾第虫病 | - | 2 | + | 3 | + | 1 | + | - | + | NA | + | 贾第虫病, H. pylori胃炎 | |
| 45/F | 贫血腹泻 | 12 | CD | - | 3 | + | 3 | + | 2 | + | + | - | NA | NA | CD | |
| 65/M | 贫血 | 6 | CD | 胃窦结节性病变 | 1 | + | 1 | - | 1 | + | - | - | - | NA | - | CD |
| 46/F | 反复呕吐 | 4 | 胃病 | 胃窦结节性病变 | 0 | + | 3 | + | 1 | + | - | - | - | + | - | 十二指肠炎, H. pylori胃炎 |
| 38/F | 腹痛腹泻 | 12 | 贾第虫病IgA缺乏症 | 胃窦结节性病变 | 0 | + | 3 | + | 2 | + | + | + | - | + | + | 贾第虫病, IgA缺乏症, H. pylori胃炎 |
| 53/M | 身材短小 | 24 | CDIDDM | - | 3 | + | 1 | - | 1 | - | - | - | + | - | NA | CD, IDDM, 贾第虫病 |
| 41/F | 腹痛 | 12 | RAP胃病 | 胃窦结节性病变 | 0 | - | 2 | - | 0 | - | - | - | - | + | - | H. pylori胃炎 |
| 25/M | 腹痛 | 6 | 贾第虫病 | - | 0 | - | 1 | - | 0 | + | - | - | - | - | + | 贾第虫病 |
| 55/F | 腹痛身材短小 | 12 | CD | - | 4 | + | 2 | - | 1 | + | + | - | - | NA | - | CD |
| 20/M | 恶心呕吐 | 2 | PT2胃病 | - | 0 | - | 3 | + | 1 | - | - | - | - | + | NA | 十二指肠炎, H. pylori胃炎 |
| 67/M | 腹痛呕吐 | 0.7 | 胃病 | 胃体及胃窦红斑样改变 | 0 | - | 1 | - | 1 | + | - | - | - | + | NA | H. pylori胃炎 |
| 54/M | 呕吐 | 1 | 胃病 | - | 0 | - | 2 | - | 1 | + | - | - | + | NA | H. pylori胃炎 | |
| 35/F | 腹痛 | 12 | RAP胃病 | 胃窦结节性病变 | 0 | + | 1 | - | 0 | + | - | - | - | + | NA | 十二指肠炎, H. pylori胃炎 |
| 38/F | 腹痛恶心 | 2 | 功能性消化不良 | - | 1 | + | 2 | - | 0 | + | - | - | - | NA | - | 十二指肠炎,慢性胃炎 |
| 46/F | 腹痛 | 24 | 贾第虫病 | - | 1 | + | 3 | + | 0 | + | - | - | - | NA | + | 贾第虫病 |
| 35/M | 腹泻身材短小 | 24 | 贾第虫病IgA缺乏症 | 胃窦结节性病变 | 1 | + | 2 | - | 0 | - | - | - | + | + | + | 贾第虫病, IgA缺乏症, H. pylori胃炎 |
胃窦结节(41%)是除十二指肠结节以外最常见的内镜发现. 全黏膜红斑1例(6%). 11例患者行贾第虫特异性抗原粪便检查, 呈阳性为5例. 患者临床和实验室特征及内镜研究结果显示见表1. 最常见的临床症状是腹痛, 有8例患者(47%), 其中37.5%局限在上腹部. 疼痛持续时间从0.7-24 mo不等(平均10 mo±7.3 mo), 常为间歇性和渐进性; 恶心和呕吐患者5例(29%), 身材矮小患者4例(23.5%), 贫血和腹泻患者各3例(分别占18%).
十二指肠结节性病变的内镜显示如图1. 该疾病的组织病理学评价表明, 在所有患者(100%)中慢性炎症浸润范围从轻微到严重, 其中有6例为1级, 4例为2级, 7例为3级并伴有慢性淋巴滤泡增生性炎症, 疑是结节性淋巴组织增生(nodular lymphoid hyperplasia, NLH); 8例活检显示不同程度的绒毛萎缩, 其中4例(严重3例)经相关科室及腹腔自身抗体测试被确诊为腹泻; 17例活检中有12例(70.5%)可观察到其隐窝和上皮内的嗜酸性粒细胞的数量增加, 但嗜酸性粒细胞的数量增加和贾第虫阳性之间没有相关性(表1). 此外, 这些患者粪便中其他寄生虫的检查结果为阴性; 患者胃上皮化生和Brunner腺增生症(brunner gland hyperplasia, BGH)不突出. 患者组织病理学研究结果显示见表2.
| 病理特征 | n | % |
| 慢性炎症 | 17 | 100 |
| 异常的嗜酸性粒细胞的炎症反应 | 12 | 70.5 |
| IELs增多 | 10 | 59 |
| 急性炎症 | 10 | 59 |
| 绒毛萎缩 | 8 | 47 |
| NLH | 7 | 41 |
| 十二指肠黏膜表面蓝氏贾第虫 | 3 | 18 |
| 胃上皮化生 | 3 | 18 |
| BGH | 2 | 12 |
对3例患者十二指肠黏膜表面的贾第虫滋养体进行病理检查. 其中2例贾第虫粪便检查特定抗原阳性, 其他原虫的病原体如隐孢子虫, 经光镜未发现. 患者无黏膜糜烂或溃疡. 除1例IgA缺乏症患者的活检显示黏膜浆细胞明显减少外, 所有活检固有层中浆细胞均易被发现. 结构良好的肉芽肿或小集合组织细胞未识别. 增生或腺瘤性息肉或任何其他恶性或组织病理学变化未发现. 收集11例患者的胃活检样本, 其中9例患者胃窦黏膜表面存在幽门螺杆菌(Helicobacter pylori, H. pylori, 表1). 在对6例胃窦结节性病变患者内镜检查中均发现结节性淋巴组织增生NLH和胃窦黏H. pylori, 其中3人十二指肠活检中亦发现NLH.
十二指肠结节性病变是一种罕见的内镜发现, 该结节性病变的病因尚不明确. 以往研究表明, 在某些特定疾病如低丙球蛋白血症、终末期肾脏疾病及腹泻中曾发现十二指肠结节性病变[5-8]. 也有其与某些媒介物如H. pylori和贾第虫之间的相关性研究[9,10]. Langkemper等[11]于1980年通过放射学及内镜发现了22例十二指肠存在结节样病变的成人患者. 他们进行组织病理学研究后显示所有患者的十二指肠球部均有特征性外观, 将其归因于胃黏膜异位, 只有1例除外. Fernandez-Melone等[1]报道十二指肠结节性炎在成人中的发生率为4%. 他们推测其为层次分明、形态多样的非特异性十二指肠炎. Triadafilopoulos等[2]报道了83例(发病率4%)患十二指肠结节性病变的男退伍军人的临床及病理特征, 并认为十二指肠结节性病变可能是十二指肠炎的1个变种, 可能与酸消化性溃疡有关, 而且其组织病理学特征是可变的. 所有的研究组包括成人患者及流行病学调查均显示其出现率大约为4%. 我们观测了相当数量的十二指肠结节性病变患者, 并且发现其在国人人群中的出现率是1.9%.
据之前报道, 十二指肠结节性病变是十二指肠腹泻的一种内镜特征[8,12]. 在我们研究中有4例腹泻患者存在十二指肠球结节性病变, 并且在我院随访的腹泻患者中其出现率为4.6%, 这主要源于上下胃肠道的丙种球蛋白缺乏导致血症患者感染的风险将会增加. 肠道免疫缺陷综合征的组织病理学特征是多样的, 但最常见的是NLH和绒毛萎缩[13]. 在先前的一个研究中32例成年患者行胃肠镜检查时发现普遍存在多种免疫缺陷, 其中31%的患者存在十二指肠结节性病变[5]. 十二指肠标本的组织学评估发现除十二指肠黏膜的正常组织外尚存在绒毛萎缩和NLH. 我们有2名患者罹患选择性IgA缺乏症(6号和17号患者). 对其进行十二指肠的组织学检查发现均存在显著的淋巴细胞炎症, 1名为NLH而另1名为绒毛萎缩. 虽然在对1名患者行十二指肠活检时发现了贾第虫滋养体, 但在别人的粪便样本中亦发现这种寄生虫的包囊和抗原. IgA抗肌内膜抗体以及IgA和IgG组织转谷氨酰胺酶抗体(tTG)对于这些腹泻患者是不兼有的. 胃窦部黏膜病理观察也发现了H. pylori, 患者接受针对贾第虫和H. pylori的治疗, 虽然6名患者的腹痛和腹泻已经治愈, 但在1年后的第2次胃镜检查中发现十二指肠的结节外观和病理组织学研究结果并未发生改变. 我们认为NLH是一种局部针对免疫缺陷患者发生的肠道微生物抗原的免疫反应[14]. 另一方面, NLH不仅在免疫缺陷症患者中存在, 他也在无免疫缺陷、肠道细菌过度生长、腹泻的成人贾第鞭毛虫病患者中被发现[15-17].
本研究中有6例贾第鞭毛虫病患者, 其中2例为IgA缺乏症, 其余丙种球蛋白水平正常. 尽管常规粪便检查检测贾第鞭毛虫滋养体或包囊可能会失败, 在粪便样本中行酶联免疫吸附测定法(enzyme linked immunosorbent assay, ELISA)检测贾第鞭毛虫抗原则更敏感[18]. 在我们的研究中, 运用粪便样本中行ELISA检测贾第鞭毛虫抗原诊断贾第鞭毛虫病患者5例, 在十二指肠黏膜中也检测出有3例. 虽然没有具体的贾第鞭毛虫感染病理发现, 但其具有不同程度的绒毛萎缩, 上皮内淋巴细胞数量增加以及先前描述的NLH表现[10,18,19]. 我们发现淋巴浸润增加5例、绒毛萎缩4例(1例腹泻, 7号患者), NLH 3例.
NLH被定义为形成大量浸润性具有明显生发中心的类淋巴细胞的淋巴滤泡, 其可能是解释十二指肠结节性病变的原因之一. 然而, 尽管内镜检查下外观相同, 组织病理学检查表明NLH在仅41%的患者中被发现, 而非全部. 另一方面, IEL浸润的增加和慢性炎症的出现率也较高(分别为59%和100%). 我们注意到本研究人群除有慢性炎症外, 在十二指肠黏膜内嗜酸性粒细胞亦有明显增加. 虽然其没有高到足以断定为嗜酸性粒细胞胃肠病的程度[20,21], 但本研究中70.5%患者有明显十二指肠黏膜内嗜酸性粒细胞浸润.
7例患者内镜检查同时发现存在胃窦结节性病变. 我们收集了11例患者的胃窦活检标本(6例有胃窦结节性病变), 发现其中有9例在胃窦黏膜上有幽门螺旋杆菌. 6例胃窦结节性病变患者中我们观察到在胃窦黏膜上NLH和H. pylori同时存在. 以前报道称H. pylori感染和胃窦结节性胃炎关系密切, 尤其是儿童[22,23]. 在实验中, 我们也观察到胃窦结节性病变常伴有H. pylori胃炎, 但不存在十二指肠结节性病变.
Li等对86例十二指肠结节性病变患者资料进行研究探讨了H. pylori感染、胃上皮化生及十二指肠结节性病变之间的关系. 他们发现在十二指肠结节性病变患者中H. pylori感染和胃上皮化生的出现率分别为58.1%和57%. 经成功治疗之后的患者, 其胃上皮化生明显消退但内镜下十二指肠结节性病变的外观未改变. 胃上皮化生在本研究中也不显著. H. pylori胃炎(伴/不伴胃窦结节性病变)与十二指肠结节性病变的关系尚不清楚.
总之, 本研究报道了17例十二指肠结节性病变患者的临床及病理表现, 该结节无显著的组织形态学特征, 患者最显著的组织形态学特征是在十二指肠黏膜上淋巴细胞的增多和嗜酸性粒细胞的浸润. 但后续还需要大样本人群的研究证实.
十二指肠结节性病变内镜特点为十二指肠近端可见无数黏膜结节, 其大小不等, 直径为0.2-0.5 cm, 该结节并不常见且其确切病因尚不清楚.
刘宝瑞, 教授, 南京大学医学院附属鼓楼医院肿瘤中心; 姜相君, 主任医师, 青岛市市立医院消化科
在某些特定疾病如低丙球蛋白血症、终末期肾脏疾病及腹泻中曾发现十二指肠结节性病变. 也有其与某些媒介物如H. pylori和贾第虫之间的相关性的研究.
文章选题新颖, 整体结构严谨, 思路清晰, 讨论全面. 由于目前对本病尚缺乏公认的诊断标准, 所以本文有较好的临床指导意义.
编辑: 张姗姗 电编: 闫晋利
| 1. | Fernandez-Melone JH, Triadafilopoulos G, Chandler JG. Nodular duodenitis and single duodenal nodules. Am Surg. 1990;56:175-177. [PubMed] |
| 2. | Triadafilopoulos G. Clinical and pathologic features of the nodular duodenum. Am J Gastroenterol. 1993;88:1058-1064. [PubMed] |
| 3. | Drut R, Rúa EC. Histopathologic diagnosis of celiac disease in children without clinical evidence of malabsorption. Int J Surg Pathol. 2007;15:354-357. [PubMed] [DOI] |
| 4. | Guarner J, Herrera-Goepfert R, Mohar A, Sanchez L, Halperin D, Ley C, Parsonnet J. Interobserver variability in application of the revised Sydney classification for gastritis. Hum Pathol. 1999;30:1431-1434. [PubMed] [DOI] |
| 5. | Luzi G, Zullo A, Iebba F, Rinaldi V, Sanchez Mete L, Muscaritoli M, Aiuti F. Duodenal pathology and clinical-immunological implications in common variable immunodeficiency patients. Am J Gastroenterol. 2003;98:118-121. [PubMed] [DOI] |
| 6. | Zukerman GR, Mills BA, Koehler RE, Siegel A, Harter HR, DeSchryver-Kecskemeti K. Nodular duodenitis. Pathologic and clinical characteristics in patients with end-stage renal disease. Dig Dis Sci. 1983;28:1018-1024. [PubMed] [DOI] |
| 7. | Sotoudehmanesh R, Ali Asgari A, Ansari R, Nouraie M. Endoscopic findings in end-stage renal disease. Endoscopy. 2003;35:502-505. [PubMed] [DOI] |
| 8. | Piazzi L, Zancanella L, Chilovi F, Merighi A, De Vitis I, Feliciangeli G, Borgheresi P, Snider L, Grassi SA, Manfrini C. Diagnostic value of endoscopic markers for celiac disease in adults: a multicentre prospective Italian study. Minerva Gastroenterol Dietol. 2008;54:335-346. [PubMed] |
| 9. | Li XB, Ge ZZ, Chen XY, Liu WZ. Duodenal gastric metaplasia and Helicobacter pylori infection in patients with diffuse nodular duodenitis. Braz J Med Biol Res. 2007;40:897-902. [PubMed] [DOI] |
| 10. | Pérez-Roldán F, Mate-Valdezate A, Villafáñez-García MC, González Carro P, Legaz Huidobro ML. Nodular lymphoid hyperplasia by Giardia lamblia. Endoscopy. 2008;40 Suppl 2:E116-E117. [PubMed] [DOI] |
| 11. | Langkemper R, Hoek AC, Dekker W, Op den Orth JO. Elevated lesions in the duodenal bulb caused by heterotopic gastric mucosa. Radiology. 1980;137:621-624. [PubMed] [DOI] |
| 12. | Lee SK, Lo W, Memeo L, Rotterdam H, Green PH. Duodenal histology in patients with celiac disease after treatment with a gluten-free diet. Gastrointest Endosc. 2003;57:187-191. [PubMed] [DOI] |
| 13. | Washington K, Stenzel TT, Buckley RH, Gottfried MR. Gastrointestinal pathology in patients with common variable immunodeficiency and X-linked agammaglobulinemia. Am J Surg Pathol. 1996;20:1240-1252. [PubMed] [DOI] |
| 14. | Webster AD, Kenwright S, Ballard J, Shiner M, Slavin G, Levi AJ, Loewi G, Asherson GL. Nodular lymphoid hyperplasia of the bowel in primary hypogammaglobulinaemia: study of in vivo and in vitro lymphocyte function. Gut. 1977;18:364-372. [PubMed] [DOI] |
| 15. | Rubio-Tapia A, Hernández-Calleros J, Trinidad-Hernández S, Uscanga L. Clinical characteristics of a group of adults with nodular lymphoid hyperplasia: a single center experience. World J Gastroenterol. 2006;12:1945-1948. [PubMed] [DOI] |
| 16. | Kasirga E, Gülen H, Simşek A, Ayhan S, Yilmaz O, Ellidokuz E. Coexistence of symptomatic iron-deficiency anemia and duodenal nodular lymphoid hyperplasia due to giardiasis: case report. Pediatr Hematol Oncol. 2009;26:57-61. [PubMed] [DOI] |
| 17. | Rambaud JC, De Saint-Louvent P, Marti R, Galian A, Mason DY, Wassef M, Licht H, Valleur P, Bernier JJ. Diffuse follicular lymphoid hyperplasia of the small intestine without primary immunoglobulin deficiency. Am J Med. 1982;73:125-132. [PubMed] [DOI] |
| 18. | Vesy CJ, Peterson WL. Review article: the management of Giardiasis. Aliment Pharmacol Ther. 1999;13:843-850. [PubMed] [DOI] |
| 19. | Eren M, Saltik-Temizel IN, Yüce A, Cağlar M, Koçak N. Duodenal appearance of giardiasis in a child with selective immunoglobulin A deficiency. Pediatr Int. 2007;49:409-411. [PubMed] [DOI] |
| 20. | Chehade M, Magid MS, Mofidi S, Nowak-Wegrzyn A, Sampson HA, Sicherer SH. Allergic eosinophilic gastroenteritis with protein-losing enteropathy: intestinal pathology, clinical course, and long-term follow-up. J Pediatr Gastroenterol Nutr. 2006;42:516-521. [PubMed] [DOI] |
| 21. | Lowichik A, Weinberg AG. A quantitative evaluation of mucosal eosinophils in the pediatric gastrointestinal tract. Mod Pathol. 1996;9:110-114. [PubMed] |
| 22. | Cohen H, Laine L. Endoscopic methods for the diagnosis of Helicobacter pylori. Aliment Pharmacol Ther. 1997;11 Suppl 1:3-9. [PubMed] [DOI] |
| 23. | Riddell RH. Pathobiology of Helicobacter pylori infection in children. Can J Gastroenterol. 1999;13:599-603. [PubMed] [DOI] |