修回日期: 2012-01-29
接受日期: 2012-03-28
在线出版日期: 2012-04-28
目的: 应用通用引物巢式PCR技术检测新疆哈萨克族食管鳞癌人乳头瘤病毒(HPV)的感染率, 并探讨HPV与新疆哈萨克族食管鳞癌的关系.
方法: 提取新疆哈萨克族食管鳞癌及正常食管组织的DNA, 应用通用引物HPV MY09/11及HPV G5+/6+进行巢式PCR, 检测新疆哈萨克族食管鳞癌中HPV的感染率.
结果: 巢式PCR法扩增后检测到食管鳞癌中HPV感染率为66.67%, 正常对照组为12.12%, 两者差异有统计学意义(P<0.05).
结论: 本实验结果表明HPV可能是新疆哈萨克族食管癌发生的一个重要病因学因素, 结合通用引物巢式PCR法可以更加方便可靠的检测HPV-DNA.
引文著录: 陈卫刚, 杨春梅, 徐丽红, 张宁, 刘晓燕, 马云贵, 霍小玲, 韩玉胜, 田德安, 郑勇. 通用引物巢式PCR法对哈萨克族食管鳞癌HPV感染的检测. 世界华人消化杂志 2012; 20(12): 1049-1053
Revised: January 29, 2012
Accepted: March 28, 2012
Published online: April 28, 2012
AIM: To detect human papillomavirus (HPV) in esophageal squamous cell carcinoma (ESCC) in Xinjiang Kazakh patients by universal primer-mediated nested PCR to investigate the relationship between HPV infection and ESCC.
METHODS: DNA was isolated from ESCC and healthy esophageal mucosal specimens from Xinjiang Kazakh adults and used to amplify HPV using universal primers HPV MY09/11 and HPV-specific primers HPV G5+/6+ by nested PCR. The rate of HPV infection was then calculated.
RESULTS: The rate of HPV infection was 66.67% in the ESCC group and 12.12% in the healthy control group.
CONCLUSION: HPV infection may be involved in the development of ESCC in Xinjiang Kazakh adults. Universal primer-mediated nested PCR is a convenient and reliable method for detection of HPV-DNA.
- Citation: Chen WG, Yang CM, Xu LH, Zhang N, Liu XY, Ma YG, Huo XL, Han YS, Tian DA, Zheng Y. Detection of human papilloma virus in esophageal cancer in Xinjiang Kazakh patients by general primer-mediated polymerase chain reaction. Shijie Huaren Xiaohua Zazhi 2012; 20(12): 1049-1053
- URL: https://www.wjgnet.com/1009-3079/full/v20/i12/1049.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i12.1049
人乳头瘤病毒(human papilloma virus, HPV)是双链DNA病毒[1], 与多种恶性肿瘤相关, 包括食管癌、口腔癌和肺癌等[2]. 然而, HPV在恶性肿瘤中的发病机制仍存在争议. 自1944年Syrjanen首次报道了HPV与食管鳞癌的关系后[3,4], 大量研究揭示HPV已经是导致食管癌发病率高的一个重要的病因学因素[5-8], 更多研究证明HPV存在于食管鳞癌的早期发生过程中, 有望成为食管癌早期诊断的分子生物学指标之一. 新疆哈萨克族是我国食管癌的高发民族, 已有研究提示HPV16在哈萨克族食管癌中的感染率达到40%[9]. 然而, HPV在食管癌中的报道至今仍存在争议, 在0-100%之间均有一些报道[10], 原因可能是检测感染率的方法不同引起的. 本次研究首次应用巢式PCR法检测新疆哈萨克族食管癌中HPV的感染率, 对新疆哈萨克族感染HPV的阳性率进行初步筛查, 以期发现HPV与新疆哈萨克族食管癌高发的关系, 并为后期进行哈萨克族食管癌HPV基因芯片的检测做好准备工作.
本实验采用1∶1病例对照, 共收集132例食管组织作为研究对象, 来自本课题组新疆伊犁哈萨克族聚集地-新源县现场, 及新疆伊犁哈萨克族自治州友谊医院、兵团农四师医院和新源县人民医院于2009-2011年收集的标本. 所有病例均未作任何化学、放射治疗, 66例食管癌组织均经病理组织学确诊为鳞状细胞癌, 其中男37例, 女29例, 平均年龄56(45-67)岁. 收集66例未患食管癌的哈萨克族正常食管组织作为对照组, 其中男41例, 女25例, 年龄30-68岁, 平均年龄49岁. DNA提取试剂盒购自QIAGEN公司; 内参β-actin引物、G5+/6+及MY09/11均由上海生物工程有限公司合成; PCR试剂购自北京天根生化科技有限公司; PCR扩增仪T-G ra-dient Thermoblock型(Biometra, 德国); GelDoc凝胶成像分析仪(Bio-Rad, 美国).
1.2.1 DNA的提取: 采用美国QIAGEN DNA Micro Kit试剂盒, 具体步骤: 将重量约为2-3 mg的食管黏膜置于1.5 mL EP管; 加入180 μL的ATL缓冲液和20 μL的蛋白酶K, 振荡混匀15 s后, 置于56 ℃水浴锅里过夜; 次日加入200 μL的AL缓冲液, 振荡混匀15 s; 加入200 μL酒精, 振荡15 s后室温静置5 min; 将所有液体转移到离心柱里, 以8 000 r/min离心1 min; 加入500 μL AW1缓冲液, 以8 000 r/min离心1 min; 加入500 μL AW2缓冲液, 以8 000 r/min离心1 min; 以14 000 r/min离心3 min后将离心柱置于1.5 μL的EP管; 加入30 μL的AE缓冲液后离心. 所有DNA均经过分光光度计进行浓度及纯度测量, A260/A280在1.7-2.1之间, DNA浓度平均在100 μg/L, 均为合格样本. 提取DNA.
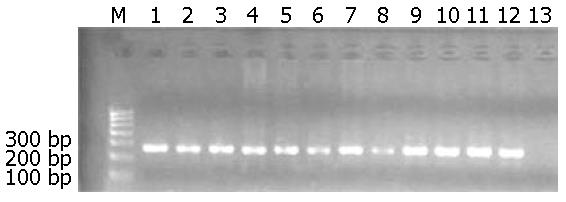
1.2.2 内参检测DNA: 内参β-actin引物序列为上游: ctccatcctggcctcgctgt, 下游: rgctgtcaccttcaccgttcc, 扩增片段为268 bp. 反应条件为: 94 ℃ 5 min预变性, 94 ℃ 30 s→58 ℃ 45 s→72 ℃ 45 s, 35个循环, 72 ℃延伸10 min. 应用内参行PCR.
1.2.3 巢式PCR法: 此法采用两种HPV通用引物分别为: G5+/6+和MY09/11, 引物具体序列见表1. 所有PCR体系均采用25 μL的反应体系. 试验采用宫颈癌阳性标本作为对照, 调整PCR反应条件. PCR方法: 首先采用MY09/11进行首次PCR, 10×Reaction Buffer 2.5 μL, dNTP 2.5 μL(200 mmol/L), 引物1 μL(0.15 mmol/L), Taq酶0.5 μL, DNA 2.5 μL(平均50 μg/L); ddH2O 16 μL. 反应条件为: 94 ℃ 5 min预变性, 94 ℃ 30 s→57 ℃ 30 s→72 ℃ 45 s, 35个循环, 72 ℃延伸10 min. 再将扩增产物作为模板, 用G5+/6+进行巢式PCR, 反应条件为: 94 ℃ 5 min预变性, 94 ℃ 30 s→58 ℃ 30 s→72 ℃ 45 s, 35个循环, 72 ℃延伸10 min. 取出3 μL PCR反应产物, 用2%琼脂糖电泳, 5×Loading Buffer进行染色, 紫外线灯下分析结果. 用MY09/11进行首次PCR. 用G5+/6+进行巢式PCR.
| 引物 | 5'-3'序列 | 基因位置 | 长度(bp) | 扩增大小(bp) |
| HPV/MY09 | CGTCCMARRGGAWACTGATCa | L1 | 20 | 398 |
| HPV/MY11 | GCMCAGGGWCATAAYAATGGa | 20 | 398 | |
| HPV/G5+ | TTTGTTACTGTGGTAGATACTAC | L1 | 23 | 150 |
| HPV/G6+ | GAAAAATAAACTGTAAATCATATTC | 25 | 150 |
统计学处理 采用SPSS13.0统计软件进行处理. 阳性率的比较采用χ2检验, 检验水准α = 0.05.
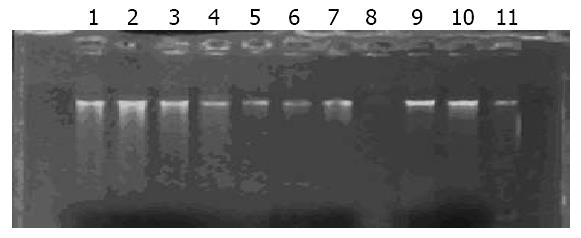
对提取的组织DNA的完整性进行电泳检测如图1, PCR检测内参表达结果如图2.
食管鳞癌中HPV感染率无性别差异(表2).
| 性别 | n | 阳性 | 阴性 | 阳性率(%) | χ2值 | P值 |
| 男性 | 37 | 28 | 9 | 64.86 | ||
| 女性 | 29 | 24 | 5 | 64.96 | 0.12 | >0.05 |
| 总数 | 66 | 52 | 14 | 66.67 |
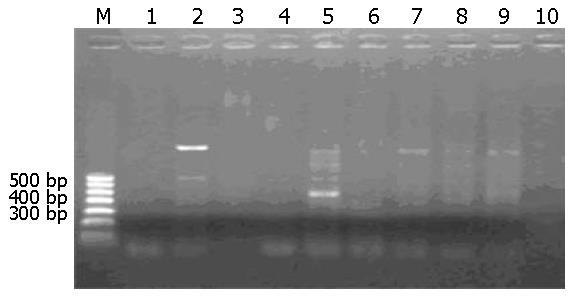
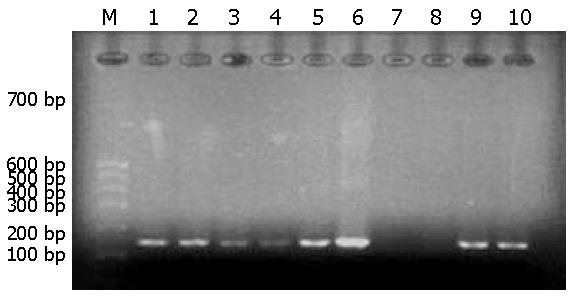
用MY09/11进行首次PCR并结合G5+/6+进行巢式PCR的结果如图3, 图4. 行巢式PCR后可检测到食管癌组HPV感染率为66.67%, 对照组为12.12%. 根据表的χ2检验, 可得到P<0.05, 表明新疆哈萨克族食管癌感染HPV的阳性率明显高于正常对照组, 两者阳性率差异具有统计学意义(表3).
| 分组 | 阳性 | 阴性 | 阳性率(%) | χ2值 | P值 |
| 食管癌组 | 44 | 22 | 66.67 | ||
| 正常组 | 8 | 58 | 12.12 | 41.12 | <0.05 |
HPV是一类双链闭合环状DNA病毒, 基因组约为8 000 bp[11], HPV DNA基因组按其功能分为3个编码区: (1)早期基因编码参与病毒DNA复制、转录及细胞转化的蛋白; (2)晚期基因编码病毒结构蛋白; (3)上游调节区位于E区和L区之间, 包含启动子等调控元件, 与病毒DNA复制转录的调控有关[12]. 现已经明确基因组全序列有80多种DNA病毒分型[13]. 其中15种高危致病亚型包括HPV-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73和82[14,15], 与多种良恶性肿瘤有关[16], 例如宫颈癌、肺癌、头颈部癌、消化系肿瘤等. 目前已有证实HPV16和HPV18病毒分型与食管癌相关. 但是, 关于新疆食管癌高发民族-哈萨克族感染HPV的相关研究, 目前知之甚少.
本实验应用通用引物MY09/11行PCR后, 食管癌组HPV感染率仅为7.58%, 正常对照组均为阴性, 阳性率偏低. 再次应用通用引物GP5+/6+进行巢式PCR时就能出现明显的扩增产物, 食管癌组和对照组HPV感染率分别为66.67%和12.12%, 两组阳性率均明显增高. 表明巢式PCR法明显提高了灵敏度, 说明PGMY/GP方法是灵敏而可靠的[17]. 阳性率提高的原因是因为MY09/11和GP5+/6+是从HPV-L1区中选择保守序列设计合成通用引物, 该引物与6, 11, 16, 18, 33型有互补序列, 可扩增其他型别的HPV[18]. 本实验应用2种通用引物巢式PCR法一次检测包括HPV6, 11, 16, 18, 31, 33, 35, 39, 40, 42, 45, 52, 53, 56和58共15个病毒型别, 初步筛查了新疆哈萨克族食管鳞癌的HPV感染率. 此外, 本次研究发现新疆哈萨克族食管鳞癌与HPV的关系, 根据实验结果哈萨克族食管癌HPV感染率无男女性别差异.
本次实验结果显示新疆哈萨克族食管癌中HPV的感染率为66.67%, 与端木忠等[19]的汉族食管癌HPV感染率38.3%相比较高. 本实验结果与国内外相关实验不符的原因, 考虑存在以下3方面因素: (1)HPV感染可能存在种族差异; (2)HPV在正常人群消化系中都有一定的感染率, 具有自限性, 大部分感染是暂时的. 当机体的防御机制改变或者宿主的基因发生突变时, HPV感染可发生恶性转化. 而新疆哈萨克族生存环境较差, 饮食单一, 缺乏叶酸、维生素等营养物质, 又好食烫、咸奶茶, 结合肿瘤的发生是由多种因素共同作用形成[20], 故考虑新疆哈萨克族食管癌中HPV的高感染率可能由于抑癌基因的失活、癌基因的激活等因素共同作用导致; (3)本次实验结果HPV感染率高可能为检测方法不同导致的, 本实验应用通用引物巢式PCR法一次可检测15种病毒型别在食管癌中感染率, 较单独设计15种病毒型别的引物检测HPV感染率更加方便、可靠, 当然, 此方法的不足之处是无法明确每个阳性标本中具体感染哪一种病毒分型, 或者是同时感染哪几种病毒分型.
总之, HPV感染是新疆哈萨克族食管鳞癌发生的重要危险因素之一, HPV可能是新疆哈萨克族食管癌发生的一个重要病因学因素. 本次实验筛选出食管鳞癌组感染HPV的阳性标本后, 后续将针对阳性标本进行含有23种型别探针的基因芯片的检查, 以期发现与新疆哈萨克族食管癌发生密切相关的特异性HPV高危致病亚型, 为食管癌的分子生物学机制提供理论基础.
人乳头瘤病毒(HPV)是双链DNA病毒, 与多种恶性肿瘤相关, 包括食管癌、口腔癌和肺癌等. 然而, HPV在恶性肿瘤中的发病机制仍存在争议.
任浩, 副教授, 中国人民解放军第二军医大学微生物学教研室
HPV已经是导致食管癌发病率高的一个重要的病因学因素, 更多研究证明HPV存在于食管鳞癌的早期发生过程中, 有望成为食管癌早期诊断的分子生物学指标之一.
本实验应用通用引物巢式PCR法初步筛查了新疆哈萨克族食管鳞癌的HPV感染率并发现新疆哈萨克族食管鳞癌与HPV的关系.
本研究具有较强的创新性和较好的临床应用价值, 为HPV与食管癌及后者的早期诊治提供了一定依据.
编辑: 张姗姗 电编: 闫晋利
| 1. | 廖 佩花, 谭 晓华, 张 海峰, 雷 丽娟, 曾 同霞, 陈 波, 李 锋, 杨 磊, 秦 江梅. HPV6b感染与新疆哈萨克族食管癌的关系. 世界华人消化杂志. 2009;17:194-197. [DOI] |
| 2. | Tew WP, Kelsen DP, Ilson DH. Targeted therapies for esophageal cancer. Oncologist. 2005;10:590-601. [PubMed] [DOI] |
| 3. | Herrera-Goepfert R, Lizano M, Akiba S, Carrillo-García A, Becker-D'Acosta M. Human papilloma virus and esophageal carcinoma in a Latin-American region. World J Gastroenterol. 2009;15:3142-3147. [PubMed] [DOI] |
| 4. | Gao GF, Roth MJ, Wei WQ, Abnet CC, Chen F, Lu N, Zhao FH, Li XQ, Wang GQ, Taylor PR. No association between HPV infection and the neoplastic progression of esophageal squamous cell carcinoma: result from a cross-sectional study in a high-risk region of China. Int J Cancer. 2006;119:1354-1359. [PubMed] [DOI] |
| 5. | Wang X, Tian X, Liu F, Zhao Y, Sun M, Chen D, Lu C, Wang Z, Shi X, Zhang Q. Detection of HPV DNA in esophageal cancer specimens from different regions and ethnic groups: a descriptive study. BMC Cancer. 2010;10:19-29. [PubMed] [DOI] |
| 6. | Mammas IN, Sourvinos G, Zaravinos A, Spandidos DA. Vaccination against human papilloma virus (HPV): epidemiological evidence of HPV in non-genital cancers. Pathol Oncol Res. 2011;17:103-119. [PubMed] [DOI] |
| 7. | Afonso LA, Moysés N, Cavalcanti SM. Human papillomavirus detection and p16 methylation pattern in a case of esophageal papilloma. Braz J Med Biol Res. 2010;43:694-696. [PubMed] [DOI] |
| 8. | 马 群风, 江 红, 冯 永强, 王 小平, 周 勇安, 刘 锟, 贾 再利. 人食管鳞状细胞癌标本中乳头状瘤病毒DNA的检测. 世界华人消化杂志. 2000;8:1218-1224. [DOI] |
| 9. | Ayshamgul H, Ma H, Ilyar S, Zhang LW, Abulizi A. Association of defective HLA-I expression with antigen processing machinery and their association with clinicopathological characteristics in Kazak patients with esophageal cancer. Chin Med J (Engl). 2011;124:341-346. [PubMed] |
| 10. | Bohn OL, Navarro L, Saldivar J, Sanchez-Sosa S. Identification of human papillomavirus in esophageal squamous papillomas. World J Gastroenterol. 2008;14:7107-7111. [PubMed] [DOI] |
| 11. | Kusumoto-Matsuo R, Kanda T, Kukimoto I. Rolling circle replication of human papillomavirus type 16 DNA in epithelial cell extracts. Genes Cells. 2011;16:23-33. [PubMed] [DOI] |
| 12. | Rachel Raybould, Alison Fiander, Sam Hibbitts. Human Papillomavirus Integration and its Role in Cervical Malignant Progression. The Open Clinical Cancer Journal. 2011;5:1-7. [DOI] |
| 13. | Steben M, Duarte-Franco E. Human papillomavirus infection: epidemiology and pathophysiology. Gynecol Oncol. 2007;107:S2-S5. [PubMed] [DOI] |
| 14. | Alba A, Cararach M, Rodríguez-Cerdeira C. The Human Papillomavirus (HPV) in Human Pathology: Description, Pathogenesis, Oncogenic Role, Epidemiology and Detection Techniques. The Open Dermatology Journal. 2009;3:90-102. [DOI] |
| 15. | Jalal H, Stephen H, Bibby DF, Sonnex C, Carne CA. Molecular epidemiology of genital human papillomavirus and Chlamydia trachomatis among patients attending a genitourinary medicine clinic - will vaccines protect? Int J STD AIDS. 2007;18:617-621. [PubMed] [DOI] |
| 16. | 姜 蕊, 吴 翠环, 郑 丽端, 赵 时宇, 陈 多恩. 人乳头瘤病毒感染与非小细胞肺癌发生的相关性. 华中科技大学学报(医学版). 2005;34:141-144 19 端木忠, 田韧, 曹秀峰. HPV与食管癌的关系. 实用医技杂志 2005; 12: 11-12. |
| 17. | Winder DM, Ball SL, Vaughan K, Hanna N, Woo YL, Fränzer JT, Sterling JC, Stanley MA, Sudhoff H, Goon PK. Sensitive HPV detection in oropharyngeal cancers. BMC Cancer. 2009;9:440. [PubMed] [DOI] |
| 18. | Cobo F, Talavera P, Concha A. Review article: relationship of human papillomavirus with papillary squamous cell carcinoma of the upper aerodigestive tract: a review. Int J Surg Pathol. 2008;16:127-136. [PubMed] [DOI] |
| 20. | Lu Y, Zhang Z, Liu Q, Liu B, Song X, Wang M, Zhao X, Zhao Q. Immunological protection against HPV16 E7-expressing human esophageal cancer cell challenge by a novel HPV16-E6/E7 fusion protein based-vaccine in a Hu-PBL-SCID mouse model. Biol Pharm Bull. 2007;30:150-156. [PubMed] [DOI] |