修回日期: 2012-02-17
接受日期: 2012-03-06
在线出版日期: 2012-04-18
目的: 探讨钼对食管癌细胞ECA-109化疗敏感性的影响及对食管癌干细胞p75NTR作用.
方法: 本实验选用人食管癌细胞(esophageal cancer cells, ECCs)ECA-109. 设计分为4组: 空白对照组、顺铂组、单纯加钼组、顺铂加钼组, 后3组均采用不同的浓度进行试验. 用MTT法检测各组对人食管癌细胞ECA-109的生长抑制作用; 流式细胞仪检测各组p75NTR百分率的变化.
结果: 顺铂组各浓度对食管癌细胞ECA-109有一定的抑制作用, 且对食管癌干细胞也有不同程度的抑制作用, 并且随着给药浓度和时间的增加均呈增强趋势; 单纯加钼组对食管癌细胞ECA-109和对食管癌干细胞的抑制作用均不明显; 顺铂加钼组对食管癌细胞ECA-109和食管癌干细胞的抑制作用则明显增强, 与单用同浓度顺铂组及空白对照组比较有差异性(P<0.05), 且呈一定的浓度、时间依赖性.
结论: 钼可明显增强顺铂对食管癌细胞ECA-109和食管癌干细胞的抑制作用, 而单用钼则达不到理想的效果, 说明钼可作为化疗增敏剂, 为其作为食管癌化疗的辅助剂提供了实验依据.
引文著录: 李珂, 龙辉, 王洁莲, 吴清明, 吴银霞, 程静. 钼对人食管癌细胞ECA-109的化疗增敏作用及对食管癌干细胞p75NTR的影响. 世界华人消化杂志 2012; 20(11): 959-963
Revised: February 17, 2012
Accepted: March 6, 2012
Published online: April 18, 2012
AIM: To investigate the effect of molybdenum on the chemosensitivity of esophageal cancer ECA-109 cells to cisplatin and expression of p75NTR in esophageal stem cells.
METHODS: ECA-109 cells were divided into four groups: blank control group, cisplatin group, molybdenum group, cisplatin plus molybdenum group. Cell proliferation was measured by methyl thiazolyl tetrazolium (MTT) assay. The expression of p75NTR in human esophageal stem cells was examined by flow cytometry.
RESULTS: Cisplatin reduced the percentage of p75NTR-positive cells and the proliferation of ECA-109 cells in a dose-dependent manner. Treatment with molybdenum alone had no significant influence on the proliferation of ECA-109 cells and the percentage of p75NTR-positive cells. However, treatment with molybdenum significantly enhanced the chemosensitivity of esophageal cancer ECA-109 cells to cisplatin and cisplatin-induced inhibition of p75NTR expression in esophageal stem cells when compared to cells incubated with cisplatin alone or blank control cells (all P < 0.05).
CONCLUSION: Molybdenum can increase the inhibitory effect of cisplatin on the proliferation of ECA-109 cells, which provides an experimental basis for the use of molybdenum as adjuvant chemotherapeutic agent for esophageal cancer.
- Citation: Li K, Long H, Wang JL, Wu QM, Wu YX, Cheng J. Molybdenum increases chemosensitivity of ECA-109 cells to cisplatin and cisplatin-induced inhibition of p75NTR expression in esophageal stem cells. Shijie Huaren Xiaohua Zazhi 2012; 20(11): 959-963
- URL: https://www.wjgnet.com/1009-3079/full/v20/i11/959.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i11.959
食管癌(esophageal carcinoma, ECC)是世界上最常见的恶性肿瘤之一, 据世界癌症研究基金会(world cancer research fund, WCRF)统计, 食管癌居全球癌症发病率第7位, 存活率较低[1-4]. 钼(Molybdenum, Mo)作为人体所必需的微量元素之一, 在现代医学研究中逐渐成为人类治癌、防癌研究中最为关注的领域[5,6]. 很多研究资料表明, 钼与食管癌的发生发展有着密切的联系. 食管癌患者在化疗过程中很容易出现耐受性, 无法达到令人满意的治疗效果. 经研究发现, 治疗过程中患者出现的耐受性与食管癌干细胞密切相关. 而肿瘤干细胞(cancer stem cell, CSC)则是存在于肿瘤组织中的一小部分具有干细胞性质的细胞群体. 近年来, 越来越多的学者认为肿瘤干细胞的残存是恶性肿瘤复发的根源[7,8]. 本文主要研究钼是否对食管癌化疗具有增敏作用及钼是否抑制食管癌干细胞, 目前国内外关于钼对食管癌干细胞作用这方面的研究还比较欠缺.
人食管癌细胞株ECA-109由太和医院馈赠; RPMI-1640培养粉购自Gibco公司; 新生胎牛血清购自杭州四季青有限公司; 胰蛋白酶粉购自Amresco公司; CO2恒温细胞培养箱购自Heal Force公司; 倒置显微镜购自Olympus公司; 超净工作台(苏州净化); 酶联免疫检测仪(美国宝特ELX800); 超速低温离心机购自Sigma公司; 37 ℃恒温水浴箱购自华普达公司; 钼酸铵购自天津化学试剂工厂; 顺铂购自齐鲁制药有限公司; 免疫组织化学试剂盒及DAB显色液购自中杉公司; p75NTR直标抗体购自BD公司; 鼠抗人C-myc蛋白单克隆抗体购自博士德公司; 流式细胞仪购自BECKMAN COULTER公司.
1.2.1 细胞培养: 食管癌细胞ECA-109常规培养于RPMI-1640(含100 mL/L胎牛血清)中, 置37 ℃、50 mL/L CO2培养箱内培养, 注明细胞名称及日期.
1.2.2 MTT法检测钼对食管癌细胞ECA-109增殖抑制作用: 取对数生长期的食管癌细胞ECA-109, 接种于96孔板中, 分为: (1)空白组: 只接种细胞未加试剂; (2)顺铂组: 加入顺铂10 mg/L, 20 mg/L, 30 mg/L, 40 mg/L, 50 mg/L; (3)单纯加钼组: 加入钼18.75 mg/L, 37.5 mg/L, 75 mg/L, 150 mg/L, 300 mg/L; (4)顺铂加钼组: 顺铂根据(1)步实验取用适宜浓度30 mg/L, 依次加入顺铂30 mg/L+钼酸铵18.75 mg/L, 顺铂30 mg/L+钼酸铵37.5 mg/L, 顺铂30 mg/L+钼酸铵75 mg/L, 顺铂30 mg/L+钼酸铵150 mg/L, 顺铂30 mg/L+钼酸铵300 mg/L, 每组每个浓度每个时间点6个复孔, 置37 ℃、50 mL/L CO2培养箱内培养, 于24 h、48 h、72 h、96 h后吸去上清, 并用PBS清洗1遍后加入RPMI-1640培养液, 再将MTT溶液(5 g/L)10 μL加入至每孔, 继续在37 ℃、50 mL/L CO2培养箱内孵育4 h后弃上清. 每孔加入100 μL DMSO, 放入摇床轻轻振荡10 min, 使结晶物充分溶解, 在590 nm波长酶标仪上测定吸光度(A)值, 并记录结果, 计算出细胞生长抑制率, 抑制率(IR) = (1-实验组平均A490值/对照组平均A490值)×100%.
1.2.3 流式细胞仪检测p75NTR细胞比例: 取用对数期生长的细胞, 分为: (1)顺铂组: 加入顺铂5 mg/L, 10 mg/L, 20 mg/L, 30 mg/L, 40 mg/L, 50 mg/L; (2)单纯加钼组: 加入钼18.75 mg/L, 37.5 mg/L, 75 mg/L, 150 mg/L, 300 mg/L; (3)顺铂加钼组: 加入顺铂30 mg/L+钼酸铵18.75 mg/L, 顺铂30 mg/L+钼酸铵37.5 mg/L, 顺铂30 mg/L+钼酸铵75 mg/L, 顺铂30 mg/L+钼酸铵150 mg/L, 顺铂30 mg/L+钼酸铵300 mg/L, 培养24 h后取出用PBS冲洗, 0.25%的胰蛋白酶消化, 1 000 r/min, 离心5 min弃上清, 再加入PBS冲洗离心2-3次, 把处理好的细胞加入20 μL p75NTR直标抗体, 充分混匀, 避光放置25 min, 再每管加入500 μL鞘液, 滤膜过滤, 即可上流式细胞仪进行检测.
统计学处理 全部资料采用SPSS 17.0统计软件分析, 所有计数资料以mean±SD表示, 均数间差异采用方差分析, 两两比较采用t检验, 显著性水准为0.05.
顺铂组各浓度梯度对食管癌细胞ECA-109均有一定程度的抑制作用, 随着作用浓度和时间的增加其抑制作用也不断增强(表1).
顺铂组各浓度均对食管癌干细胞p75NTR有抑制作用, 随着作用浓度和时间的增加其抑制作用也不断增强. 本实验中给予高浓度顺铂(>10 mg/L)作用后, p75NTR细胞的百分率则呈现逐步下降的趋势. 给予5 mg/L的顺铂后, 测得24 h食管癌细胞ECA-109的p75NTR细胞的百分率为6.8%, 而用10 mg/L的顺铂测得p75NTR细胞的百分率为7.9%, 之后分别给予20 mg/L、30 mg/L、40 mg/L、50 mg/L的顺铂后, 测得p75NTR细胞的百分率分别为5.5%、3.0%、1.9%、0.8%, 呈逐渐下降的趋势. 说明>10 mg/L的高浓度顺铂对食管癌干细胞具有较强的杀伤作用.
加入不同浓度的钼处理细胞后, 发现钼对食管癌细胞ECA-109无明显抑制作用, 增加钼的浓度为300 mg/L时, 细胞出现极少量的死亡, 再增至600 mg/L时, 其对ECA-109的增殖抑制作用才比较明显. 考虑可能为单纯的化学反应, 而高浓度的钼也不能运用于临床, 会产生不良反应, 对临床应用价值不大. 与空白组以及单用顺铂的对照组比较, 差异无统计学意义(P>0.05).
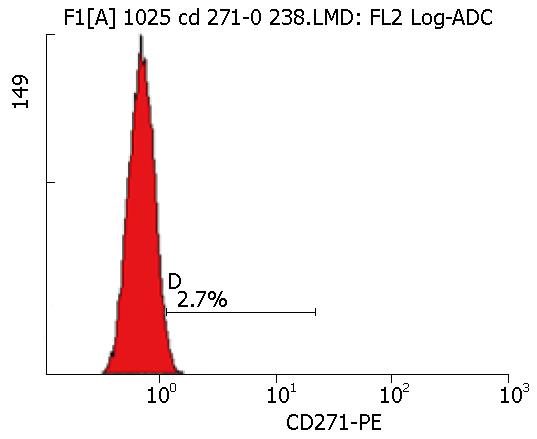
钼组测得24 h p75NTR的百分率分别为2.9%、2.8%、2.4%、2.6%、2.5%, 而空白组p75NTR的百分率为2%-3%(图1), 说明单独加钼组对食管癌干细胞并无明显影响, 且无统计学意义.
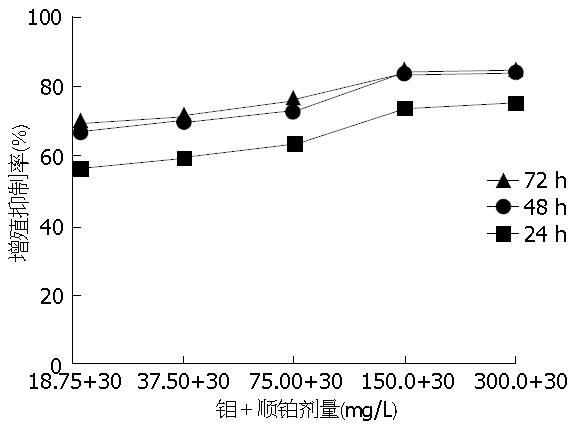
各浓度顺铂加钼组与顺铂组相比, 对于食管癌细胞ECA-109的抑制作用则更强, 与未经任何试剂处理的空白组以及单用顺铂的对照组比较, 差异有统计学意义(P<0.05), 且呈一定的浓度、时间依赖性(表2). 顺铂加钼浓度为30 mg/L+150 mg/L作用72 h对ECA-109细胞抑制作用最强(图2).
p75NTR细胞的比例比单用30 mg/L的顺铂测得的干细胞百分率的减少更为明显, 进而发现在给予150 mg/L的钼加顺铂后, p75NTR的百分率从2.7%下降为0.6%, 之后再加大钼的浓度300 mg/L时测得p75NTR的百分率为0.5%, 下降趋势并没有比较明显的增加, 说明150 mg/L的钼和顺铂联合应用对食管癌干细胞杀伤效果最强, 而继续增加钼的剂量对于食管癌干细胞的影响则不太明显(表3).
| 顺铂+钼(mg/L) | 30+18.75 | 30+37.5 | 30+75 | 30+150 | 30+300 |
| p75NTR (%) | 2.5 | 1.9 | 1.4 | 0.6 | 0.5 |
越来越多的研究资料表明, 钼与食管癌有着紧密的联系, 据陈伯扬[4]等的调查发现食管癌高发区饮水与作物中普遍缺钼, 河南省林县是有名的食道癌高发区, 应用光谱分析河南省7个县的粮食样品, 发现食管癌高发地区林县的粮食中钼的含量低于其他县[9,10]. 钼在人体内主要通过影响钼酶的活性来实现其生物学功能. 钼是在新陈代谢中起重要作用的2种酶的组成成分, 一是黄嘌呤氧化酶, 二是亚硫酸盐氧化酶. 这几种酶对人体中的氧化代谢、铁代谢及毒性醛类的解除具有重要的生化功能; 同时钼是植物亚硝酸盐还原酶的成分, 缺钼直接导致作物中亚硝酸盐的增加, 为合成亚硝胺提供前体; 此外, 钼可调节体内的铁代谢, 促使肝脏铁蛋白中铁释放入血浆, 催化Fe2+转化为Fe3+, 并与β1-球蛋白结合成运铁蛋白供机体利用. 钼还是醛氧化酶的组分, 醛氧化酶参与细胞内的电子传递过程和体内醛的氧化, 将醛氧化成羧酸, 消除有毒醛类物质对人体的危害[11].
肿瘤干细胞是肿瘤复发、转移、耐药及放疗抵抗的根源, 众多研究资料表明干细胞与癌症治疗的耐受性有关[12-16], p75NTR是一种相对分子质量为75 kDa的蛋白受体, 属Ⅰ型跨膜TNF受体超家族成员, 可与NGF、BDNF、NT-3和NT-4等低亲合性结合, 在Trk存在条件下被活化, 提高对神经营养因子的反应性, 曾被用来分离神经冠干细胞等. Okumura等[17]研究证明, 正常食管上皮细胞中的p75NTR阳性细胞具有增殖、自我更新及多向分化能力, 经鉴定为食管上皮干细胞. 所以本实验选用食管癌干细胞p75NTR分选法分离出食管癌干细胞, 研究钼对其的抑制作用. 本实验结果显示, 钼联合顺铂对食管癌细胞ECA-109的增殖均有明显抑制作用, 与顺铂组和空白组比较有统计学意义(P<0.05), 且呈一定的浓度、时间依赖性; 随着浓度的增加, 时间的延长, 对食管癌细胞ECA-109的增殖抑制作用也明显增强. 而单用钼则对食管癌增殖抑制作用不太明显, 增加钼的浓度到600 mg/L时, 其抑制作用才比较显著. 考虑其高浓度对癌细胞的杀伤作用可能仅为单纯的化学反应, 在此不作细致研究. 所以钼本身不能作为一种单纯的化疗药物而是一种化疗增敏剂, 将他与化疗药物联用可以达到很好的增敏效果.
流式仪检测食管癌干细胞p75NTR的比例显示: 在高浓度(>10 mg/L)顺铂组中p75NTR细胞的比例随着化疗剂量的增加而逐渐减少, 证明高浓度的化疗药物不仅能杀死普通的食管癌细胞也能杀死部分肿瘤干细胞, 但是在给予低浓度的顺铂时(<10 mg/L)p75NTR的比例则会逐渐增加, 说明低浓度顺铂杀死的细胞多为普通食管癌细胞而对食管癌干细胞作用不大. 顺铂加钼组中p75NTR的百分率比单用同浓度的顺铂下降趋势则更为明显, 说明二者联用对食管癌干细胞的抑制作用更强, 钼对化疗药物有显著的增敏效果, 能够抑制食管癌干细胞p75NTR. 但是钼对于顺铂的化疗增敏作用其增敏机制尚不明确, 具体是作用于这个过程的哪个环节, 还不是特别清楚, 在这个方面还有待于进一步研究.
钼作为一种人体所必需的微量元素, 在现代医学研究中逐渐成为人类治癌、防癌研究中最为关注的领域. 目前人们对于钼的研究, 比较侧重于他对食管癌的预防作用.
张力为, 副教授, 新疆医科大学第一附属医院胸外科
钼作为人体必需的一种微量元素, 对生命的正常新陈代谢很重要, 缺少会引起疾病的发生, 过量则会出现毒理学反应. 有关钼中毒的资料极少, 如果人体内钼过多, 黄嘌呤氧化酶活性过多增加, 生产尿酸过多, 可导致痛风症.
本实验研究了钼对体外培养食管癌细胞ECA-109化疗敏感性的影响和化疗时加钼对食管癌干细胞P75NTR的作用, 说明钼可作为化疗增敏剂, 使其作为食管癌化疗的辅助剂提供了实验依据.
本研究选题较好, 有一定创新, 设计尚合理, 思路清晰, 对临床上食管癌的化疗提供了较好的参考价值.
编辑: 张姗姗 电编: 鲁亚静
| 1. | Zhao Y, Hong L, Wang R, Fan D. Expression and prognostic value of ZNRD1 in esophageal squamous cell carcinoma. Dig Dis Sci. 2009;54:586-592. [PubMed] [DOI] |
| 2. | Wu L, Xu Z, Zhao X, Li J, Sun Y. Surgical treatment and prognosis of esophageal cancer after distal gastrectomy. J Gastrointest Surg. 2010;14:32-37. [PubMed] [DOI] |
| 5. | Nath M, Offers M, Hummel M, Seissler J. Isolation and in vitro expansion of Lgr6-positive multipotent hair follicle stem cells. Cell Tissue Res. 2011;344:435-444. [PubMed] [DOI] |
| 6. | Jeong SH, Han JH, Kim JH, Ahn MS, Hwang YH, Lee HW, Kang SY, Park JS, Choi JH, Lee KJ. Bax predicts outcome in gastric cancer patients treated with 5-fluorouracil, leucovorin, and oxaliplatin palliative chemotherapy. Dig Dis Sci. 2011;56:131-138. [PubMed] [DOI] |
| 7. | Li SH, Wang Z, Liu XY. Metastasis-associated protein 1 (MTA1) overexpression is closely associated with shorter disease-free interval after complete resection of histologically node-negative esophageal cancer. World J Surg. 2009;33:1876-1881. [PubMed] [DOI] |
| 9. | Ulla M, Cavadas D, Muñoz I, Beskow A, Seehaus A, García-Mónaco R. Esophageal cancer: pneumo-64-MDCT. Abdom Imaging. 2010;35:383-389. [PubMed] [DOI] |
| 10. | Jensen AD, Grehn C, Nikoghosyan A, Thieke C, Krempien R, Huber PE, Debus J, Münter MW. Catch me if you can--the use of image guidance in the radiotherapy of an unusual case of esophageal cancer. Strahlenther Onkol. 2009;185:469-473. [PubMed] [DOI] |
| 12. | Oelschlager BK. Intramucosal esophageal cancer and high-grade dysplasia: which treatment frame the debate. J Gastrointest Surg. 2009;13:1169-1171. [PubMed] [DOI] |
| 13. | Marjanovic G, Schricker M, Walch A, zur Hausen A, Hopt UT, Imdahl A, Makowiec F. Detection of lymph node involvement by cytokeratin immunohistochemistry is an independent prognostic factor after curative resection of esophageal cancer. J Gastrointest Surg. 2011;15:29-37. [PubMed] [DOI] |
| 14. | Hatiboglu MA, Wei J, Wu AS, Heimberger AB. Immune therapeutic targeting of glioma cancer stem cells. Target Oncol. 2010;5:217-227. [PubMed] [DOI] |
| 15. | Barnes M, Eberhart CG, Collins R, Tihan T. Expression of p75NTR in fetal brain and medulloblastomas: evidence of a precursor cell marker and its persistence in neoplasia. J Neurooncol. 2009;92:193-201. [PubMed] [DOI] |
| 16. | Sugiura A, Ohtori S, Yamashita M, Yamauchi K, Inoue G, Suzuki M, Norimoto M, Orita S, Eguchi Y, Kuniyoshi K. Effect of applying p75NTR saporin to a punctured intervertebral disc on calcitonin gene-related peptide expression in rat dorsal root ganglion neurons. J Orthop Sci. 2010;15:407-413. [PubMed] [DOI] |